- 883.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
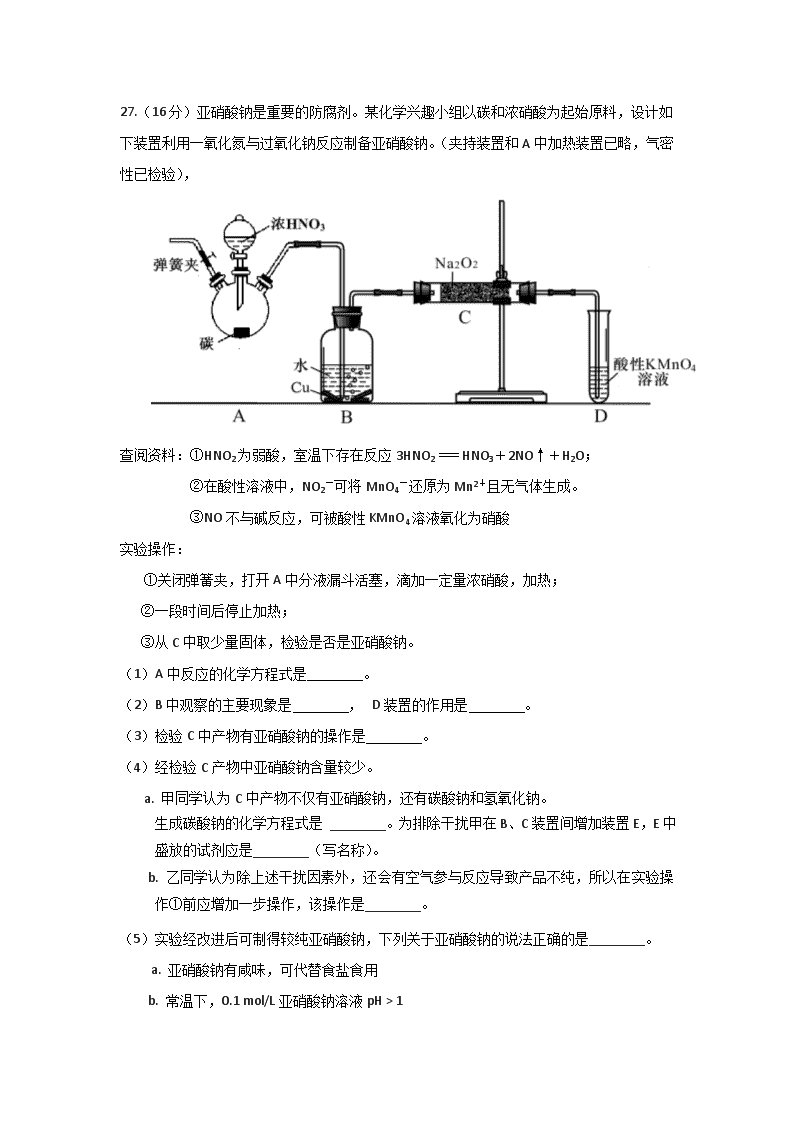
27.(16分)亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如
下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密
性已检验),
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)A中反应的化学方程式是 。
(2)B中观察的主要现象是 , D装置的作用是 。
(3)检验C中产物有亚硝酸钠的操作是 。
(4)经检验C产物中亚硝酸钠含量较少。
a. 甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。
生成碳酸钠的化学方程式是 ________。为排除干扰甲在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
b. 乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是________。
(5)实验经改进后可制得较纯亚硝酸钠,下列关于亚硝酸钠的说法正确的是________。
a. 亚硝酸钠有咸味,可代替食盐食用
b. 常温下,0.1 mol/L亚硝酸钠溶液pH > 1
c. 0.1 mol/L亚硝酸钠溶液中存在:c(Na+) + c(H+) = c(NO2— ) + c(OH— )
d. 0.1 mol/L亚硝酸钠溶液中存在:c(NO2— ) > c(Na+) > c(OH— ) > c(H+)
27. (16)(每空2分)
(1) C +4HNO3 (浓) CO2↑+ 4NO2↑+ 2H2O
(2) 溶液变蓝,铜片溶解,导管口有无色气体冒出;除去未反应的NO,防止污染空气
(3)方法Ⅰ:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠。反应的离子方程式是3NO2-+2H+=NO3-+2NO↑+H2O
方法Ⅱ:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,反应的离子方程式是5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O
(4) a. 2CO2 + 2Na2O2 ===2Na2CO3 + O2 ,碱石灰
b. 打开弹簧夹,通入N2一段时间
(5)b c
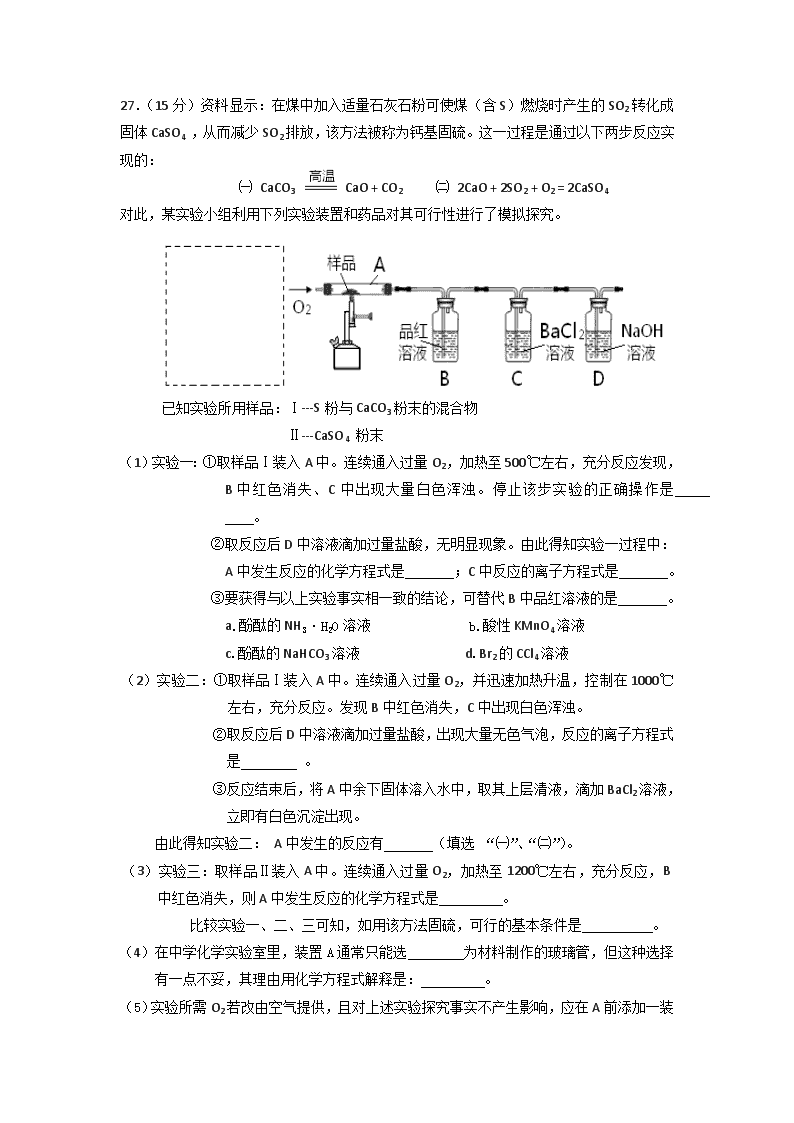
27.(15分)资料显示:在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4 ,从而减少SO2排放,该方法被称为钙基固硫。这一过程是通过以下两步反应实现的:
㈠ CaCO3 CaO + CO2 ㈡ 2CaO + 2SO2 + O2 = 2CaSO4
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。
已知实验所用样品:Ⅰ---S粉与CaCO3粉末的混合物
Ⅱ---CaSO4 粉末
(1)实验一:①取样品Ⅰ装入A中。连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊。停止该步实验的正确操作是 。
②取反应后D中溶液滴加过量盐酸,无明显现象。由此得知实验一过程中:
A中发生反应的化学方程式是 ;C中反应的离子方程式是 。
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是 。
a.酚酞的NH3·H2O溶液 b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液 d.Br2的CCl4溶液
(2)实验二:①取样品Ⅰ装入A中。连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应。发现B中红色消失,C中出现白色浑浊。
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是 。
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现。
由此得知实验二: A中发生的反应有 (填选 “㈠”、“㈡”)。
(3)实验三:取样品Ⅱ装入A中。连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是 。
比较实验一、二、三可知,如用该方法固硫,可行的基本条件是 。
(4)在中学化学实验室里,装置A通常只能选 为材料制作的玻璃管,但这种选择有一点不妥,其理由用化学方程式解释是: 。
(5)实验所需O2
若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置。请将该药品和装置图示在图中的虚线框内。
27.(15分)
(1)① 撤掉喷灯,继续通入O2至A冷却 ----------------------------------------- (1分)
② S + O2 SO2 ---------------------------------------------------------(1分)
2SO2 + 2H2O + O2 + 2Ba2+ = 2BaSO4↓+ 4H+ -----------------------------(2分)
③ a、b --------------------------------------------------------------------------------(2分)
(2)② CO32- + 2H+ = CO2 ↑+H2O -------------------------------------------------(1分)
③ (一)、(二)--------------------------------------------------------------------(1分)
(3)2CaSO42CaO + 2SO2↑+ O2 ↑ --------------------------------------------------(2分)
燃烧温度需1000℃左右 -------------------------------------------------------------(1分)
(4) 石英 , SiO2 + CaO CaSiO3 ---------------------------------------(2分)
(5)图略(装置+ 药品)--------------------------------------------------------------------(2分)
27.(15分) 某课外活动小组探究镁与CO2、NO2的反应
(1) 实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应
解释该现象 。
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:
写出Mg与NO2反应的化学方程式 。
Mg
弹簧夹
特种不锈
钢钢板
NO2
B
A
水
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)
资料信息:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
① 装置A中的试剂是 。
② 干燥管和装置B的作用分别是 、 。
③ 实验开始时正确的操作步骤是 。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红综色气体后,关闭弹簧夹
(4)实验结束时,同学们观察到与预测相符合的现象,但当用水洗涤硬质玻璃管时,固
体遇水产生有刺激性气味的气体,该气体能使湿润的石蕊试纸变蓝。
① 同学们认为硬质玻璃管中还发生了另一个反应,该反应为 。
② 请用化学方程式解释加水产生该气体的原因 。
27.(15分)
(1)2Mg + CO22MgO + C (2分)
(2)4Mg +2NO24MgO + N2 (2分)
(3) ① NaOH溶液(2分)
② 吸收NO2避免环境污染 (2分) 收集N2(2分)
③ badc(2分)
(4)① 3Mg + N2Mg3N2 (或7Mg +2NO24MgO +Mg3N2)(2分)
② Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑(1分)
27.(16分)某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
(1)D中产生NaHCO3的化学方程式是 。
(2)请结合化学平衡移动原理解释B中溶液的作用 。
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用):
① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 。
② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是 。
该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。
③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3 ,结合甲同学实验,还应补充的实验是 。
乙同学:利用仪器测定了固体残留率随温度变 化的曲线,如下图所示。
a. 根据A点坐标得到的结论是 。
b. 根据B点坐标,计算残留固体中
n(NaHCO3:n(Na2CO3))= 。
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。
27.(16分)
(1)Na2CO3+CO2+H2O == 2NaHCO3 (2分)
(2)CO2在水中存在平衡:CO2+H2OH2CO3HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
(3)
① Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3。(2分)
② 2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(2分)
合理(1分)
③ 接下来的操作:冷却到室温,加水至溶液体积为400 mL,再次测定pH(2分)
补充实验:取相同质量的纯净的NaHCO3配成1000 mL溶液,取400 mL,重复甲的实验,进行对照。(2分)
a.白色固体为NaHCO3 (2分)
b.71:42(或1.69)(1分)
27.(14分)
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H2O(l) DH1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq) DH2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议: 。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。
27.(14分)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)除去氯气中的氯化氢
(3)
(4)将盛NaOH溶液的洗气瓶浸在冰水中
(5)①b d
②向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
27.(16分)某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
实验操作
实验现象
I
打开活塞a,滴加氯水,关闭活塞a
A中溶液变为红棕色。
II
吹入热空气
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。
III
停止吹入空气,打开活塞b,逐滴加入H2O2溶液
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。
请回答下列问题:
(1)A中反应的离子方程式是_______。
(2)实验操作II吹入热空气的目的是_______。
(3)装置C的作用是_______,C中盛放的药品是_______。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式_______。
(5)由上述实验得出的结论是_______。
(6)实验反思:
① 有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_______。
② 实验操作III,开始时颜色无明显变化的原因是(写出一条即可):_______。
27.(16分,每空2分)
(1)2Br—+Cl2 = Br2 + 2Cl—
(2)吹出单质Br2
(3)吸收尾气 NaOH溶液
(4)H2O2 + 2Br—+2H+ = Br2+ 2H2O
(5)氧化性:H2O2 >Br2 >H2SO3
(6) ① 不干扰,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时无明显颜色变化,即能证明Br2氧化了H2SO3
② H2SO3有剩余(H2O2浓度小或Br—与H2O2反应慢等因素都可)
27.(14分)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:① H2S可溶于水(约1:2),其水溶液为二元弱酸。
② H2S可与许多金属离子反应生成沉淀。
③ H2S在空气中燃烧,火焰呈淡蓝色。
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
回答下列问题:
① A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为_________________。
② B中的现象是_________。
③ C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为_____。
④ D中盛放的试剂可以是____________(填标号)。
a. 水 b. 盐酸 c. NaCl溶液 d. NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验。
实验操作
实验现象
实验1
将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合
无明显现象
实验2
将H2S通入Na2SO3溶液中
未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀
实验3
将SO2通入Na2S溶液中
有浅黄色沉淀产生
已知:电离平衡常数:H2S Ka1 =1.3×10-7;Ka2 = 7.1×10-15
H2SO3 Ka1 =1.7×10-2;Ka2 = 5.6×10-8
① 根据上述实验,可以得出结论:在_________条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______(填序号)。
A
B
C
D
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2
S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_______。
27.(14分)
(1) ① H2S+CuSO4=CuS↓+H2SO4
②蓝色石蕊试纸变红
③ H2S+2Fe3+=S↓+2H++2Fe2+
④ d
(2) ①酸性(或酸性较强)
② C
(3)将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应(或做爆鸣实验,其它合理答案酌情给分)