- 1.14 MB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
【十年高考】2004-2013年高考化学试题分类汇编——化学反应中的能量变化
(2013福建卷)11.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32—+2H2O
【答案】C
(2013海南卷)5.已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2 -2△H1 D.△H1-5△H2-12△H3
[答案]A
[2013高考∙重庆卷∙6]已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。
下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+ PCl3(g)=4PCl5(g)的反应热△H
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ∙mol—1
D.P-P键的键能为(5a-3b+12c)/8 kJ∙mol—1
答案:C
(2013上海卷)9.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q
答案:B
(2013山东卷)12.CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
答案:B
(2013新课标卷2)12.在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=S2(g)+2H2O(g) △H2
H2S(g)+O2(g)=S(g)+H2O(g) △H3
2S(g) =S2(g) △H4
则△H4的正确表达式为
A.△H4=(△H1+△H2-3△H3) B.△H4=(3△H3-△H1-△H2)
C.△H4=(△H1+△H2+3△H3) D.△H4=(△H1-△H2-3△H3)
答案:A
(2013北京卷)6.下列设备工作时,将化学能转化为热能的是
【答案】D
(2013全国新课标卷1)28.二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:
①CO(g)+ 2H2(g)=CH3OH(g) △H1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
水煤气变换反应:
③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=-41.1 kJ·mol-1
二甲醚合成反应:
④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
⑴Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是 (以化学方程式表示) 。
⑵分析二甲醚合成反应④对于CO转化率的影响 。
⑶由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
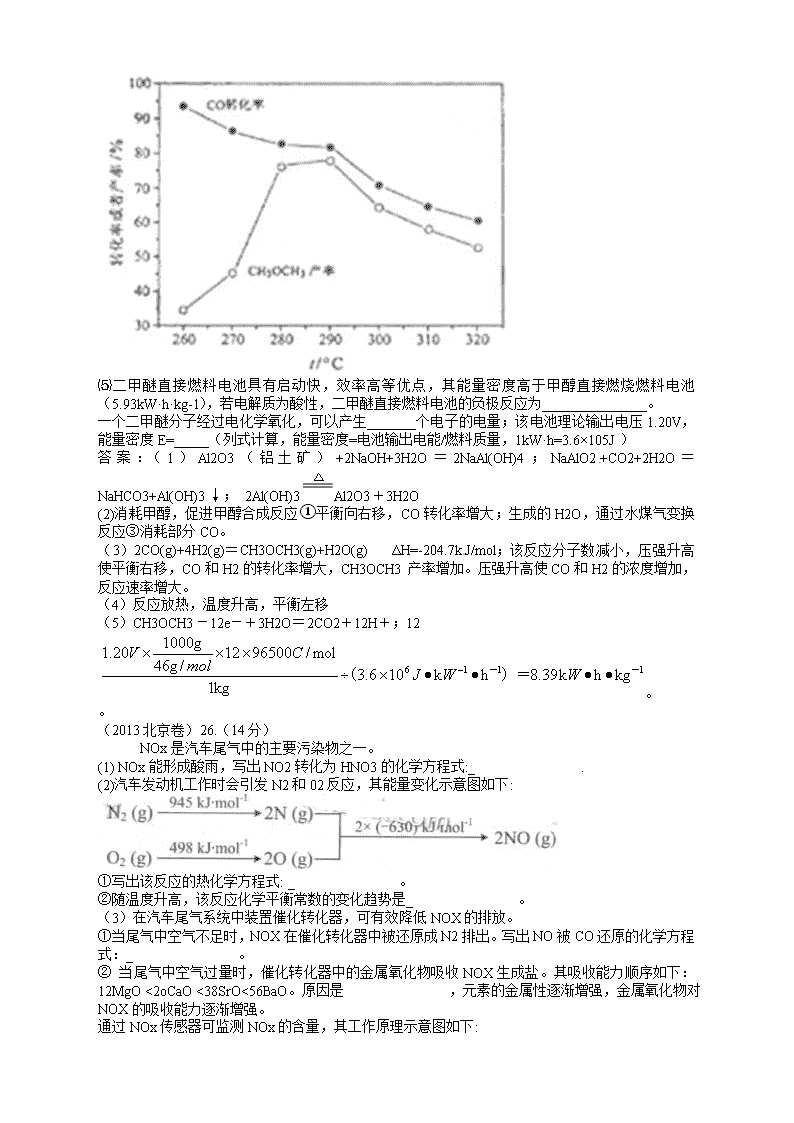
⑷有研究者在催化剂(含Cu-Zn-Al-O和Al2O3),压强为5.0MPa的条件下由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是____________。
⑸二甲醚直接燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃烧燃料电池(5.93kW·h·kg-1),若电解质为酸性,二甲醚直接燃料电池的负极反应为_______________。
一个二甲醚分子经过电化学氧化,可以产生_______个电子的电量;该电池理论输出电压1.20V,能量密度E=_____(列式计算,能量密度=电池输出电能/燃料质量,1kW·h=3.6×105J )
答案:(1)Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4;NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓; 2Al(OH)3Al2O3+3H2O
(2)消耗甲醇,促进甲醇合成反应①平衡向右移,CO转化率增大;生成的H2O,通过水煤气变换反应③消耗部分CO。
(3)2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=-204.7kJ/mol;该反应分子数减小,压强升高使平衡右移,CO和H2的转化率增大,CH3OCH3产率增加。压强升高使CO和H2的浓度增加,反应速率增大。
(4)反应放热,温度升高,平衡左移
(5)CH3OCH3-12e-+3H2O=2CO2+12H+;12
。
。
(2013北京卷)26.(14分)
NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
①写出该反应的热化学方程式: _ 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ 。
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
【答案】(1)3NO2+2H2O=2HNO3+NO;
(2)①N2(g)+O2(g)=2NO(g) △H=+183KJ/mol; ②增大;
(3)①2NO+2CON2+2CO2
②由Mg、Ca、Sr、Ba的质子数,得知它们均为第ⅡA族。同一主族的元素,从上到下,原子半径逐渐增大;
(4)①还原; ②NO+O2--2e-=NO2;
2012年高考化学试题
.(2012江苏∙10)下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g)2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
答案:B
.(2012安徽∙7)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2储氢
释氢
HCOONa+H2O下列有关说法正确的是
A.储氢、释氢过程均无能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被氧化
D.释氢过程中,每消耗0.1molH2O放出2.24L的H2
答案:B
.(2012江苏∙4)某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
答案:C
.(2012浙江∙12)下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)H2O(l) 的ΔH = 40.69 kJ·mol-1
B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) = 6.82 × 10-6
C.已知:
共价键
C-C
C=C
C-H
H-H
键能/ kJ·mol-1
348
610
413
436
则可以计算出反应的ΔH为-384 kJ·mol-1
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O
的电离度降低,溶液的pH减小
答案:D
12.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如题12所示,已知断裂1mol化学键所需的能量(kJ):N=N为942、O=O为500、N−N为154,则断裂1molN−H键所需的能量(KJ)是
△H2= -2752KJ/mol
△H3
△H1=-534KJ/mol
2N(g)+4H(g)+2O(g)
N2H4(g)+O2(g)
N2(g)+2H2O(g)
生成物的总能量
反应物的总能量
假想中间物质的总能量
能量
A.194 B.391 C.516 D.658
答案:B
.(2012安徽∙12)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=—67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=—57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
HF(aq)=H+(aq) +F−(aq) △H=+10.4KJ·mol—1
B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D.当V>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
答案:B
.(2012大纲∙9)反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是
反应过程
能 量
反应过程
能 量
反应过程
能 量
反应过程
能 量
X
C
X
X
X
C
C
C
A+B
A+B
A+B
A+B
A B C D
答案:D
.(2012北京∙26)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl+O2
400℃
CuO/CuCl2
2Cl2+2H2O
(1)已知:Ⅰ反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
ⅡO O
Cl Cl
O
O
Cl
Cl
243KJ/mol
键断裂
498KJ/mol
键断裂
H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________KJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“若”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1、]
下,反应温度对HCl平衡转化率影响的曲线。
60
70
80
90
100
360
380
400
420
440
460
反应温度/℃
HCl的平衡转化率/%
a
b
c
d
①曲线b对应的投料比是______________.
②当曲线b, c, d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投
料比的关系是_________________.
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
答案:(1) 4HCl+O2
400℃
CuO/CuCl2
2Cl2+2H2O △H=-115.6kJ·mol-1;32;强
(2) 4:1;投料比越小时对应的温度越低;30.8%
.(2012海南∙13)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) = N2O4(l) ΔH1=-19.5kJ∙mol-1
②N2H4(l) + O2 (g)=N2(g)+2H2O(g) ΔH2 =-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
答案:(1) 5 (2)2NH3+NaClO=N2H4+NaCl+H2O
(3)2N2H4(l)+ N2O4(l)=3N2(g)+ 4H2O(g) ΔH=−1048.9kJ·mol-1
(4) N2H4 + 4OH-− 4e- = 4H2O +N2↑
.(2012天津∙10)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3 (s)+3H2(g)W (s) +3H2O (g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为 。
⑵某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度
25 ℃~550 ℃~600 ℃~700 ℃
主要成分
WO3 W2O5 WO2 W
第一阶段反应的化学方程式为 ;580 ℃时,固体物质的主要成分为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
⑷已知:温度过高时,WO2 (s)转变为WO2 (g):
WO2 (s)+2H2(g) W (s)+2H2O (g) ∆H=+66.0 kJ/mol
WO2 (g)+2H2(g) W (s)+2H2O (g) ∆H=-137.9 kJ/mol
则WO2 (s) WO2 (g)的∆H= 。
⑸钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s)+ 2 I2 (g) W I4 (g)。下列说法正确的有 。
a.灯管内的I2可循环使用
b.W I4在灯丝上分解,产生的W又沉积在灯丝上
c.W I4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,W I4的分解速率加快,W和I2的化合速率减慢
答案: ⑴k= ⑵ =60%。正反应吸热。
⑶第一阶段的方程:2WO3+H2=W2O5+H2O,第二阶段方程:W2O5+H2=2WO2+H2O
第三阶段方程:WO2+2H2=W+2H2O所以三个阶段消耗H2的物质量之比为1:1:4
⑷△H=+203.9KJ.mol-1. ⑸a、b。
.(2012新课标∙27)光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为−890.3kJ∙mol−1、−285. 8 kJ∙mol−1和−283.0 kJ∙mol−1,则生成1m3(标准状况)CO所需热量为 :
(3)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(4)COCl2的分解反应为COCl2(g)Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体
系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min
的COCl2浓度变化曲线未示出):
0
2
4
6
8
10
12
14
16
18
0.00
0.02
0.04
0.06
0.08
0.10
0.12
0.14
Cl2
CO
COCl2
t/min
c/mol·L−1
①计算反应在第8 min时的平衡常数K= ;
②比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比教产物CO在2−3 min、5−6 min和12−13 min时平均反应速率[平均反应速率分别以v(2−3)、v(5−6)、v(12−13)表示]的大小 ;
⑤比较反应物COCl2在5−6min和15−16 min时平均反应速率的大小: v(5−6) v(15−16)(填“<”、“>”或“=”),原因是 。
答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
⑵5.52×103kJ
⑶CHCl3+H2O2HCl+H2O+COCl2
⑷①0.234mol·L-1 ②< ③0.031 ④v(5-6)>v(2-3)=v(12-13) ⑤> 在相同温度时,该反应的反应物浓度越高,反应速率越大
.(2012浙江∙27)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”
)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是 。
(4)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器 是 。
A.pH计 B.元素分析仪
C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如下图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。
答案: (1) (2)减小 小于
(3)D (4)> 较高 (5)C (6)
(2011·浙江卷)下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,。若加入少量醋酸钠固体,则CH3COOHCH3COO-+H+向左移动,α减小,Ka变小
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.已知:Fe2O3(s)+3C(石墨)2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
CO(g)+O2(g)CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g)CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g)2Fe2O3(s),△H=-1641.0 kJ/mol
【解析】A.正确,熔化热只相当于0.3 mol氢键;B.错误。Ka只与温度有关,与浓度无关;C.正确。环己烯(l)与环己烷(l)相比,形成一个双键,能量降低169kJ/mol,苯(l)与环己烷(l)相比,能量降低691kJ/mol,远大于169×3,说明苯环有特殊稳定结构;D.正确。热方程式①=(③-②)×3-④÷2,△H也成立。
【评析】本题为大综合题,主要考察了物质的键能分析应用,化学反应能量变化的盖斯定律的应用,以及弱电解质溶液的电离平衡分析。
【答案】B
(2011·北京卷)25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
【解析】Na2O是由Na+和O2-构成的,二者的个数比是2:1。Na2O2是由Na+和O22-构成的,二者的个数比也是2:1,选项A不正确;由化合价变化可知生成1molNa2O转移2mol电子,而生成1molNa2O2也转移2mol电子,因此选项B不正确;常温下Na与O2反应生成Na2O,在加热时生成Na2O2,所以当温度升高到一定程度时就不在生成Na2O,所以选项C也不正确;由盖斯定律知①×2-②即得到反应
Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol,因此选项D正确。
【答案】D
(2011·重庆卷) SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A. -1780kJ/mol B. -1220 kJ/mol
C.-450 kJ/mol D. +430 kJ/mol
【解析】本题考察反应热的有关计算。在化学反应中断键需要吸热,而形成新的化学键需要放热。由题意的1mol S(s)和3molF2(g)形成S原子和F原子共需要吸收能量是280kJ+3×160kJ=760 kJ。而生成1mol SF6(g)时需形成6molS-F键,共放出6×330kJ=1980 kJ,因此该反应共放出的热量为1980 kJ-760 kJ=1220kJ,所以该反应的反应热△H=-1220 kJ/mol,选项B正确。
【答案】B
(2011·海南卷)已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
【答案】C
【解析】反应的焓值由盖斯定律直接求出。即(△H1-△H2)/2=-259.7 kJ·mol-1。误区警示:本题中两负数相减易出错,此外系数除以2时,焓值也要除2。
(2011·海南卷)某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是
A.正反应活化能小于100kJ·mol-1
B.逆反应活化能一定小于100kJ·mol-1
C.正反应活化能不小于100kJ·mol-1
D.正反应活化能比逆反应活化能大100kJ·mol-1
【答案】CD
【解析】在可逆反应过程中活化能有正反应和逆反应两种,焓与活化能的关系是△H=Σ(反应物)-Σ(生成物)。题中焓为正值,过程如图所以CD正确
技巧点拨:关于这类题,比较数值间的相互关系,可先作图再作答,以防出错。
(2011·上海卷)据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
【解析】分解水属于吸热反应,催化剂可以降低活化能。
【答案】B
(2011·上海卷)根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g) 2HI(g)+ 9.48 kJ (ii) I2(S)+ H2(g)2HI(g) - 26.48 kJ
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
【解析】反应是可逆反应,反应物不能完全转化;利用盖斯定律可得出1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ;同一种物质的能量在相同条件下,能量一样多。同样利用盖斯定律可得出选项D正确。
【答案】D
(2011·江苏卷)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是
。燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式: 。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是 。
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为 。
【解析】本题以新能源为背景涉及元素化合物性质、热化学方程式和电极反应方程式的书写、读图读表的综合题,是以化学知识具体运用的典型试题。
(1)利用盖斯定律即可得出;(2)H2S热分解制氢属于吸热反应,需要提供能量;(3)在很高的温度下,氢气和氧气会分解生成氢原子和氧原子;(4)阳极失去电子,在碱性溶液中碳原子变成CO32-。
【备考提示】高三复习一定要关注生活,适度加强综合训练与提升。
【答案】(1)CH 4(g)+2H2O(g) =CO 2(g) +4H2(g) △H=165.0 kJ·mol-1
(2)为H2S热分解反应提供热量 2H2S+SO2 =2H2O+3S (或4H2S+2SO2=4H2O+3S 2)
(3)H、O(或氢原子、氧原子)
(4)CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
(5)2Mg2Cu+3H2MgCu2+3MgH2
(2010·山东卷)10下列与化学反应能量变化相关的叙述正确的是
A 生成物能量一定低于反应物总能量
B 放热反应的反应速率总是大于吸热反应的反应速率
C 英语盖斯定律,可计算某些难以直接侧脸房的反应焓变
D 同温同压下,在光照和点燃条件的不同
【解析】生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故A错;反映速率与反应是吸热还是放热没有必然的联系,故B错;C是盖斯定律的重要应用,正确;根据=生成物的焓-反应物的焓可知,焓变与反应条件无关,故D错。
【答案】C
(2010·重庆卷)12.已知 蒸发1mol Br2(l
)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为
A.404 B.260 C.230 D.200
【答案】D
【解析】本题考查盖斯定律的计算。由已知得:Br2(l)=Br2(g) DH=+30KJ/mol,则H2(g) + Br2(g) = 2HBr(g);DH= -102KJ/mol。436+a-2×369=-102;a=―200KJ,D项正确。
(2010·天津卷)6.下列各表述与示意图一致的是
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g) 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
【解析】酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错;正逆反应的平衡常数互为倒数关系,故B正确;反应是放热反应,且反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,C错;反应是放热反应,但图像描述是吸热反应,故D错。命题立意:综合考查了有关图像问题,有酸碱中和滴定图像、正逆反应的平衡常数图像,反应速率图像和能量变化图像。
【答案】B
(2010·广东卷)在298K、100kPa时,已知:2 ⊿
⊿
⊿
则⊿与⊿和⊿间的关系正确的是
A .⊿=⊿+2⊿ B ⊿=⊿+⊿
C. ⊿=⊿-2⊿ D. ⊿=⊿- ⊿
【解析】第三个方程式可由第二个方程式乘以2与第一个方程式相加,有盖斯定律可知
【答案】A
(2010·浙江卷)12. 下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
△H=-38.6kJ·mol-1
C. 氯化镁溶液与氨水反应:
D. 氧化铝溶于NaOH溶液:
【解析】本题考查热化学方程式与离子方程式的书写。A、标准燃烧热的定义,1mol可燃物完全燃烧生成稳定氧化物时方出的热量(标准指298K,1atm)。水液态稳定,方程式系数就是物质的量,故A错。B、根据热化学方程式的含义,与对应的热量是1mol氮气完全反应时的热量,但次反应为可逆反应故,投入0.5mol的氮气,最终参加反应的氮气一定小于0.5mol。所以△H的值大于38.6。B错。D、氢氧化铝沉淀没有沉淀符号。
【答案】C
教与学提示:化学用语的教学是化学学科技术规范,强调准确性,强调正确理解与应用。特别重视热化学方程式的系数与反应热的对应关系。重视离子方程式的拆与不拆的问题。热化学方程式的书写问题由:聚集状态、系数、系数与反应热数值对应、反应热单位、可逆反应的反应热等内容构成。离子方程式的书写问题由:强弱电解质、最简整数比、定组成规律、离子方程式正误判断、守恒、定量离子方程式等内容组成。
(2010·上海卷)14.下列判断正确的是
A.测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值
B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C.0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH
D.1L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1L mol·L-1硫化钠溶液吸收SO2的量
【答案】C
【解析】此题考查了实验操作、化学反应中的能量变化、溶液的pH、元素化合物等知识。测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,说明部分硫酸铜分解生成了氧化铜,测定值大于理论值,A错;氢原子转化为氢分子,形成化学键放出能量,说明2mol氢原子的能量大于1molH2,B错;碳酸的酸性弱于醋酸,故此相同浓度的碳酸钠溶液的pH大于醋酸钠溶液,C对;1L 1mol.L-1的溶液中含有溶质1mol,前者发生:Na2CO3+SO2+H2O=2NaHSO3+CO2↑;后者发生:2Na2S+5SO2+2H2O=4NaHSO3+3S↓;分析可知,很明显后者大于前者,D错。
易错警示:此题解答是的易错点有二:一是对化学键的形成断开和吸热放热的关系不清,要能够准确理解断键吸热成键放热;二是忽视亚硫酸的酸性强于氢硫酸,不能准确判断硫化钠中通入二氧化硫时要生成氢硫酸,造成氢硫酸和亚硫酸能发生氧化还原反应生成单质硫。
(2010·上海卷)17.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
【答案】B
【解析】此题考查化学反应速率和化学平衡知识。催化剂能提高化学反应速率,加快反应进行,也就是提高了生产效率,A对;反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,B错;充入大量CO2气体,能使平衡正向移动,提高H2的转化率,C对;从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,D对。
易错警示:利用化学平衡知识判断反应吸热还是放热时,一定要注意温度的变化使反应正向移动还是逆向移动,倘若给出的知识温度条件则无法判断。
(2010·江苏卷)8.下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应不能自发进行,则该反应的
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中、、的氧化性依次减弱
【答案】AC
【解析】本题主要考查的是相关的反应原理。A项,铅蓄电池在放电过程中,负极反应为其质量在增加;B项,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,可知的氧化性大于,综上分析可知,本题选AC项。
(2010·安徽卷)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素
相关信息
X
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等
Y
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积
Z
Z和Y同周期,Z的电负性大于Y
W
W的一种核素的质量数为63,中子数为34
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:XO(g)+O2(g)=XO2(g) H=-283.0 kJ·mol-2
Y(g)+ O2(g)=YO2(g) H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
【答案】(1)3 VIA HClO4
(2)2 H-Z H-Y
(3)[Ar]3d104s1 2Cu2S+3O2=2Cu2O+2SO2
(4)2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ/mol
【解析】由表中可知,X为C Y为 S Z为 Cl W为Cu
(2010·天津卷)7.(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R
受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
【解析】(1)X、Y、Z、L是组成蛋白质的四种元素且原子序数依次增大,故分别为:H、C、N、O元素;M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第ⅢA族;再根据五种元素在周期表的位置,可知半径由大到小的顺序是:Al>C>N>O>H。
(2) N和H 1:3构成的分子为NH3,电子式为;2:4构成的分子为N2H4,其结构式为。
(3)Se比O多两个电子层,共4个电子层,1→4电子层上的电子数分别为:2、8 、18、6,故其原子序数为34;其最高价氧化物对应的水化物的化学式类似H2SO4,为H2SeO4。
非金属性越强,与氢气反应放出的热量越多,故2→5周期放出的热量依次是:d、c、b、a,则第四周期的Se对应的是b。
(4)Al作阳极失去电子生成Al3+,Al3++3HCO3-==Al(OH)3+3CO2,2Al(OH)3Al2O3+3H2O。
【答案】
(1)O 第三周第ⅢA族 Al>C>N>O>H
(2)
(3) 34 H2SeO4 b
(4) Al-3e-Al3+ Al3++3HCO3-==Al(OH)3+3CO2 2Al(OH)3Al2O3+3H2O。
命题立意:本题以元素的推断为背景,综合考查了元素符号的书写、元素位置的判断和原子半径大小的比较;考查了电子式、结构式的书写,元素周期律,和电极反应式、化学方程式的书写,是典型的学科内综合试题。
(2010·广东卷)31.(16分)硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OHB(OCH3)3 +3H2O中,H3BO 3的转化率()在不同温度下随反应时间(t)的变化见图12,由此图可得出:
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
【解析】(1)根据元素守恒,产物只能是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。
(2)由图像可知,温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应,△H>O。
(3) K===
【答案】
(1) B2H6 + 6H2O=2H3BO3 +6H2
(2) ①升高温度,反应速率加快,平衡正向移动 ②△H>O
(3) 或1.43
(2010·福建卷)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
选项
a
b
c
d
x
温度
温度
加入H2的物质的量
加入甲的物质的量
y
甲的物质的量
平衡常数K
甲的转化率
生成物物质的量总和
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为
(3)M和T形成的化合物为,与水反应,其中氯化氢气体呈雾状
(4)①氨水与双氧水发生氧化还原反应:
生成无污染的氮气;
②甲在固体体积的密闭容器中发生分解反应,表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
(5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式
【答案】(1) ; ⅦA
(2)
(3),
(4)①
②a和c;a或c
(5)
(2010·上海卷)25.接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
1)该反应所用的催化剂是 (填写化合物名称),该反应450℃时的平衡常数 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是 .
a. b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molSO2,半分钟后达到平衡,测得容器中含SO30.18mol,则= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol
O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol