- 351.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
番禺区2014年高考化学统考试题(一)
7.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,1.7gH2O2中含有的电子数为0.9nA
B.1 mol.L-1CuCl2溶液含有2nA个Cl-
C.1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去2nA个电子
D.标准状况下,2.24L戊烷所含分子数为0.1nA
8.在水溶液中能大量共存的一组是( )
A.Ba2+、Na+、SO32-、Cl− B.MnO4− 、SO42− 、K+ 、H+
C.Al3+ 、Mg2+、NO3− 、HCO3− D.Fe3+、Na+、SCN− 、Cl−
9.下列叙述正确的是( )
A.碳酸氢钠溶液可用于区分乙酸、乙醇和苯
B.糖类、油脂、蛋白质都是高分子化合物,都可以在一定条件下发生水解反应
C.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
10.短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
A.Y的最高化合价为+6
B.离子半径:W>Q>Y>X
C.氢化物的沸点:Y>Q
D.最高价氧化物的水化物的酸性:W>Q
11.查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH—2e—→X+2H+.下列说法中正确的是( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2+4e—+2H2O=4OH—
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O
12.下列有关物质的性质与其应用不相对应的是( )
A.Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品
B.NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂
C.NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏
D.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于自来水的净化和杀菌消毒
22.25℃时,下列说法正确的是( )
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl—)>c(NH4+)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3—) >c(H2CO3)>c(CO32−)
C.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后所得溶液显酸性
D.将0.1 mol/L的氨水溶液加水稀释10倍,溶液中离子浓度都减少
5
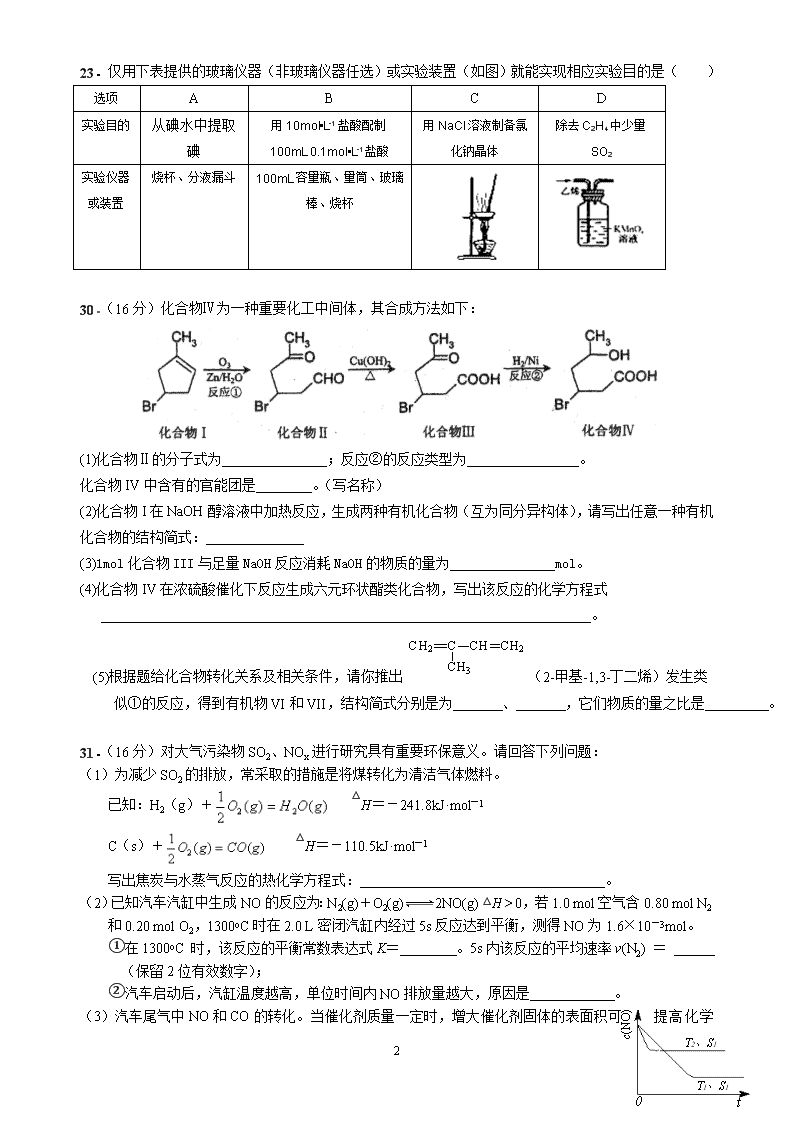
23.仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(如图)就能实现相应实验目的是( )
选项
A
B
C
D
实验目的
从碘水中提取碘
用10mol•L-1盐酸配制100mL 0.1mol•L-1盐酸
用NaCl溶液制备氯化钠晶体
除去C2H4中少量SO2
实验仪器
或装置
烧杯、分液漏斗
100mL容量瓶、量筒、玻璃棒、烧杯
30.(16分)化合物Ⅳ为一种重要化工中间体,其合成方法如下:
(1)化合物Ⅱ的分子式为_______________;反应②的反应类型为________________。
化合物IV中含有的官能团是 。(写名称)
(2)化合物I在NaOH醇溶液中加热反应,生成两种有机化合物(互为同分异构体),请写出任意一种有机化合物的结构简式:______________
(3)1mol化合物III与足量NaOH反应消耗NaOH的物质的量为 mol。
(4)化合物IV在浓硫酸催化下反应生成六元环状酯类化合物,写出该反应的化学方程式
______________________________________________________________________。
(5)根据题给化合物转化关系及相关条件,请你推出(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为 、 ,它们物质的量之比是 。
31.(16分)对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:H2(g)+ △H=-241.8kJ·mol-1
C(s)+ △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
(2)已知汽车汽缸中生成NO的反应为:N2(g)+O2(g)2NO(g) △H0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
①在1300oC 时,该反应的平衡常数表达式K= 。5s内该反应的平均速率ν(N2) = (保留2位有效数字);
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
c(NO)
t
0
T2、S1
T1、S1
(3)汽车尾气中NO和CO的转化。
5
当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g)+2CO(g) 2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
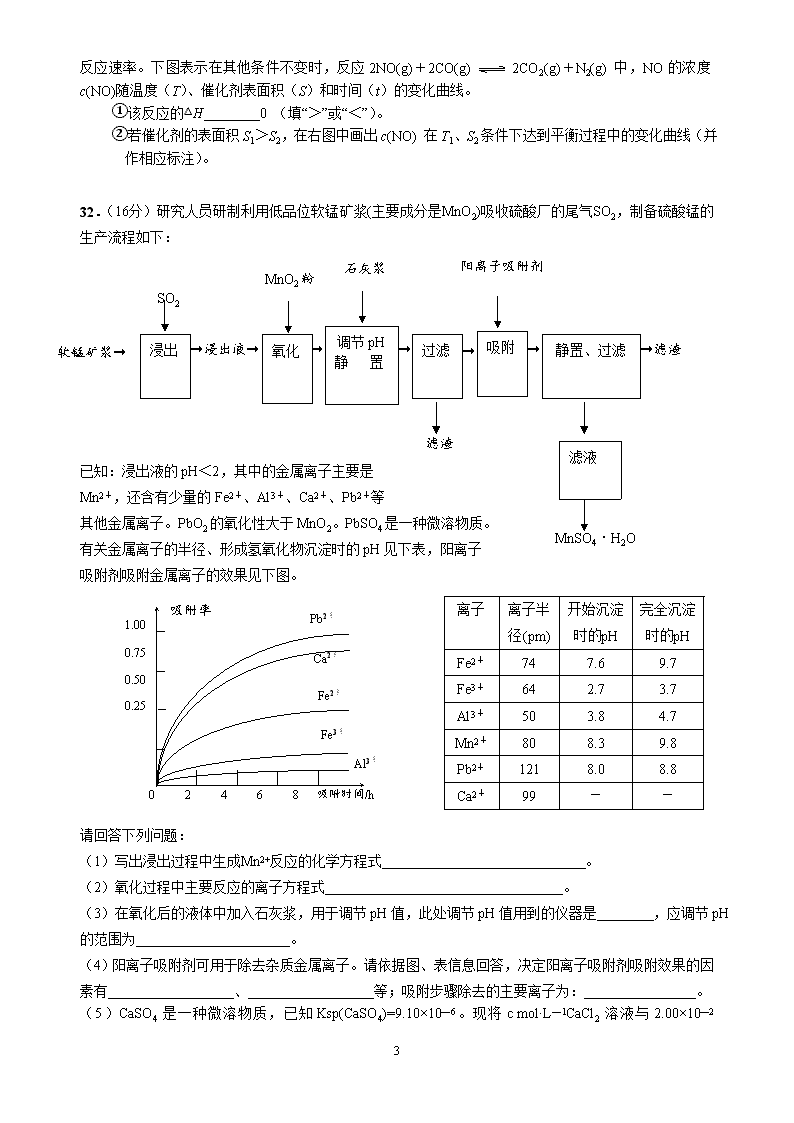
32.(16分)研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
→滤渣
→
阳离子吸附剂
MnSO4·H2O
→
滤渣
→
石灰浆
→
MnO2粉
→浸出液→
软锰矿浆→
SO2
浸出
氧化
调节pH
静 置
过滤
滤液
吸附
静置、过滤
已知:浸出液的pH<2,其中的金属离子主要是
Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等
其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子
吸附剂吸附金属离子的效果见下图。
离子
离子半径(pm)
开始沉淀
时的pH
完全沉淀
时的pH
Fe2+
74
7.6
9.7
Fe3+
64
2.7
3.7
Al3+
50
3.8
4.7
Mn2+
80
8.3
9.8
Pb2+
121
8.0
8.8
Ca2+
99
-
-
Pb2+
Ca2+
Fe2+
Al3+
Fe3+
吸附率
1.00
0.75
0.50
0.25
0 2 4 6 8 吸附时间/h
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2
5
mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
33.(16分)某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1) 操作①的名称是 ;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、泥三角和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有 。
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为 , 操作④相关的化学方程式为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中, 。 (填写操作与现象),则证实滤液中含有NH4+。
(5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。
限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液;
限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器
请在下面的方框中画出实验装置图,并作相应标注,同时写出正极方程式
番禺区2014年高考化学统考试题(一)参考答案
ABACDB BC AC
5
30.(16分)(1)(1分,C、H、Br原子顺序一定要准确,否则不得分); 加成反应(或还原反应)(1分)(只写“加成”不得分);;羟基、羧基、溴原子 (3分,只能写出官能团的名称)
(2)(2分)
(3)2(2分)
(4)(3分,化学式写错0分;没写条件或条件不完整,扣1分;写可逆符号不扣分)
(5)(5分,顺序可颠倒,对应比值也要准确)
或 (每空各2分);1:2 (1分)
31.(16分)
(1)C(s) + H2O(g) = CO(g) + H2(g) △H=+131.3kJ·mol-1 (3分,化学式、状态错误0分;焓变数值、单位错漏扣1分;计量数用分数表示与焓变相匹配也给分)
(2)①
c2(NO) (2分)8.0×10-5 mol/(L·s)(2分,单位或有效数字错漏扣1分)
c(NO)
t
0
T2、S1
T1、S1
T1、S2
c(N2)·c(O2)
② 温度升高,反应速度加快(2分),平衡向右移动(2分)
(3)① <(2分)
②见右图:(3分,其中曲线2分,标注1分)
32.(16分)(1)SO2+MnO2=MnSO4 (2分) (未配平扣1分;)
(2)2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O(3分)(未配平扣1分;)
(3)pH计(2分), 4.7 ≤pH<8.3 (2分)
(4)吸附时间、金属离子的半径 、金属离子的电荷(2分)(答三者中的任两点得满分) ;
Pb2+、Ca2+(2分)(5)1.82×10 - 3(3分)(有效数字错漏扣1分)
33.(16分)(1)溶解 (1分)(2)坩埚,C(碳) (共2分,每空1分)
MnO2
(3)二氧化锰(MnO2)(2分) 2H2O2==2H2O+O2↑(3分)(漏反应条件、“↑”各扣1分;未配平扣1分;)(4)(3分)加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近,试纸变蓝色
(5)(答案符合题意均可)(共5分,)(3分,标注正负极材料1分,标注电解质溶液1分,图1分。)
正极方程式:Cu2+ + 2e- = Cu (2分)
5