- 11.34 MB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013 高考百天仿真冲刺卷
理 综 试 卷(六)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 P 31 Cu 64 Hg 201
第Ⅰ卷(选择题 共 120 分)
本卷共 20 小题,每小题 6 分,共 120 分。在每小题列出的四个选项中,选出符合题目要求的一项。
1.人体细胞进行正常的生命活动,每天需要水解 200—300 摩尔 ATP,但人体细胞中 ATP 的总量只有约 0.1
摩尔。下列有关 ATP 的叙述错误..的是( )
A.ATP 和 ADP 的相互转化保证了机体对能量的需求
B.ATP 由 3 个磷酸基团和 1 个腺嘌呤构成
C.有氧呼吸的第三阶段为人体细胞活动提供的 ATP 最多
D.人体细胞内形成 ATP 的场所是细胞溶胶和线粒体
2.治疗性克隆有何希望最终解决供体器官的短缺和器官移植出现的排异反应。下图表示治疗性克隆的过
程,下列说法正确的是 ( )
A.上述过 程利用了动物
体细胞融合技术
B.上述过程实现了动物细胞的全能性
C.胚胎干细胞的不断增殖和分化潜能保证①过程的进行
D.①、②过程不进行 DNA 复制和蛋白质合成
3.下列有关生物多样性利进化的叙述中,不.正确的是 ( )
A.细菌在接触青霉素后会产生抗药性的突变个体,青霉素的选择作用使其生存
B.蜂鸟细长的喙与倒挂金钟的简状花萼是它们长期协同进化形成的相互适应特征
C.异地新物种的形成通常要经过突变和基因重组、自然选择及隔离三个基本环节
D.自然选择能定向改变种群的基因频率,决定了生物进化的方向
4.下列有关种群和群落的叙述中,正确的是 ( )
A.用样方法调查种群密度时,应先选取样方再确定调查对象
B.用标志重捕法调查种群密度时,应用鲜艳的颜色标记被捕获的动物
C.群落的水平结构常表现为群落中的生物呈集群分布或斑块状镶嵌分布
D.火灾过后的草原上发生的群落演替属于初生演替
5.下列有关人体特异性免疫的说法中,正确的是 ( )
A.人体对花粉或某些药物产生的过敏反应:是先天性免疫缺乏病
B.血清中的抗体与破伤风杆菌结合并抑制其繁殖属于细胞免疫
C.体液免疫中,效应 B 细胞与被感染的细胞接触使其裂解死亡
D.切除胸腺后,人体的细胞免疫和体液免疫功能都会受到影响
6.下列既法不正确...的是 ( )
A.可用中和法处理酸性或碱性工业废水
B.垃圾填埋正成为垃圾处理的发展方向
C.使用纤维素和淀粉为原料制成的微生物降解塑料,可治理“白色污染”
D.向煤中加入适量石灰石,可减少其燃烧产物中的 SO2,降低对大气的污染
放电
充电
800
℃1200℃
1200℃
7.下列说法正确的是 ( )
A.用氨水洗涤附着银镜的试管
B.用 CCl4 作萃取剂直接从海带中提取 I2
C.用向下排空气法收集 NH3,并用湿润的蓝色石蕊试纸验满
D.制乙炔时滴加饱和食盐水是为了减缓电石与水的反应速率
8.下列离子方程式书写不正确的是 ( )
A.Cl2 通入 FeCl2 溶液中:Cl2+Fe2+=Fe3++2Cl-
B.Na2CO3 溶液显碱性:CO 2
3 +H2O HCO
3 +OH-+3H2↑
C.Al 和 NaOH 溶液反应:2Al+2OH-+2H2O=2AlO
2
D.少量 SO2 通入氨水中:SO2+2NH3·H2O=2NH
4 +SO 2
3 +H2O
9.X 和 Y 元素的原子在化学反应中都容易失去电子,形成与 Ne 原子具有相同电子层结构的离子,且 X 的
原子序数大于 Y 的原子序数。下列说法正确的是( )
A.X 的金属性比 Y 的强
B.X 的最高正化合价比 Y 的高
C.常温下,X 和 Y 的单质一定不与水反应
D.Y 的最高价氧化物对应水化物的碱性比 X 的弱
10.Li-SO2 电池具有输出功率高和低温性能好等特点。其电解质是 LiBr,溶剂是碳酸丙烯酯和乙腈,电池
反应为 2Li+2SO2 Li2S2O4。下列说法正确的是( )
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为 Li++e-=Li
D.该电池的电解质溶液可以换成 LiBr 的水溶液
11.25℃时,下列关于分别由等体积 0.1 mo1/L 的 2 种溶液混合而成的溶液的说法中,不正确...的是( )
A.Ba(OH)2 溶液与 Na2SO4 溶液:pH=13
B.醋酸与 CH3COONa 溶液:c(Na+)+c(H+)=c(CH3COO 一)+c(OH 一)
C.Na2CO3 溶液与 NaOH 溶液:c(Na+)>c( CO 2
3 )>c(OH 一)>c(H+)
D.Na2CO3 溶液与 NaHCO3 溶液:2c(Na+)=3c(CO 2
3 )+3c(HCO
3 )+3c(H2CO3)
12.火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
①2CuFeS2+4O2 Cu2S+3SO2+2FeO
②2Cu2S+3O2 2Cu2O+2SO2
③2Cu2O+Cu2S 6Cu+SO2↑
下列说法正确的是 ( )
A.反应②、③中,Cu2S 都只做还原剂
B.1molCu2FeS2 生成 1 mol Cu,理论上消耗 2.5 mol O2
C.1molCu2S 和 O2 反应生成 2 mol Cu 转移的电子数为 4 mo1
D.反应①中,共转移的电子数为 16mol,CuFeS2 中铜元素的化合价为+2
13.下列事例中表明光子不但具有能量,而且象实物粒子一样具有动量的是 ( )
A.康普顿效应 B.光的偏振现象
C.光的色散现象 D.光的干涉现象
14.氢原子的部分能级如图所示。用单色光照射处于基态的氢
原子,氢原子吸收光子后跃迁到 n=3 的激发态,此后氢原
子又放出光子。在此过程中,氢原子 ( )
A.吸收光子的能量可以是任意值
B.吸收光子的能量是某一确定值
C.放出光子的能量可以是任意值
D.放出光子的能量是某一确定值
15.下列叙述中正确的是 ( )
A.狭义相对论认为,物体静止时的质量与运动时的质量相等
B.在光的衍射现象中,亮条纹位簧是光子到达几率大的位置
C.宏观物体的物质波波长非常小,容易观察到它的波动性
D.不确定关系表明,可以同时准确地确定粒子的位置和动量
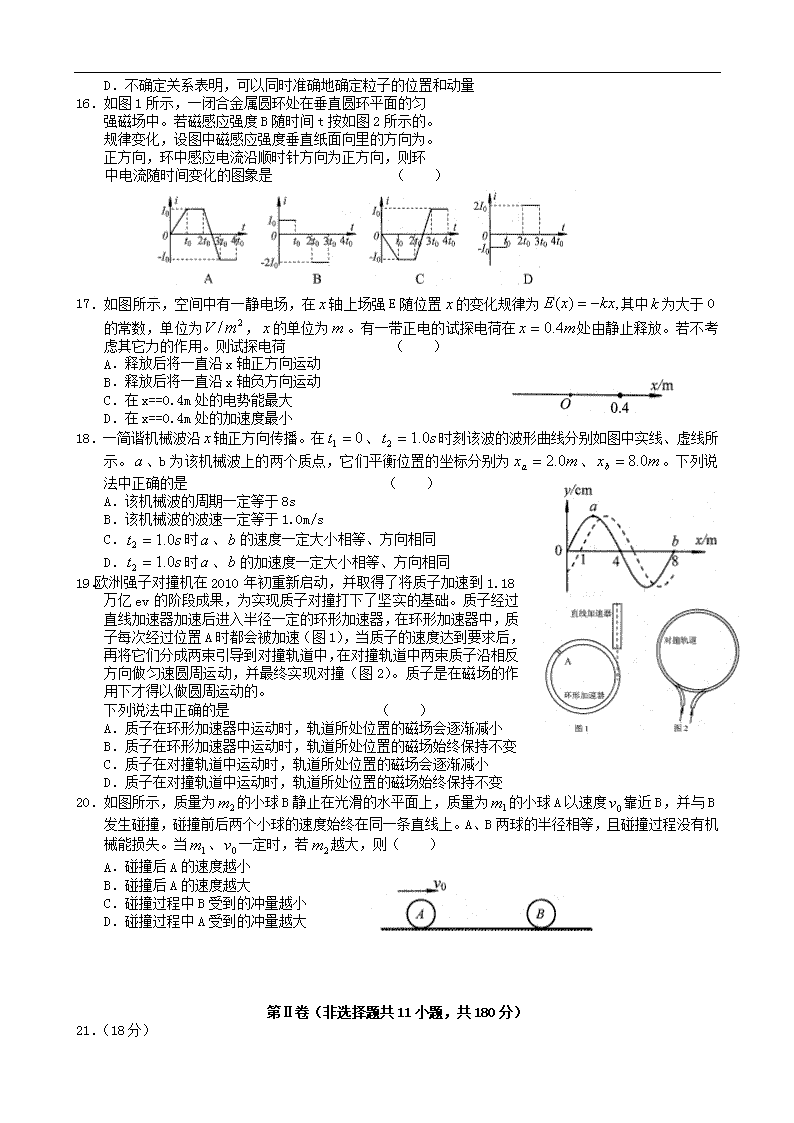
16.如图 1 所示,一闭合金属圆环处在垂直圆环平面的匀
强磁场中。若磁感应强度 B 随时间 t 按如图 2 所示的。
规律变化,设图中磁感应强度垂直纸面向里的方向为。
正方向,环中感应电流沿顺时针方向为正方向,则环
中电流随时间变化的图象是 ( )
17.如图所示,空间中有一静电场,在 x 轴上场强 E 随位置 x 的变化规律为 ,)( kxxE 其中 k 为大于 0
的常数,单位为 2/ mV , x 的单位为 m 。有一带正电的试探电荷在 mx 4.0 处由静止释放。若不考
虑其它力的作用。则试探电荷 ( )
A.释放后将一直沿 x 轴正方向运动
B.释放后将一直沿 x 轴负方向运动
C.在 x==0.4m 处的电势能最大
D.在 x==0.4m 处的加速度最小
18.一简谐机械波沿 x 轴正方向传播。在 01 t 、 st 0.12 时刻该波的波形曲线分别如图中实线、虚线所
示。 a 、b 为该机械波上的两个质点,它们平衡位置的坐标分别为 mxa 0.2 、 mxb 0.8 。下列说
法中正确的是 ( )
A.该机械波的周期一定等于 8s
B.该机械波的波速一定等于 1.0m/s
C. st 0.12 时 a 、b 的速度一定大小相等、方向相同
D. st 0.12 时 a 、b 的加速度一定大小相等、方向相同
19.欧洲强子对撞机在 2010 年初重新启动,并取得了将质子加速到 1.18
万亿 ev 的阶段成果,为实现质子对撞打下了坚实的基础。质子经过
直线加速器加速后进入半径一定的环形加速器,在环形加速器中,质
子每次经过位置 A 时都会被加速(图 1),当质子的速度达到要求后,
再将它们分成两束引导到对撞轨道中,在对撞轨道中两束质子沿相反
方向做匀速圆周运动,并最终实现对撞(图 2)。质子是在磁场的作
用下才得以做圆周运动的。
下列说法中正确的是 ( )
A.质子在环形加速器中运动时,轨道所处位置的磁场会逐渐减小
B.质子在环形加速器中运动时,轨道所处位置的磁场始终保持不变
C.质子在对撞轨道中运动时,轨道所处位置的磁场会逐渐减小
D.质子在对撞轨道中运动时,轨道所处位置的磁场始终保持不变
20.如图所示,质量为 2m 的小球 B 静止在光滑的水平面上,质量为 1m 的小球 A 以速度 0v 靠近 B,并与 B
发生碰撞,碰撞前后两个小球的速度始终在同一条直线上。A、B 两球的半径相等,且碰撞过程没有机
械能损失。当 1m 、 0v 一定时,若 2m 越大,则( )
A.碰撞后 A 的速度越小
B.碰撞后 A 的速度越大
C.碰撞过程中 B 受到的冲量越小
D.碰撞过程中 A 受到的冲量越大
第Ⅱ卷(非选择题共 11 小题,共 180 分)
21.(18 分)
(1)图 1 是演示简谐运动图象的装置,它由一根较长的细线和一个较小的沙漏组成。当沙漏摆动时,
若将沙漏下方的木板匀速拉出,漏出的沙在板上会形成一条曲线。通过对曲线的分析,可以确定
沙漏的位移随时间变化的规律。图 2 是同一个沙漏分别在两块木板上形成的曲线。
①沙漏在木板 1 上形成曲线 OA 段经历的时间 (填“大于”、“等于”或“小于”)沙漏
在木板 2 上形成曲线 O′A′段经历的时间。
②经测量发现 OB=O′B′。若木板 1 运动的速度大小为 v1,木板 2 运动的速度大小为 v2,则
A. 1 2
3
2v v B. 1 2v v C. 1 2
3
4v v D. 1 2
2
3v v
(2)某同学做“测量金属丝电阻率”的实验。
①首先,他用螺旋测微器在被测金属丝上的三个不同位置各测一次直
径,并求出其平均值作为金属丝的直径 d。其中某次测量如图 3 所示,
这次测量对应位置金属导线的直径为 mm;
②然后他测量了金属丝的电阻,实验中使用的器材有:
a.金属丝(接入电路的长度 x0 为 1m,电阻约 5Ω~6Ω)
b.直流电源(4.5V,内阻不计)
c.电流表(200mA,内阻约 1.0Ω
d.电压表(3V,内阻约 3kΩ)
e.滑动变阻器(50Ω,1.5A)
f.定值电阻 R1(5.0Ω,1.5A)
g.定值电阻 R2(10.0Ω,1.0A)
h.定值电阻 R3 (00.0Ω,1.0A)
i.开关,导线若干
该同学实验时的电路图如图 4 所示,且在实验中两块电表的读数都能接近满偏值,定值电阻应该
选 (选填“R1”、“R2”或“R3”);
③该同学根据测量时电流表的读数 I、电压表的读数 U 描绘的 U—I 图象如图 5 所示,根据图象可
以求得金属丝的电阻 Rx= Ω。
④设法保持金属丝的温度不变,而逐渐减小上述金属丝(接入电路长度为 x0)接入电路的长度 x,
当电压表的示数保持不变时,下列图象中正确反映了金属丝电阻消耗的功率 P 随 x 变化规律的是
( )
22.(16 分)如图所示,两块相同的金属板正对着水平放置,电压 U 时,一个质量为 m、电荷量为+q 的带
电粒子,以水平速度 v0 从 A 点射入电场,经过一段时间后从 B 点射出电场,A、B 问的水平距离为 L。
不计重力影响。求
(1)带电粒子从 A 点运动到 B 点经历的时间 t;
(2)A、B 问竖直方向的距离 y;
(3)带电粒子经过 B 点时速度的大小 v。
23.(18 分)利用水流和太阳能发电,可以为人类提供清洁能源。水的密度 3 31.0 10 /kg m ,太阳光
垂直照射到地面上时的辐射功率 3 2
0 1.0 10 /P W m ,地球表面的重力加速度取 g=10m/s2。
(1)三峡水电站发电机输出的电压为 18kV。若采用 500kV 直流电向某地区输电 5.0×106kW,要求输电
线上损耗的功率不高于输送功率的 5%,求输电线总电阻的最大值;
(2)发射一颗卫星到地球同步轨道上(轨道半径约为地球半径的 6.6 2 11 )利用太阳能发电,然后
通过微波持续不断地将电力输送到地面,这样就建成了宇宙太阳能发电站。求卫星在地球同步轨
道上向心加速度的大小;
(3)三峡水电站水库面积约 1.0×109m2,平均流量 Q=1.5×l04m3/s,水库水面与发电机所在位置的平
均高度差 h=l00m,发电站将水的势能转化为电能的总效率 1 60% 。在地球同步轨道上,太阳
光垂直照射时的辐射功率为 10P0。太阳能电池板将太阳能转化为电能的效率 2 =20%,将电能输
送到地面的过程要损失 50%。若要使(2)中的宇宙太阳能发电站的发电能力与三峡电站相当,
卫星上太阳能电池板的面积至少为影大?
24.(20 分)如图所示,A、B 两个小物体(可看成质点)的质量分别为 2m、m,
它们栓接在跨过定滑轮的细绳两端,细绳不可伸长,且能承受足够大的拉力。
B 物体悬吊着静止时,A 也静止在地面上,A、B 与定滑轮轮轴之间的竖直距
离分别为 2l、l。现将 B 物体竖直向上提高距离 l,再将其从静止释放。每次
细绳被拉直时 A、B 速度的大小立即变成相等,且速度方向相反,由于细绳被
拉直的时间极短,此过程中重力的作用可以忽略不计。物体与地面接触时,
速度立即变为 0,直到再次被细绳拉起。细绳始终在滑轮上,且不计一切摩
擦。重力加速度为 g。求
(1)细绳第一次被拉直瞬间绳对 A 冲量的大小;
(2)A 第一次上升过程距离地面的最大高度;
(3)A 运动的总路程。
25.(16 分)香兰素存在于香草豆等植物中,是有机合成的重要原料。
(1)香兰素有 C、H、O3 种元素,相对分子质量为 152,氧元素的质量分数为 31.6%,碳、氢元素质量
比为 12:1。香兰素易溶于乙醇,熔点为 81℃~83℃,沸点为 284℃。
①从香草豆等植物中可以提取香兰素,部分流程如下图所示。
操作 1 的名称是 。
②香兰素的分子式是 。
(2)以香兰素为原料,经过一系列转化,可以得到药物利喘贝
①写出实现下列转化的化学方程式:
G→利喘贝 。
E→F 。
②D 分子内含有碳碳双键,C→D 的反应类型为 。
③B 的结构简式是 。
④下列说法正确的是(填选项序号) 。
a. A 分子中含有羟基和醛基
b. 有机物 C 存在顺式和反式结构
c. 有机物 F 生成 G 时,可以用 KMnO4 酸性溶液代替新制 Cu(OH)2 悬浊液
d. 既能与盐酸又能与 NaOH 溶液反应
⑤香兰素能发生银镜反应,其分子中苯环上取代基的数目和位置均与 A 相同。1mol 香兰素与饱和
溴 水 发 生 取 代 反 应 生 成 1molHBr , 且 最 多 能 与 1molNa 反 应 。 则 香 兰 素 的 结 构 简 式
是 。
26.(12 分)化合物 A 是制玻璃的主要原料之一。常温下,化合物 B、H、I 为气体,B 不溶于水,H、I 易
溶于水,H 的水溶液呈碱性,I 的水溶液呈酸性。D 元素是地壳中含量仅次于氧的非金属元素。化合物
J 是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为 140,其中 D 元素的质量分数
为 60%。上述物质间的转化关系如下图所示。
(1)除 A 外,制玻璃的主要原料还有物质(填化学式) 、 。
盛放 NaOH 溶液的试剂瓶不能用玻璃塞,原因是(用化学方程式表示) 。
(2)D 元素在元素周期表中的位置是 。
(3)H 的电子式是 。
(4)F 和 H 反应生成 J 和 I 反应的化学方程式是 。
(5)下列说法正确的是(填选项序号) 。
a. 上述由 A 生成 D 的单质的反应属于置换反应
b. D 元素在自然界中主要以单质形式存在
c. G 是含有极性共价键的离子化合物
d. I 是强电解质,G 是弱电解质,二者的水溶液都显酸性
27.(16 分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3 在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备 Na2S2O3·5H2O 装置和部分操作步骤如下。
I.打开 K1,关闭 K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C 中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当 C 中溶液的 pH 接近 7 时即停止 C 中的反应,停止加热。
III.过滤 C 中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I 中,圆底烧瓶中发生反应的化学方程式是 。
②II 中,“当 C 中溶液的 pH 接近 7 时即停止 C 中的反应”的原因是 。
“停止 C 中的反应”的操作是 。
③III 中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④装置 B 中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应 2S2O3
2-+I2=S4O6
2-+2I-,可用 I2 的标准溶液测定产品的纯度。取 5.5g 产品,配制成 100mL
溶液。取 10mL 溶液,以淀粉溶液为指示剂,用浓度为 0.050mol/LI2 的标准溶液进行滴定,相关
数据记录如下表所示。
编号 1 2 3 4
溶液的体积/mL 10.00 10.00 10.00 10.00
消耗 I2 标准溶液的体积/mL 19.99 19.98 17.13 20.03
①判断达到滴定终点的现象是 。
②Na2S2O3·5H2O 在产品中的质量分数是(计算结果保留 1 位小数) 。
(Na2S2O3·5H2O 的式量为 248)
28.(14 分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以 N2 和 H2 为原料合成氨气。反应 N2(g)+3H2(g) 2NH3(g) △H<0
①下列措施可以提高 H2 的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的 NH3 d.升高温度
②一定温度下,在密闭容器中充入 1molN2 和 3molH2 发生反应。若容器容积恒定,达到平衡状态时,
气体的总物质的理是原来的
16
15 ,则 N2 的转化率 a1= ;
若容器压强恒定,达到平衡状态时,N2 的转化率为 a2,则 a2 a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3 被氧气催化氧化生成 NO 的反应的化学方程式是 。
②在容积恒定的密闭容器中进行反应 2NO(g)+O2(g) 2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若 t2、t4 时刻只改变一个条件,下
列说法正确的是(填选项序号) 。
a.在 t1~t2 时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在 t2 时,采取的措施可以是升高温度
c.在 t3~t4 时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在 t5 时,容器内 NO2 的体积分数是整个过程中的最大值
(3)硝酸厂常用如下 2 种方法处理尾气。
①催化还原法:催化剂存在时用 H2 将 NO2 还原为 N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则 H2 还原 NO2 生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用 Na2CO3 溶液吸收 NO2 生成 CO2。
若每 9.2gNO2 和 Na2FCO3 溶液反应时转移电子数为 0.1mol,则反应的离子方程式是 。
29.(12 分,每空 2 分)葡萄生长需要强光照、适宜温度,春季大棚中的弱光、低温条件影响其生长。科
研人员在不同低温条件下研究葡萄幼苗相关生理指标的变化,为葡萄的大棚栽培提供理论依据。实验
的基因步骤如下:
①挑选长势相同、具有 5~6 片真叶的某种葡萄功苗如下,平均分成三组,分别在常温 25°C、低温
15°C 及 5°C 的环境中培养 8 天,然后恢复常温培养 4 天。
②在培养的 0、2、4、6、8 天和恢复常温培养的第 2(R2)天、第 4(R4)天,进行各项生理指标测
定。
③记录实验结果(如下图所示),并对实验结果进行统计分析。
请回答下列问题。
(1)本实验中的对照组是 ;研究中测定的内容是 。
(2)在低温条件下,植物体内可产生大量的活性氧,活性氧的累积可引发膜脂过氧化,造成细胞膜系
统的损伤,膜脂过氧化的产物之一是丙二醛(MDA)。超氧化物歧化酶(SOD)是存在于植物细胞
中的最重要的清除活性氧的酶之一,对保护膜系统具有重要作用。膜脂的主要万分是 ,
膜脂过氧化会影响系统的 。
(3)综合图 1、图 2 所示结果:15°C 的低温处理,对葡萄幼苗造成的伤害是 (可逆、不可逆)
的,判断的依据是 .
30.(每空 2 分,共 18 分)近年来,家禽生态养殖在我国发展很快。某地区建立了“稻—鸭”
共作的生态型农业生产体系(如下图所示),实现了稻、鸭的双丰收。请回答下列问题。
(1)从生态系统的组成成分上分析,该生态系统的生产者是 ,沼气池中的生物属于 。
此生态系统的建立实现了物质的 。
(2)过去,羽毛加工厂通常将废弃的羽毛填埋于土壤中,利用土壤中的微生物将其分解。为了充分利
用废弃的羽毛中的蛋白质资源,某研究小组欲从土壤中分离出能够水解羽毛角蛋白的细菌,他们
应从 处取土壤,并制成土壤稀释液。以羽毛粉为唯一的氮源配制的培养基在功能上属
于 培养基。
(3)研究人员尝试利用羽毛粉制成饲料添加剂,以替代鱼粉添加剂来饲养产蛋鸡。请设计实验探究羽
毛粉能否替代鱼粉作为饲料添加剂饲养产蛋鸡。
实验材料:养殖的蛋鸡若干只,含羽毛粉的饲料,含鱼粉的饲料。
实验步骤:
①将实验用鸡随机均分为甲、乙两组;
② ,其他饲养条件相同;
③观察记录,统计各组鸡的 。预期结果及分析:
如果 ,说明羽毛粉能替代鱼粉;
如果 ,说明羽毛粉不能替代鱼粉。
31.(每空 2 分,20 分)人的生长激素(hGH)缺乏的原因之一是患者缺失 hGH 基因片段,简称 hGH 基因缺
失,患者表现为身材较正常人矮小。为进一步研究该病的遗传方式,指导优生,科研人员对首次发现
的两列患者家系做了调查,调
查的部分结果见下图。请回答
下列问题:
(1)hGH 基因位于 染色体上,III-4 杂合
子的概率是 。
(2)右对此家族中某一未出生的孩子进行产前诊断,
快 速 检 测 其 是 否 患 有 该 遗 传 病 , 应 以
基 因 为 标 准 ( 作 为 分 子 探 针 ), 通 过
方法进行检测。
(3)生长激素是由垂体分泌的。下图是人体内某些
生命活动调节过程示意图。垂体除分泌生长激
素外,还通过分泌[b] 来调节甲状腺的
活动,由其释放的[d] ,作用于肾脏,使
尿量减少来调节人体内的 。
(4)由图可知,内分泌调节的枢纽是 ,
④、⑤过程表示激素分泌的 调节。
(5)如果用含有激素 c 的饲料饲喂小白鼠,再将其
放到密闭的容器中饲养,此小鼠对缺氧的耐受
力将 。
2013 高考百天仿真冲刺卷
理综试卷(六)参考答案
第Ⅰ卷(选择题 共 120 分)
本卷共 20 小题,每小题 6 分,共 120 分.在每小题列出的四个选项中,选出符合题目要求的一项.
题号 1 2 3 4 5 6 7 8 9 10
答案 B C A C D B D A B C
题号 11 12 13 14 15 16 17 18 19 20
答案 C B A B B D C C D D
第Ⅱ卷(非选择题 共 180 分)
21.实验题(18 分)
(1)①等于 (3 分)
②C (3 分)
(2)①0.526 (3 分)
(0.524~0.528)
②R2 (3 分)
③5.2 (3 分)
(4.9~5.5)
④B(3 分)
22.(16 分)
(1)带电粒子在水平方向做匀速直线运动,
从 A 点运动到 B 点经历的时间
0v
Lt (4 分)
(2)带电粒子在竖直方向做匀加速直线运动
板间场强大小
d
UE (2 分)
加速度大小
m
qEa (2 分)
A、B 间竖直方向的距离 2
0
2
2
22
1
mdv
qULaty (2 分)
(3)带电粒子从 A 点运动到 B 点过程中,根据动能定理得
2
0
2
2
1
2
1 mvmvqU AB (2 分)
而 EyU AB (2 分)
解得带电粒子在 B 点速度的大小 2
0
22
222
2
0 vdm
LUqvv (2 分)
23.(18 分)
(1)设输电线总电阻的最大值为 r ,当通过输电线的电注以为 I 时,输电线上损耗的功率为 2P I r损
(2 分)
采用 U=500kV 直流电向某地区输电 9100.5 P W 时,通过输电线的电流
U
PI (2 分)
依题意得 %5 PP损
解得 5.2r (2 分)
(2)设卫星的轨道半径为 R,卫星所在轨道的向心加速度大小为 a ,根据万有引力定律和牛顿第二定
律得:
ma
R
MmG 2 (2 分)
解得 GMaR 2 (2 分)
当卫星在地表附近时, GMgR 2
0
在同步轨道上, GMRa t 2
1
根据题意,同步轨道的半径 0112 RRt
解得卫星在地球同步轨道上向心加速度的大小
2
2
2
0 /23.0 smg
R
Ra
t
t (2 分)
(3)三峡水电站的发电功率 WQghP 9
11 100.9 (2 分)
设卫星太阳能电池板的面积至少为 S,
则宇宙太阳能发电站的发电功率
SSPP 3
02 10%50%2010 (2 分)
根据题意 21 PP
所以太阳能电池板的面积至少为 26100.9 mS (2 分)
24.(20 分)
(1)B 做自由落体,下降高度为 I 时的速度为 0v
根据 axvvt 22
0
2 得
glv 20 (3 分)
此时细绳被拉直,A、B 速度的大小立即变成 1v ,
设绳子对 A、B 的冲量大小为 I,根据动量定理得
对 B 01 mvmvI (1 分)
对 A 12mvI (1 分)
解得细绳第一次被拉直瞬间绳对 A 冲量的大小
3
22 glmI (2 分)
(2)由(1)可得 A 第一次离开地面时速度的大小
3
2
3
0
1
glvv (2 分)
从 A 离开地面到 A 再次回到地面的过程中,A、B 组成的系统机械能守恒,
假设 A 第一次上升过程距离地面的最大高度为 1x ,则
)(2)2(2
1
11
2
1 xlmgmgxmglvmm (2 分)
解得
32
3 2
1
1
l
g
vx (2 分)
(3)从 A 离开地面到 A 再次回到地面的过程中,A、B 组成的系统机械能守恒,
所以,A 再次回到地面时速度的大小依然为 1v ,
即 B 再次回到距离地面高度为l 时速度的大小也为 1v 。
此后 B 做竖直上抛运动,落回距离地面高度为l 时速度的大小还是 1v 。(1 分)
根据(1)求解可得 A 第二次离开地面时速度的大小
3
1
2
vv (1 分)
同理可求 A 第二次离开地面上升的最大高度为
g
v
g
vx 2
3
3
1
2
3 2
1
2
2
2
2 (1 分)
……
A 第 n 次离开地面时速度的大小 1
11
33
n
n
n
vvv (1 分)
同理可求 A 第 n 次离开地面上升的最大高度为
g
v
g
vx n
n
n 2
3
3
1
2
3 2
1
)1(2
2
(1 分)
由于 A 的质量大于 B 的质量,A 最终会静止在地面上。
所以 A 运动的总路程 )(2 21 nxxxx
)
3
1
3
11(3
)1(22
2
1 ng
v
l4
3
25~28 题其他合理答案可给分
25.(16 分)
(1)①(2 分)蒸馏 ②(2 分)C8H8O3
(2)
①(2 分)
(2 分)
②(2 分)取代反应
③(2 分)
④(2 分)bd
⑤(2 分)
一定条件
催化剂
△
26.(12 分)
(1 分)Na2CO3 (1 分)CaCO3
(2 分)SiO2+2NaOH Na2SiO3+H2O
(2)(2 分)第 3 周期 IVA 族
(3)(2 分)
(4)(2 分)3SiCl4+4NH3 Si3N4+12HCl
(5)(2 分)ac
27.(16 分)
(1)①(2 分)Cu+2H2SO4(浓) CuSO4+SO2↑f+2H2O
②(2 分)Na2S2O3 在酸性溶液中不能稳定存在
(2 分)打开 K2,关闭 K1
③(2 分)漏斗、玻璃棒、烧杯
④(2 分)NaOH
(2 分)在 C 中的反应停止后,吸收 A 中产生的多余 SO2,防止空气污染
(2)①(2 分)加入最后一滴 I2 标准溶液后,溶液变蓝..,且半分钟内颜色不改变.........
②(2 分)90.2%
28.(14 分)
(1)①(2 分)bc
②(2 分)12.5%
(2 分)>
(2)①(2 分)4NH3+5O2 4NO+6H2O
②(2 分)ab
(3)①(2 分)4H2(g)+2NO2(g) N2(g)+4H2O(g) △H=-103.9kJ/mol
②(2 分)2NO2+CO3
2-=NO3
-+NO2
-+CO2
29.(12 分,每空 2 分)
(1)25℃(或:常温)条件下培养的葡萄幼苗
(不同温度处理下)SOD 活性和 MDA 的含量(答全给分)
(2)磷脂 结构和功能(流动性或选择透过性)(答出其中一项合理即可)
(3)可逆
恢复常温培养后,MDA 含量接近正常值(多答 SOD 酶的活性接近正常值不扣分)
30.(每空 2 分,共 18 分)
(1)水稻和杂草(答全给分) 分解者 良性循环(或:循环再生、循环利用)
(2)填埋废弃羽毛 选择
(3)②甲组饲喂适量的含羽毛粉的饲料,乙组饲喂等量的含鱼粉的饲料
③总产蛋量(或:平均产蛋率)
甲组鸡的总产蛋量(或:平均产蛋率)高于乙组或与乙组持平
甲组鸡的总产蛋量(或:平均产蛋率)低于乙组
(注意:答案合理给分,②所分组和③中分组的预测要一致)
(每空 2 分,20 分)
31.(每空 2 分,20 分)
(1)常 2/3
(2)hGH(或:正常) DNA 分子杂交
(3)促甲状腺激素 抗利尿激素 水(盐)平衡(或:渗透压平衡)
(4)下丘脑 反馈
(5)下降
版权所有:高考资源网(www.ks5u.com)