- 342.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第四节 用途广泛的金属材料 开发利用金属矿物
一、合金及常见金属材料
1.金属的通性
(1)金属具有共同的物理性质是 、 、 、 。大多数金属单质呈 色,但铜、金、铯等少数金属有特殊颜色。常温下金属大多都是固体,但 是液体。
(2)不同的金属,密度相差较大,其中密度最小的金属是 (0.534 g·cm-3),常见金属中密度最大的是铂 (Pt,俗称白金,21.45 g·cm-3)。金属的熔、沸点相差也很大,其中 的熔点都低于水的沸点(100℃),而熔点最高的 达到3 410 ℃。金属中硬度最大是铬(Cr)。
(3)在冶金工业中,称铁、铬、锰为黑色金属,其它金属称为有色金属;在有色金属范围内,又以单质密度4.5 g·cm-3为界,分成重金属和轻金属。根据在地壳中含量,又把金属分为常见金属和稀有金属等。
(4)金属的化学性质:金属原子的最外层电子数一般少于4个(但ⅣA、ⅤA、ⅥA族金属元素原子最外层电子数等于或多于4个),在化学反应中易 电子,表现出较强的 性。其主要表现为:①易与O2、Cl2、Br2等非金属反应;②部分能与H2O反应;③大多数能与酸反应;④一般能与盐溶液发生反应。
2.合金
⑴概念: 。
⑵性质特点:合金的物理性质各成分金属 。化学性质与各成分金属 。
①具有金属特性,属于 (混合、纯净)物。
②合金的硬度:一般比它的各成分金属的 ,
③多数合金的熔点:一般比它的各成分金属的 。
二、金属矿物的开发利用
1.金属在自然界中存在的形态:除了金 、铂等极少数金属外,绝大多数金属以 的形式存在于自然界中。在这些金属化合物中,金属元素都显 (正、负)化合价。
2.金属冶炼的实质:使金属化合物中的金属离子 的过程,Mn++ne-==M。
3.金属冶炼的一般步骤: (含除杂)→ → (含提纯)
4.金属冶炼的方法:由于金属的化学活动性不同,因此需采用不同的冶炼方法。
⑴活泼金属,如K、Ca、Na、Mg、Al等,用 法。
Mg: ; Al: 。
冶Mg等多数金属用氯化物,但冶Al用Al2O3。原因是 。
4
⑵中等活泼金属,如Zn、Fe、……Cu等,用 法,还原剂多用CO、Al、C、H2等。
H2还原WO3: 。
Al还原Cr2O3(铝热反应): 。
CO还原Fe2O3: 。
⑶不活泼金属,如Hg、Ag等,用 法。
HgO→Hg: ,Ag2O→Ag: 。
⑷极不活泼金属,如Pt、Au等,用 法。
5.铝热反应知识
(1)原理: 。(活泼性排在 的金属氧化物)。
(2)实验装置:如图所示。
氯酸钾作用 ,
镁条作用 。
(3)实验现象
①镁条 ,
②氧化铁粉末和铝粉剧烈反应,纸漏斗 。
③待熔融物冷却后,除去外层熔渣,可以发现落下的是 。
(4)铝热反应的应用
①由于该反应放热,铝在高温下还原出金属,常用这一原理 的金属,如铬、锰等。
②该反应原理可以应用在生产上,如 等。
规律总结
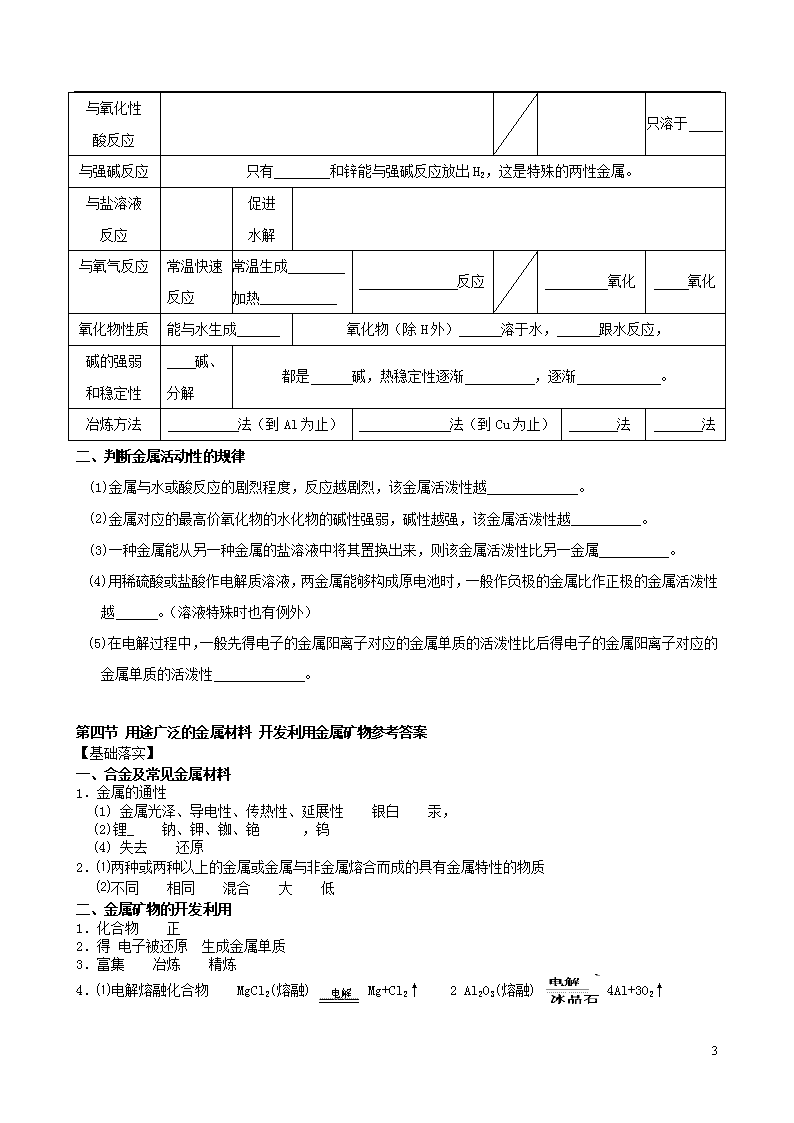
一、常见金属的主要化学性质总结:
金属活动
顺序表
K Ca Na
Mg Al Zn
Fe Sn Pb
(H)
Cu Hg Ag
Pt Au
性质变化
规律
元素的金属性 ,单质还原性 。
阳离子得电子能力 ,阳离子氧化性 。
与水的反应条件产物
不反应
生成
生成
与非氧化
性酸反应
反应
反应逐渐
4
与氧化性
酸反应
只溶于
与强碱反应
只有 和锌能与强碱反应放出H2,这是特殊的两性金属。
与盐溶液
反应
促进
水解
与氧气反应
常温快速反应
常温生成
加热
反应
氧化
氧化
氧化物性质
能与水生成
氧化物(除H外) 溶于水, 跟水反应,
碱的强弱
和稳定性
碱、
分解
都是 碱,热稳定性逐渐 ,逐渐 。
冶炼方法
法(到Al为止)
法(到Cu为止)
法
法
二、判断金属活动性的规律
(1)金属与水或酸反应的剧烈程度,反应越剧烈,该金属活泼性越 。
(2)金属对应的最高价氧化物的水化物的碱性强弱,碱性越强,该金属活泼性越 。
(3)一种金属能从另一种金属的盐溶液中将其置换出来,则该金属活泼性比另一金属 。
(4)用稀硫酸或盐酸作电解质溶液,两金属能够构成原电池时,一般作负极的金属比作正极的金属活泼性越 。(溶液特殊时也有例外)
(5)在电解过程中,一般先得电子的金属阳离子对应的金属单质的活泼性比后得电子的金属阳离子对应的金属单质的活泼性 。
第四节 用途广泛的金属材料 开发利用金属矿物参考答案
【基础落实】
一、合金及常见金属材料
1.金属的通性
(1) 金属光泽、导电性、传热性、延展性 银白 汞,
(2)锂_ 钠、钾、铷、铯 ,钨
(4) 失去 还原
2.⑴两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质
⑵不同 相同 混合 大 低
二、金属矿物的开发利用
1.化合物 正
2.得 电子被还原 生成金属单质
3.富集 冶炼 精炼
4.⑴电解熔融化合物 MgCl2(熔融) Mg+Cl2↑ 2 Al2O3(熔融) 4Al+3O2↑
4
⑵热还原 WO3+3H2 W+3H2O Cr2O3+2Al 2Cr+Al2O3 Fe2O3+3CO 2Fe+3CO2
⑶热分解 2 HgO2Hg+O2↑ 2Ag2O4Ag+O2↑
⑷物理富集
5.(1)高温下铝将金属氧化物中的金属还原出来 铝以后
(2)供氧,与镁共同产生高温 燃烧产生的高温
(3) 剧烈燃烧,发出耀眼的强光 的下部被烧穿,有熔融物落入沙中 铁
(4)冶炼熔点较高 野外焊接
【规律总结】
一、常见金属的主要化学性质总结:
金属活动
顺序表
K Ca Na
Mg Al Zn
Fe Sn Pb
(H)
Cu Hg Ag
Pt Au
性质变化
规律
逐渐减弱 , 由强到弱 。
由难到易 , 由弱到强 。
与水的反应条件产物
冷水
沸水
高温水蒸气
不反应
碱和氢气
氧化物 和H2
与非氧化
性酸反应
剧烈
减缓
不反应
与氧化性
酸反应
能反应,不放出H2
能反应不放H2
王水
与强碱反应
只有 铝 和锌能与强碱反应放出H2,这是特殊的两性金属。
与盐溶液
反应
先与水反应,再复分解
促进
水解
置换反应
与氧气反应
常温快速反应
致密膜
快速反应
加热快速
加热能够
不能
氧化物性质
碱
不 , 不 ,
碱的强弱
和稳定性
强
不
弱 , 减弱 , 易分解 。
冶炼方法
电解
热还原
热分解
物理富集
二、判断金属活动性的规律
强 强 强 强 差
4
相关文档
- 高考化学一轮复习第3讲物质的组成2021-05-149页
- 高考化学一轮复习课时分层训练35烃2021-05-146页
- 2020高考化学二轮增分优选练 选择2021-05-144页
- 高考化学二轮复习选择题1~25题满分2021-05-1411页
- 2018高考化学第一轮复习专题溶液的2021-05-146页
- 2年模拟高考化学化学平衡移动化学2021-05-1411页
- (新课标)广西2020高考化学二轮复习 2021-05-144页
- 2020高考化学第一轮复习 专题 化学2021-05-146页
- 2019届高考化学第二轮复习 专题十2021-05-148页
- 高考化学一轮复习练习题(9)(含解析)新2021-05-147页