- 504.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
山东省临清一中2009届高考理科综合全真模拟试题(五)
化学
第I卷(必做,共28分)
一、 选择题(本题包括7小题,每小题只有一个选项符合题意,每小题4分,共28分。)
9.NA代表阿伏加德罗常数的值,下列说法正确的是
A.1 mol HNO3见光分解,转移电子数4NA
B.28 g晶体硅中含有Si-Si键的数目为2NA
C.100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+
D.Cu与浓硝酸产生的22.4 L(标准状况)气体中含原子数为3NA
10.根据热化学方程式:S(s)+O2(g)=SO2(g);△H=-297.23kJ·mol-1分析下列说法正确的是
A.S(g)+O2(g)=SO2(g);△H=-297.23kJ·mol-1
B.S(g)+O2(g)=SO2(g);△H>-297.23kJ·mol-1
C.S(g)+O2(g)=SO2(g);△H<+297.23kJ·mol-1
D.S(g)+O2(g)=SO2(g);△H>+297.23kJ·mol-1
11.下列溶液中的各组离子,因发生氧化还原反应而不能大量共存的是
A.H+、Na+、NO、SO B.AlO、OH-、Na+、NH
C.Fe3+、SCN-、SO、Cl- D.Fe3+、HCO、Cl-、NH
12.镁铁混合物4.9g,溶解在过量某浓度和稀硝酸中,完全反应得到标况下气体2.24L(假
设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是
A.6g B.8g C.10g D.12g
13.通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是
A.分子中N—C1键键长比CCl4分子中C—C1键键长长
B.分子中的所有原于均达到8电子稳定结构
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
14.下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确
的是
A.产生气体体积①=②
B.电极上析出固体质量①<②
C.电极反应式:①中阳极:4OH-——4e-=2H2O+O2↑②中负极2H++2e-=H2↑
D.溶液的pH变化:①减小②增大
15.恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:
A(g)+2B(g)2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-)
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.当v正(A)=2v逆(B)时,可确定反应达平衡
第Ⅱ卷(必做42分+选做8分,共50分)
28.(15分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
(正)
(正)
(逆)
(正)
(逆)
(逆)
t0
t1
t2
t3
t4
t5
t6
t7
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= 。
(4)达到平衡后,改变某一外界条件(不改变
N2、CO的量),反应速率与时间t的关系如右图。
图中t4时引起平衡移动的条件可能是 ;
图中表示平衡混合物中CO的含量最高的一段时间
是 。
(5)若该反应的平衡常数为 K=729,则在同温度
下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是多少?(写出计算过程) 提示:272 = 729
29.(15分)已知X、Y、Z、W四种短周期元素的原子半径依次减小。在周期表中X与Y、Y与Z均位于同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物。请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关式子表示)
(1)(XY)2分子中所有原子最外层都满足8电子,请写出其结构式: ;(XY)2可与W2化合生成WXY,其水溶液是一种酸,某浓度该酸的钾盐(KXY)溶液能使酚酞试液显红色,请用离子方程式表示其原因: .
(2)WXY分子中的W原子被氨基(—NH2)取代后可得氰胺,氰胺电子式为: 。
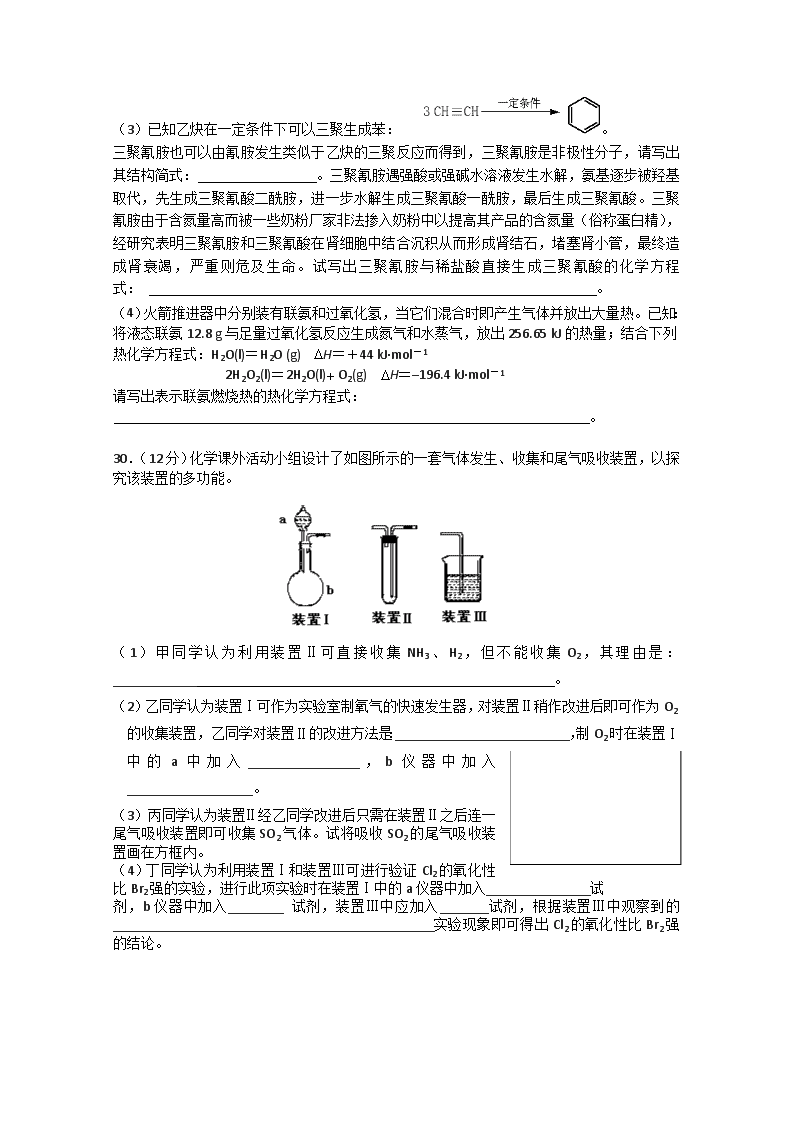
(3)已知乙炔在一定条件下可以三聚生成苯: 。
三聚氰胺也可以由氰胺发生类似于乙炔的三聚反应而得到,三聚氰胺是非极性分子,请写出其结构简式: 。三聚氰胺遇强酸或强碱水溶液发生水解,氨基逐步被羟基取代,先生成三聚氰酸二酰胺,进一步水解生成三聚氰酸一酰胺,最后生成三聚氰酸。三聚氰胺由于含氮量高而被一些奶粉厂家非法掺入奶粉中以提高其产品的含氮量(俗称蛋白精),经研究表明三聚氰胺和三聚氰酸在肾细胞中结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭,严重则危及生命。试写出三聚氰胺与稀盐酸直接生成三聚氰酸的化学方程式: 。
(4)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体并放出大量热。已知:将液态联氨12.8 g与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;结合下列热化学方程式:H2O(l)=H2O (g) DH=+44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH=–196.4 kJ·mol-1
请写出表示联氨燃烧热的热化学方程式:
。
30.(12分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能。w.w.w.k.s.5.u.c.o.m
(1)甲同学认为利用装置Ⅱ可直接收集NH3、H2,但不能收集O2,其理由是:____________ 。
(2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:_________________________,制O2时在装置Ⅰ中的a中加入________________,b仪器中加入__________________。
(3)丙同学认为装置Ⅱ经乙同学改进后只需在装置Ⅱ之后连一尾气吸收装置即可收集SO2气体。试将吸收SO2的尾气吸收装置画在方框内。
(4)丁同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中加入_______________试
剂,b仪器中加入________ 试剂,装置Ⅲ中应加入_______试剂,根据装置Ⅲ中观察到的______________________________________________实验现象即可得出Cl2的氧化性比Br2强的结论。
w.w.w.k.s.5.u.c.o.m
【选做部分】共3个大题,考生选择其中一个在指定区域作答。
31.(8分)下图涉及多种无机化工反应,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化学肥料,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2∶1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
⑴试写出下列指定物质的化学式:B_________________,F_____________。
⑵反应①的化学方程式为___________________________________________。
⑶反应④的离子方程式为___________________________________________。
⑷上述反应中属于非氧化还原反应的有_____________(填写相应反应的序号)
32.现有部分前四周期元素的性质或原子结构如下表:
元素编号
元素性质或原子结构
A
第三周期中的半导体材料
B
L层s电子数比p电子数少1
C
第三周期主族元素中其第一电离能最大
D
前四周期呀中其未成对电子数最多
(1)B单质分子中,含有________个键和__________个键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
33.在下图所示的转化关系中。A是一种链状羧酸,分子式为;F中含有七个原子构成的环;H是一种高分子化合物。请填写下列空白:
(1)写出F的结构简式:___________
(2)请写出:
①A→H的化学方程式:______________________________________________
②B与溶液反应的化学方程式:________________________________
(3)反应G→丙二酸的反应类型是:______________________________________
参考答案
一、选择题
9.B10.D11.A12.C13.B14.D15.C
二、填空题
28.(共15分)
(1)氮气 氮化硅(化学式同样给分) (2分)
(2)K=[c(CO)]6/[c(N2)]2 (2分)
(3)< 减小 6 mol••L-1.min-1 (每空1分共3分)
(4)升高温度或增大压强 t3~t4 (每空2分共4分)
高温
(5)(4分)50% [解:设2molN2转化xmol,由:
3SiO2(s)+6C(s)+ 2N2(g) Si3N4(s)+ 6CO(g)
则平衡时: (2-x) 3xmol
(3x)6/(2-x)2=729 (3x)3/(2-x)=27 得:x3+x-2=0 只能:x=1 故转化50%]
29.(15分)(1)NCCN(2分);
CN—+ H2O HCN +OH— (3分)
H
N
C
N
H
(2)氰胺电子式: (2分) (2分)
+3NH4Cl
+3HCl+3H2O
(3) (3分)
(4)N2H4(l)+O2(l)=N2(g)+2H2O(l) ; ΔH=-621.23 kJ·mol-1 (3分)
30.(12分)(1)H2、NH3的密度比空气小,而O2的密度比空气大。(3分)
(2)把装置Ⅱ中的进气导管改为长导管插到试管底部,出气导管管口应与胶塞相平
3%的H2O2溶液、少量的MnO2粉末。(3分)
(3)
(3分)
(4)浓盐酸、KMnO4、NaBr溶液、溶液由无色变橙色。(3分)
31.(8分)⑴Al2O3(1分) CO(NH2)2(1分)
⑵N2+Al2O3+3C 1400~1800℃
3CO+2AlN(2分)
⑶AlN+OH-+H2O=AlO+NH3↑(2分)
⑷④⑦(2分,少一个正确答案扣1分、错选一个倒扣一分扣完为止)
32.(8分)
(1)1 (1分) 2 (1分) ,三角锥形(1分)
(2)低于(1分) Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高(2分)
(3)1s22s22p63s23p64s13d5(2分
33.(8分)
(3)氧化反应 (2分)
www.ks5u.com
www.ks5u.com
www.ks5u.com
w.w.w.k.s.5.u.c.o.mwww.ks5u.com
w.w.w.k.s.5.u.c.o.m
www.ks5u.com