- 518.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型五 化学反应与能量
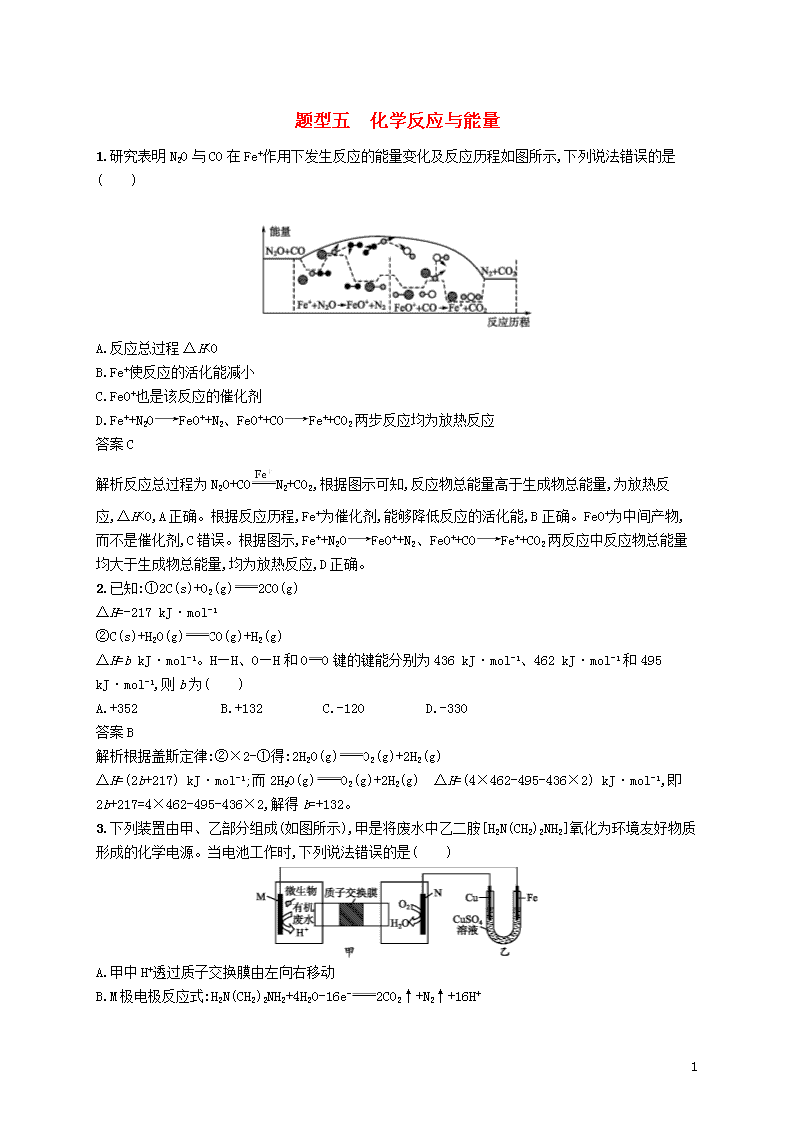
1.研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是( )
A.反应总过程ΔH<0
B.Fe+使反应的活化能减小
C.FeO+也是该反应的催化剂
D.Fe++N2OFeO++N2、FeO++COFe++CO2两步反应均为放热反应
答案C
解析反应总过程为N2O+CON2+CO2,根据图示可知,反应物总能量高于生成物总能量,为放热反应,ΔH<0,A正确。根据反应历程,Fe+为催化剂,能够降低反应的活化能,B正确。FeO+为中间产物,而不是催化剂,C错误。根据图示,Fe++N2OFeO++N2、FeO++COFe++CO2两反应中反应物总能量均大于生成物总能量,均为放热反应,D正确。
2.已知:①2C(s)+O2(g)2CO(g)
ΔH=-217 kJ·mol-1
②C(s)+H2O(g)CO(g)+H2(g)
ΔH=b kJ·mol-1。H—H、O—H和OO键的键能分别为436 kJ·mol-1、462 kJ·mol-1和495 kJ·mol-1,则b为( )
A.+352 B.+132 C.-120 D.-330
答案B
解析根据盖斯定律:②×2-①得:2H2O(g)O2(g)+2H2(g)
ΔH=(2b+217) kJ·mol-1;而2H2O(g)O2(g)+2H2(g) ΔH=(4×462-495-436×2) kJ·mol-1,即2b+217=4×462-495-436×2,解得b=+132。
3.下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
A.甲中H+透过质子交换膜由左向右移动
B.M极电极反应式:H2N(CH2)2NH2+4H2O-16e-2CO2↑+N2↑+16H+
7
C.一段时间后,乙中CuSO4溶液浓度基本保持不变
D.当N极消耗0.25 mol O2时,则铁极增重16 g
答案D
解析甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应。M是负极,N是正极,质子透过质子交换膜由M极移向N极,即由左向右移动,A正确。H2N(CH2)2NH2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和H+,电极反应式为H2N(CH2)2NH2+4H2O-16e-2CO2↑+N2↑+16H+,B正确。乙部分是在铁上镀铜,电解质溶液浓度基本不变,所以乙中CuSO4溶液浓度基本保持不变,C正确。当N电极消耗0.25 mol氧气时,则转移0.25 mol×4=1 mol电子,所以铁电极增重 mol×64 g·mol-1=32 g,D错误。
4.已知:
①2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
③H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
A.H2(g)的燃烧热为142.9 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
答案B
解析根据燃烧热的定义可知,H2(g)的燃烧热为285.8 kJ·mol-1,A错误。2 mol(即4 g) H2(g)完全燃烧放出571.6 kJ的热量,2 mol(即64 g) CH3OH(l)完全燃烧放出1 452 kJ的热量,单位质量的H2(g)放出的热量多,B正确。中和反应是放热反应,硫酸与氢氧化钡溶液反应,由于有硫酸钡沉淀生成,所以反应的ΔH≠-57.3 kJ·mol-1,C错误。根据盖斯定律,由,可得热化学方程式:3H2(g)+CO2(g)CH3OH(l)+H2O(l) ΔH=-131.4 kJ·mol-1,D错误。
5.混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:
7
其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液。关于镍氢电池,下列说法不正确的是( )
A.充电时,阴极附近pH降低
B.电动机工作时溶液中OH-向甲移动
C.放电时正极反应式为:NiOOH+H2O+e-Ni(OH)2+OH-
D.电极总反应式为:MH+NiOOHM+Ni(OH)2
答案A
解析充电时阴极发生还原反应,电极反应为M+H2O+e-MH+OH-,生成氢氧根,pH增大,A错误。电动机工作时是放电过程,原电池工作时,溶液中氢氧根离子向负极即甲电极迁移,B正确。正极得电子发生还原反应,电极反应式为NiOOH+H2O+e-Ni(OH)2+OH-,C正确。放电过程的正极反应为NiOOH+H2O+e-Ni(OH)2+OH-,负极反应为MH+OH--e-M+H2O,则电池总反应为MH+NiOOHM+Ni(OH)2,D正确。
6.已知:
2H2(g)+O2(g)2H2O(g) ΔH1
H2(g)+Cl2(g)2HCl(g) ΔH2
4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH3
N2(g)+3H2(g)2NH3(g) ΔH4
2NH3(g)+3Cl2(g)N2(g)+6HCl(g) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH2>0
B.ΔH3>0,ΔH4>0
C.ΔH2=ΔH4+ΔH5
D.ΔH3=ΔH1-2ΔH2
答案D
解析2H2(g)+O2(g)2H2O(g)属于放热反应,ΔH1<0;H2(g)+Cl2(g)2HCl(g)属于放热反应,ΔH2<0;N2(g)+3H2(g)2NH3(g)属于放热反应,ΔH4<0,A、B错误;根据盖斯定律,ΔH2=(ΔH4+ΔH5)×,C错误;根据盖斯定律,ΔH3=ΔH1-2ΔH2,D正确。
7.近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )
7
A.石墨极发生的反应是2H2O+2e-H2↑+2OH-
B.有机电解质和水溶液不可以互换区域
C.标准状况下产生22.4 L的氢气时,正极消耗锂的质量为14 g
D.该装置不仅可提供电能,还可得到清洁的氢气
答案C
解析根据图示信息可知,石墨电极上产生氢气,应该是正极,该电极上发生得电子的还原反应:2H2O+2e-H2↑+2OH-,A正确。由于金属Li可以与水反应生成氢氧化锂和氢气,但是与有机电解质不反应,所以有机电解质和水溶液不可以互换区域,B正确。金属Li与水发生反应2Li+2H2O2LiOH+H2↑,标准状况下产生22.4 L的氢气时,金属锂是负极,负极消耗锂的质量为14 g,C错误。该装置是将化学能转化为电能的装置,装置不仅可提供电能,并且反应产物是氢气,能提供能源,D正确。
8.已知反应:
①H2(g)+O2(g)H2O(g) ΔH1
②N2(g)+O2(g)NO2(g) ΔH2
③N2(g)+H2(g)NH3(g) ΔH3
则反应2NH3(g)+O2(g)2NO2(g)+3H2O(g)的ΔH为( )
A.2ΔH1+2ΔH2-2ΔH3
B.ΔH1+ΔH2-ΔH3
C.3ΔH1+2ΔH2+2ΔH3
D.3ΔH1+2ΔH2-2ΔH3
答案D
7
解析根据盖斯定律,①×3+②×2-③×2得2NH3(g)+O2(g)2NO2(g)+3H2O(g) ΔH=3ΔH1+2ΔH2-2ΔH3。
9.瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+4O2--8e-CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
答案C
解析电子不能在电池内电路流动,只能在外电路中流动,A错误。O2-是阴离子,应向负极移动,即O2-由正极(电极b)流向负极(电极a),B错误。甲烷所在电极a为负极,电极反应式为CH4+4O2--8e-CO2+2H2O,C正确。1 mol O2得4 mol电子生成2 mol O2-,故当固体电解质中有1 mol O2-通过时,电子转移2 mol,D错误。
10.LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH溶液和LiCl溶液。下列说法不正确的是( )
A.B极区电解液为LiOH溶液
B.每产生标准状况下2.24 L氢气,就有0.1 mol阳离子通过交换膜进入阴极区
C.电解过程中Li+向B电极迁移
D.阳极电极反应式为2Cl--2e-Cl2↑
答案B
解析根据图知,B电极上有氢气生成,则B为电解池阴极,A为阳极。B电极反应式为2H2O+2e-2OH-+H2↑,有氢氧根离子生成,所以B极区电解液为LiOH溶液,A极区电解液为LiCl溶液,A正确。每产生标准状况下2.24 L氢气,有0.2 mol电子转移,根据电荷守恒知,有0.2 mol阳离子通过交换膜进入阴极区,B错误。电解池工作时,电解质溶液中的阳离子向阴极移动,即电解过程中Li+向B电极迁移,C正确。A电极为阳极,电极上氯离子放电,电极反应式为2Cl--2e-Cl2↑,D正确。
7
11.(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.2 kJ·mol-1 ①
CH4(g)+CO2(g)2CO(g)+2H2(g)
ΔH=+247.4 kJ·mol-1 ②
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知表示H2(g)、CO(g)和CH3OH(l)燃烧热的ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
①用太阳能分解10 mol水消耗的能量是 kJ。
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
。
答案(1)CH4(g)+2H2O(g)CO2(g)+4H2(g)
ΔH=+165.0 kJ·mol-1
(2)①2 858
②CH3OH(l)+O2(g)CO(g)+2H2O(l)
ΔH=-443.5 kJ·mol-1
解析(1)CH4(g)+2H2O(g) CO2(g)+4H2(g)可通过①式×2-②式得到,故ΔH=+165.0 kJ·mol-1。
(2)①因为1 mol氢气燃烧生成1 mol水放出的热量是285.8 kJ,则1 mol水分解需要吸收285.8 kJ的能量,所以用太阳能分解10 mol水需要的能量是2 858 kJ。②根据题意写出如下热化学方程式:ⅰ.CO(g)+O2(g)CO2(g) ΔH=-283.0 kJ·mol-1,ⅱ.CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1,应用盖斯定律,由ⅱ式-ⅰ式得CH3OH(l)+O2(g)CO(g)+2H2O(l) ΔH=(-726.5+283.0) kJ·mol-1=-443.5 kJ·mol-1。
12.利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2废水,如下图所示;电解过程中溶液发生反应:Cr2+6Fe2++14H+2Cr3++6Fe3++7H2O。
7
(1)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨Ⅱ是电池的 极;石墨Ⅰ附近发生的电极反应式为 。
(2)工作时,甲池内的N向 极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为 。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为 。
(4)若溶液中减少了0.01 mol Cr2,则电路中至少转移了 mol电子。
(5)向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至1.0×10-5 mol·L-1,溶液的pH应调至 。
答案(1)正 NO2+N-e-N2O5
(2)石墨Ⅰ 1∶4
(3)Fe-2e-Fe2+
(4)0.12
(5)5
解析(1)根据图示知甲池为燃料电池,电池工作时,石墨Ⅰ附近NO2转变成N2O5,发生氧化反应,电极反应式为NO2+N-e-N2O5;石墨Ⅱ是电池的正极,O2得电子发生还原反应,电极反应式为O2+2N2O5+4e-4N。(2)电池工作时,电解质溶液中的阴离子移向负极,即甲池内的N向石墨Ⅰ极移动;根据两极的电极反应式结合得失电子守恒知,在相同条件下,消耗O2和NO2的体积比为1∶4。(3)乙池为电解池,Fe(Ⅰ)棒为电解池的阳极,发生的电极反应为Fe-2e-Fe2+。(4)根据反应Cr2+6Fe2++14H+2Cr3++6Fe3++7H2O知,若溶液中减少了0.01 mol Cr2,则参加反应的Fe2+为0.06 mol,根据电极反应:Fe-2e-Fe2+知电路中至少转移了0.12 mol电子。(5)常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,c(Cr3+)=10-5 mol·L-1,则c3(OH-)=1.0×10-27,c(OH-)=1.0×10-9 mol·L-1,c(H+)=10-5 mol·L-1,溶液的pH应调至5。
7