- 521.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型十二 综合化学实验
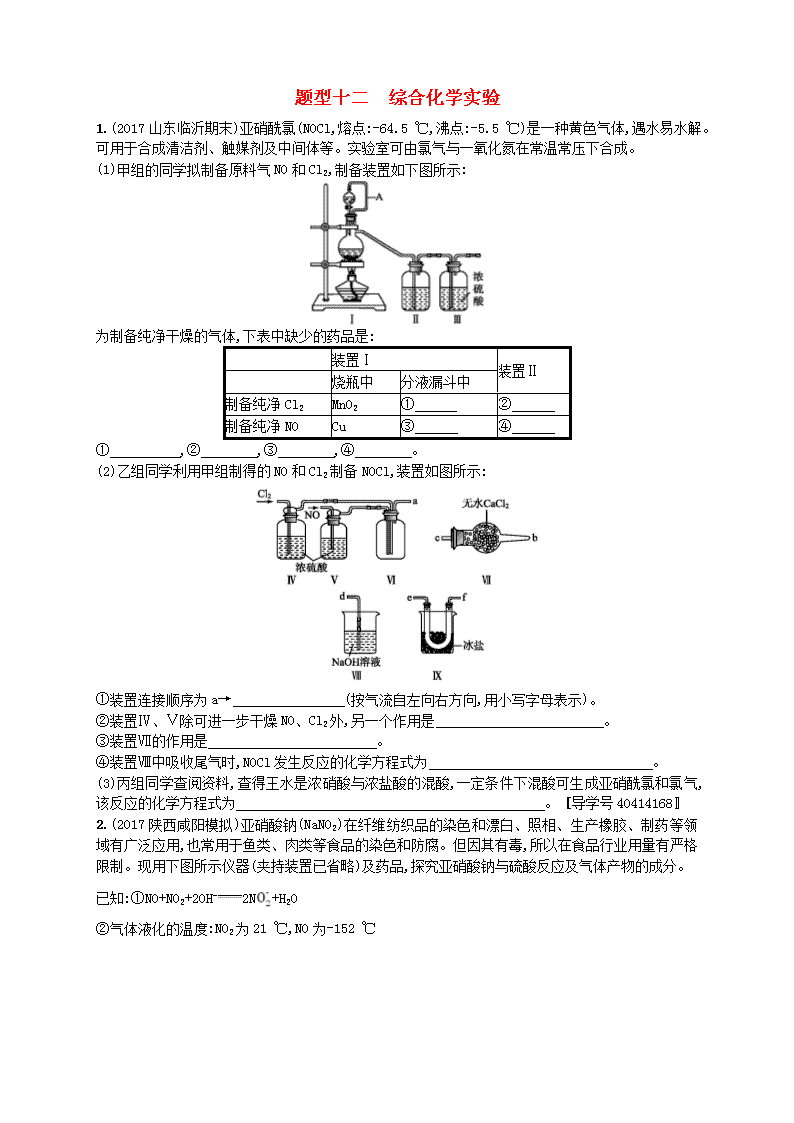
1.(2017山东临沂期末)亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ
装置Ⅱ
烧瓶中
分液漏斗中
制备纯净Cl2
MnO2
①
②
制备纯净NO
Cu
③
④
① ,② ,③ ,④ 。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
①装置连接顺序为a→ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是 。
③装置Ⅶ的作用是 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为 。 〚导学号40414168〛
2.(2017陕西咸阳模拟)亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-2N+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、 、 、 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是 。
(3)再关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
3.(2017河南信阳一模)化学兴趣小组对牙膏中摩擦剂成分及其含量进行探究。查资料得知:某品牌牙膏中的摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分不与酸、碱反应。
Ⅰ.利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是 (填字母代号)。
a.组装好仪器后,密封装置A的进气口和装置D的出气口,分液漏斗中装水,打开分液漏斗的两个活塞,若水滴不进去,则整套装置不漏气
b.装好药品后,密封装置A的进气口和装置D的出气口,打开分液漏斗的两个活塞,若盐酸滴不进去,则整套装置不漏气
c.微热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气
(2)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有 。
(3)盐酸有一定程度的挥发性,为什么该兴趣小组不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置? 。
(4)实验中准确称取16.00 g样品三份,进行三次测定,测得BaCO3平均质量为7.88 g。则样品中碳酸钙的质量分数为 。
Ⅱ.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验。
实验步骤
预期现象与结论
取适量牙膏样品于试管中,
〚导学号40414169〛
4.某研究性学习小组为合成1-丁醇。查阅资料得知一条合成路线:
CH3CHCH2+CO+H2CH3CH2CH2CHOCH3CH2CH2CH2OH
CO的制备原理:HCOOHCO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式 、 ;
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 、 ;c和d中盛装的试剂分别是 、 ;
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 ;
①饱和Na2SO3溶液 ②KMnO4酸性溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正反应放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是 ;
a.低温、高压、催化剂
b.适当的温度、高压、催化剂
c.常温、常压、催化剂
d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:
粗品滤液有机层1-丁醇、乙醚纯品
试剂1为 ,操作1为 ,操作2为 ,操作3为 。
5.(2017四川乐山二模,节选)电石的主要成分是CaC2,常用作焊接机的乙炔发生剂。现有含CaO杂质的CaC2试样。设计以下实验,测定CaC2试样的纯度。[反应的化学方程式为CaC2+2H2OCa(OH)2+C2H2↑]请从下图中选用适当的装置,完成该实验。
(1)制取C2H2最好选④中的 装置,所选用装置的连接顺序是 。(填各接口A~E的顺序)
(2)若实验时称取的试样为1.4 g,产生的乙炔在标准状况下的体积为448 mL,此试样中CaC2的质量分数为 。(保留3位有效数字)
题型十二 综合化学实验
1.答案 (1)①浓盐酸 ②饱和食盐水 ③稀硝酸 ④水
(2)①e→f(或f→e)→c→b→d ②通过观察气泡调节气体的流速 ③防止水蒸气进入反应器 ④NOCl+2NaOHNaCl+NaNO2+H2O
(3)HNO3(浓)+3HCl(浓)NOCl↑+Cl2↑+2H2O
解析 (1)实验室通常用浓盐酸与MnO2混合加热制氯气,因浓盐酸有挥发性,氯气中混有的HCl气体需要用饱和食盐水除去,最后再用浓硫酸干燥即可得纯净Cl2;用铜与稀硝酸反应制NO气体,因装置中混有的氧气与NO反应生成少量NO2,因此需要通过水除去可能混有的NO2,最后再用浓硫酸干燥即可得纯净NO。(2)亚硝酰氯熔点、沸点较低,遇水易水解,故需要保持装置内干燥和反应混合气体干燥,同时需要考虑Cl2和NO尾气对环境的污染,需要用NaOH溶液除尾气,则装置连接顺序为a→e→f(或f→e)→c→b→d。②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,还可以通过观察气泡调节气体的流速,控制NO和Cl2的比例。③亚硝酰氯遇水易水解,装置Ⅶ的作用是防止水蒸气进入反应器。④装置Ⅷ中NaOH溶液能吸收NO、Cl2及NOCl的尾气,其中NOCl与NaOH发生反应的化学方程式为NOCl+2NaOHNaCl+NaNO2+H2O。(3)浓硝酸与浓盐酸在一定条件下生成亚硝酰氯和氯气,发生反应的化学方程式为HNO3(浓)+3HCl(浓)NOCl↑+Cl2↑+2H2O。
2.答案 (1)E D B
(2)防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰
(3)①装置D中通入氧气后出现红棕色气体
②冷凝,使NO2完全液化
(4)4NO2+O2+4NaOH4NaNO3+2H2O 水蒸气会与NO2反应产生NO,造成对NO的来源认识不清
(5)2NaNO2+H2SO4Na2SO4+NO2↑+NO↑+H2O
解析 (1)为了检验装置A中生成的气体产物,在仪器A中制取气体,然后在装置C中用浓硫酸对气体进行干燥处理;然后把气体通过E冰水浴,检验NO2的产生,再把气体通过D装置,检验是否产生NO气体,由于NO、NO2都是大气污染物,为了防止大气污染,最后把气体通过NaOH溶液进行尾气处理。所以仪器的连接顺序(按左→右连接)为A、C、E、D、B。(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是防止空气中的氧气与可能产生的NO反应生成NO2,造成对A中反应产物检验的干扰。(3)①确认A中产生的气体含有NO,依据的现象是装置D中通入氧气后出现红棕色气体,反应是2NO+O22NO2;②装置E的作用是冷凝,使NO2完全液化,防止影响NO的检验。(4)如果向D中通入过量O2,则从该装置逸出的气体为NO2和O2,则在装置B中发生反应的化学方程式为4NO2+O2+4NaOH4NaNO3+2H2O。如果没有装置C,水蒸气会与NO2反应产生NO,造成对NO的来源认识不清。(5)通过上述实验探究过程,可得出装置A中反应产生的气体中含有NO、NO2,根据电子守恒和原子守恒,可得反应的化学方程式是2NaNO2+H2SO4Na2SO4+NO2↑+NO↑+H2O。
3.答案 Ⅰ.(1)a
(2)把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收
(3)碳酸氢钠虽能吸收盐酸,但也产生CO2
,影响实验结果的测量,HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3
(4)25%
Ⅱ.
实验步骤
预期现象与结论
加入足量的NaOH溶液,过滤,向滤液中滴加盐酸
滤液中先出现白色沉淀,随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝
解析 Ⅰ.(1)根据气压差原理检验装置的气密性,检验装置气密性必须在装药品之前进行,在装置中如果微热B,由于锥形瓶内长导管被液封,所以无论装置气密性是否良好,A装置中导管都不会出现液柱。(2)装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小,持续缓缓通入空气的作用为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收。(3)挥发出来的氯化氢气体与饱和碳酸氢钠溶液反应会产生二氧化碳,影响实验结果测量,而HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3,所以不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置。(4)根据碳元素守恒可知关系式:CaCO3~BaCO3,BaCO3平均质量为7.88 g,所以碳酸钙的质量为m(CaCO3)=×100 g·mol-1=4.00 g,所以样品中碳酸钙的质量分数为×100%=25%。
Ⅱ.确定该牙膏摩擦剂中氢氧化铝的存在,根据氢氧化铝具有两性的特点,可以将牙膏样品加入足量的NaOH溶液中,过滤后,向滤液中滴加盐酸,如果滤液中先出现白色沉淀,随后沉淀溶解,则说明该牙膏摩擦剂中含氢氧化铝,所以设计实验为
实验步骤
预期现象与结论
取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤,向滤液中滴加盐酸
滤液中先出现白色沉淀,随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝
4.答案 (1)Zn+2HClZnCl2+H2↑ (CH3)2CHOH
CH2CHCH3↑+H2O (2)保持恒压 防倒吸 NaOH溶液 浓硫酸 (3)④⑤①②③(或④⑤①③②) (4)b (5)饱和NaHSO3溶液 过滤 萃取 蒸馏
解析 (1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,制备H2的化学方程式为Zn+2HClZnCl2+H2↑;2-丙醇通过消去反应即可得到丙烯,方程式为(CH3)2CHOHCH2CHCH3↑+H2O。
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸。又因为甲酸易溶于水,所以必须防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO。
(3)检验丙烯可以用KMnO4酸性溶液,检验SO2可以用KMnO4酸性溶液、品红溶液或石灰水,检验CO2可以用石灰水,检验水蒸气可以用无水CuSO4,所以检验这四种气体必须考虑试剂的选择和顺序。只要通过溶液,就会产生水蒸气,因此先检验水蒸气,然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①②③或④⑤①③②。
(4)由于合成正丁醛的反应是一个体积减小的可逆反应,所以采用高压,有利于增大反应速率和提高原料气的转化率;正向反应是放热反应,虽然低温有利于提高原料气的转化率,但不利于增大反应速率,因此要采用适当的温度;催化剂不能提高原料气的转化率,但有利于增大反应速率,缩短达到平衡所需要的时间,故正确选项是b。
(5)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇,因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开。
5.答案 (1)丙 E、C、D、B
(2)91.4%(或0.914)