- 282.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2015年江苏省高考化学试卷
一、单项选择:本题包括10小题,每小题2分,共计20分.每小题只有一个选项符合1.(2分)(2015•江苏)“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
A.采取低碳、节俭的生活方式
B.按照规定对生活废弃物进行分类放置
C.深入农村和社区宣传环保知识
D.经常使用一次性筷子、纸杯、塑料袋等
2.(2分)(2015•江苏)下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子:Cl
B.氯离子(Cl﹣)的结构示意图:
C.氯分子的电子式:
D.氯乙烯分子的结构简式:H3C﹣CH2Cl•
3.(2分)(2015•江苏)下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能
途径a:CCO+H2CO2+H2O
途径b:CCO2
C.在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数
D.通过化学变化可以直接将水转变为汽油
4.(2分)(2015•江苏)在CO2中,Mg燃烧生成MgO和C.下列说法正确的是( )
A.元素C的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C.在该反应条件下,Mg的还原性强于C的还原性
D.该反应中化学能全部转化为热能
5.(2分)(2015•江苏)短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述正确的是( )
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
6.(2分)(2015•江苏)常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.=1×10﹣13mol•L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
D.水电离的c(H+)=1×10﹣13mol•L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
7.(2分)(2015•江苏)下列实验操作正确的是( )
A.用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH
B.中和滴定时,滴定管用所盛装的反应液润洗2~3次
C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
D.用装置乙加热分解NaHCO3固体
8.(2分)(2015•江苏)给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.粗硅SiCl4Si
B.Mg(OH)2MgCl2(aq)Mg
C.Fe2O3FeCl3(aq)无水FeCl3
D.AgNO3(aq)[Ag(NH3)2]OH(aq)Ag
9.(2分)(2015•江苏)下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl﹣+ClO﹣
B.Na2CO3溶液中CO32﹣的水解:CO32﹣+H2O=HCO3﹣+OH﹣
C.酸性溶液中KIO3与KI反应生成I2:IO3﹣+I﹣+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O
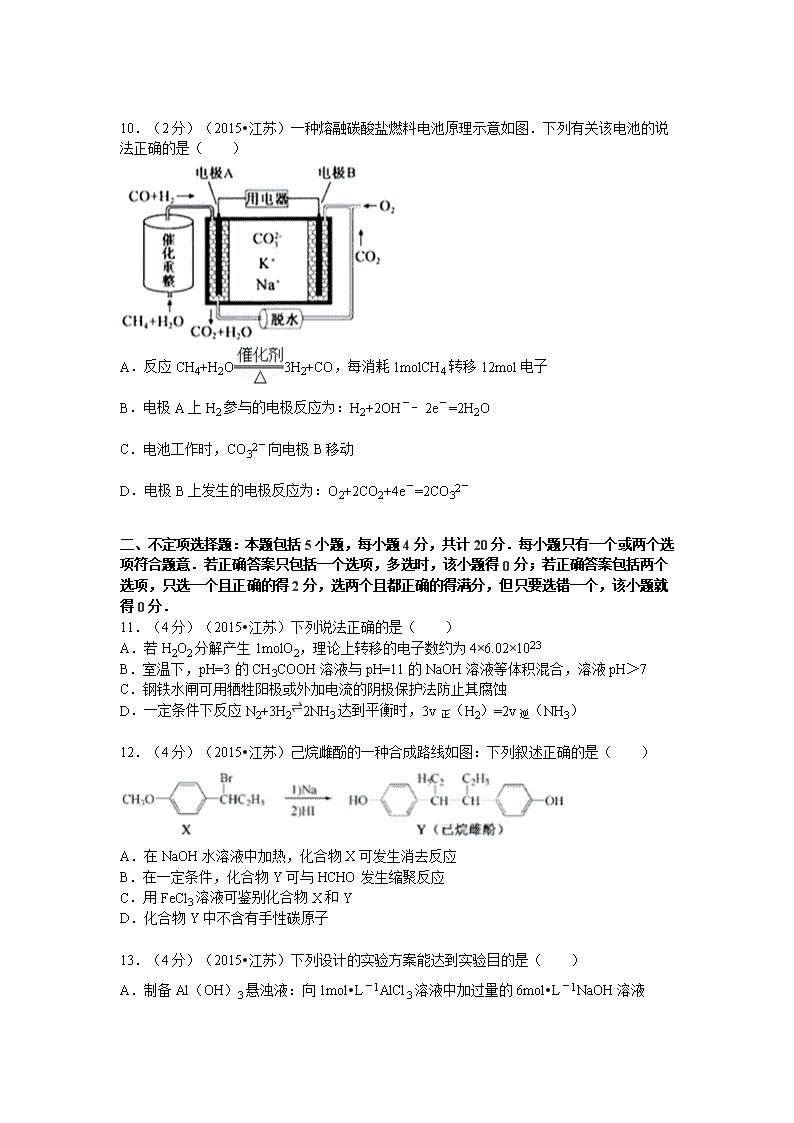
10.(2分)(2015•江苏)一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
A.反应CH4+H2O3H2+CO,每消耗1molCH4转移12mol电子
B.电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C.电池工作时,CO32﹣向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
二、不定项选择题:本题包括5小题,每小题4分,共计20分.每小题只有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分.
11.(4分)(2015•江苏)下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2⇌2NH3达到平衡时,3v正(H2)=2v逆(NH3)
12.(4分)(2015•江苏)己烷雌酚的一种合成路线如图:下列叙述正确的是( )
A.在NaOH水溶液中加热,化合物X可发生消去反应
B.在一定条件,化合物Y可与HCHO发生缩聚反应
C.用FeCl3溶液可鉴别化合物X和Y
D.化合物Y中不含有手性碳原子
13.(4分)(2015•江苏)下列设计的实验方案能达到实验目的是( )
A.制备Al(OH)3悬浊液:向1mol•L﹣1AlCl3溶液中加过量的6mol•L﹣1NaOH溶液
B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水
C.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象
D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象
14.(4分)(2015•江苏)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol•L﹣1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3﹣)+c(CO32﹣)
B.向0.10mol•L﹣1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32﹣)
C.向0.10mol•L﹣1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32﹣)+c(HSO3﹣)+c(H2SO3)]
D.向0.10mol•L﹣1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl﹣)
15.(4分)(2015•江苏)在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)⇌2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
A.反应CO2(g)+C(s)⇌2CO(g)的△S>0、△H<0
B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
二、非选择题
16.(12分)(2015•江苏)以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3.
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42﹣)随时间变化见图.清液pH>11时CaSO4转化的离子方程式为 ;能提高其转化速率的措施有 (填序号)
A.搅拌浆料 B.加热浆料至100℃C.增大氨水浓度 D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体.滤液中物质的量浓度最大的两种阴离子为 和 (填化学式);检验洗涤是否完全的方法是 .
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是 .
17.(15分)(2015•江苏)化合物F是一种抗心肌缺血药物的中间体,可以通过以下方法合成:
(1)化合物A中的含氧官能团为 和 (填官能团的名称).
(2)化合物B的结构简式为 ;由C→D的反应类型是: .
(3)写出同时满足下列条件的E的一种同分异构体的结构简式 .
Ⅰ.分子含有2个苯环Ⅱ.分子中含有3种不同化学环境的氢
(4)已知:RCH2CNRCH2CH2NH2,请写出以为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHOCH3COOHCH3COOCH2CH3.
18.(12分)(2015•江苏)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化 L(标准状况)SO2.
(2)已知:Ksp[Al(OH)3]=1×10﹣33,Ksp[Fe(OH)3]=3×10﹣39,pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10﹣6mol•L﹣1),需调节溶液pH范围为 .
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4•H2O晶体,需控制结晶温度范围为 .
(4)准确称取0.1710gMnSO4•H2O样品置于锥形瓶中,加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol•L﹣1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL.计算MnSO4•H2O样品的纯度(请给出计算过程)
19.(15分)(2015•江苏)实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.已知K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液,②在0℃﹣5℃、强碱性溶液中比较稳定,③在Fe3+和Fe(OH)3催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2.
(1)装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为 ,将制备的Cl2通过装置B可除去 (填化学式).
(2)Cl2和KOH在较高温度下反应生成KClO3,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是 .
(3)制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液的混合方式为 .
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L﹣1KOH溶液中, (实验中须使用的试剂有:饱和KOH溶液,乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱).
20.(14分)(2015•江苏)烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)═NO2(g)+O2(g)△H=﹣200.9kJ.mol﹣1
NO(g)+O2(g)═NO2(g)△H=﹣58.2kJ.mol﹣1
SO2(g)+O3(g)═SO3(g)+O2(g)△H=﹣241.6kJ.mol﹣1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H= mol•L﹣1.
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见图.
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是 .
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 .
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO32﹣将NO2转化为NO2﹣,其离子方程式为: .
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32﹣)= [用c(SO42﹣)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因 .
四.(12分)【选做题】本题包括21、22两小题,请选定一中一小题,并在相应的答题区域内作答.若多做,则按A小题评分.
21.(12分)(2015•江苏)下列反应曾用于检测司机是否酒后驾驶:2Cr2O72﹣+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为 ;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是 (填元素符号).
(2)CH3COOH中C原子轨道杂化类型为 .1mol CH3COOH分子中含有σ键的数目为 .
(3)与H2O互为等电子体的一种阳离子为 (填化学式);H2O与CH3CH3OH可以任意比例互溶,除因为它们都是极性分子外,还因为 .
答案
一、DCCCA BBADD
二、C;BC;BD;D;BC
三,16(1) CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42﹣+H2O或CaSO4+CO32﹣=CaCO3+SO42﹣ ; AC
(2) SO42﹣ 和 HCO3﹣ ; 取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全 .
(3) 浸取液温度上升,溶液中氢离子浓度增大,促进固体中钙离子浸出 .
17.(1) 醚键 和 醛基 .
(2) ; 取代反应 .
(3) .
(4)
18.(1) 4.48 .
(2) 5.0~7.1 .
(3) 高于60℃ .
(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=0.02L×0.0500mol=1.00×10﹣3mol,根据Mn元素守恒,m(MnSO4•H2O)=1.00×10﹣3mol×169g/mol=0.169g,纯度为×100%=98.8%,
答:MnSO4•H2O样品的纯度为98.8%.
19.(1) 2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O ; HCl .
(2) 缓慢滴加盐酸、装置C用冰水浴中 .
(3) 在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中 .
(4) 用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2﹣3次后,在真空干燥箱中干燥 .
20.(1) ﹣317.3 .
(2)① O3将NO2氧化为更高价态氮氧化物 .
② 可能是其反应速率较慢 .
(3) SO32﹣+2NO2+2OH﹣=SO42﹣+2NO2﹣+H2O .
(4); CaSO3转化为CaSO4使溶液中SO32﹣的浓度增大,加快SO32﹣与NO2的反应速率 .
21.(1) 1s22s22p63s23p63d3 ; O .
(2) sp3和sp2 . 7mol .
(3) H2F+ ; H2O与CH3CH3OH之间可以形成氢键 .