- 306.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
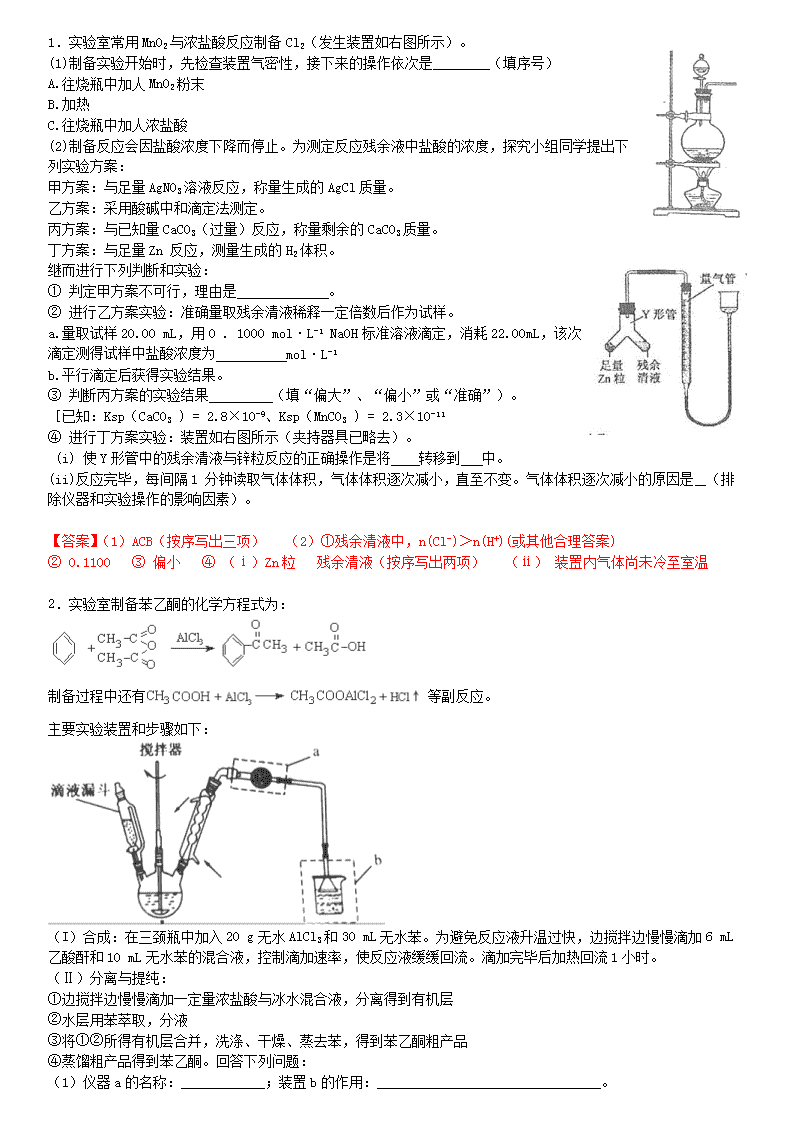
1.实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如右图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如右图所示(夹持器具已略去)。
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_(排除仪器和实验操作的影响因素)。
【答案】(1)ACB(按序写出三项) (2)①残余清液中,n(Cl-)>n(H+)(或其他合理答案)
② 0.1100 ③ 偏小 ④ (ⅰ)Zn粒 残余清液(按序写出两项) (ⅱ) 装置内气体尚未冷至室温
2.实验室制备苯乙酮的化学方程式为:
制备过程中还有等副反应。
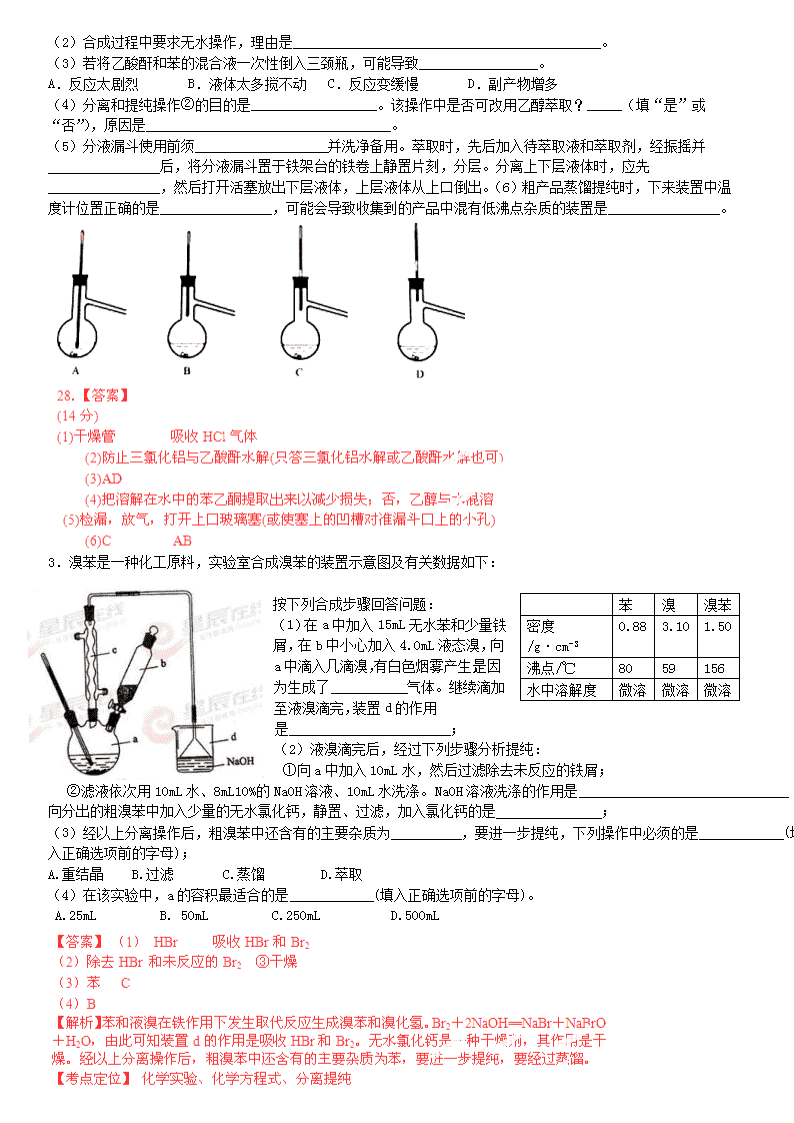
主要实验装置和步骤如下:
(I)合成:在三颈瓶中加入20 g无水AlCl3和30 mL无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6 mL乙酸酐和10 mL无水苯的混合液,控制滴加速率,使反应液缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮。回答下列问题:
(1)仪器a的名称:____________;装置b的作用:________________________________。
(2)合成过程中要求无水操作,理由是____________________________________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致_________________。
A.反应太剧烈 B.液体太多搅不动 C.反应变缓慢 D.副产物增多
(4)分离和提纯操作②的目的是__________________。该操作中是否可改用乙醇萃取?_____(填“是”或“否”),原因是___________________________________。
(5)分液漏斗使用前须___________________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并________________后,将分液漏斗置于铁架台的铁卷上静置片刻,分层。分离上下层液体时,应先________________,然后打开活塞放出下层液体,上层液体从上口倒出。(6)粗产品蒸馏提纯时,下来装置中温度计位置正确的是________________,可能会导致收集到的产品中混有低沸点杂质的装置是________________。
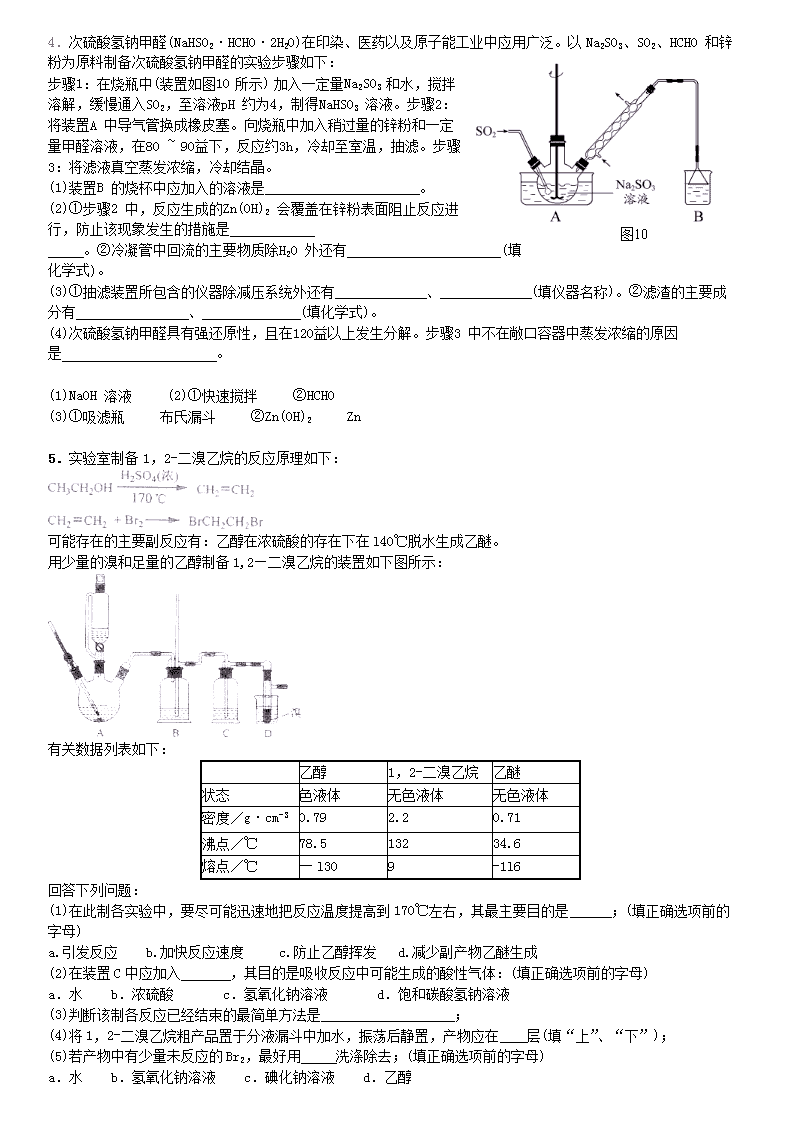
3.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯
溴
溴苯
密度/g·cm-3
0.88
3.10
1.50
沸点/℃
80
59
156
水中溶解度
微溶
微溶
微溶
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
图10
4.次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图10 所示) 加入一定量Na2SO3 和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3 溶液。步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 ~ 90益下,反应约3h,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B 的烧杯中应加入的溶液是 。
(2)①步骤2 中,反应生成的Zn(OH)2 会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是
。②冷凝管中回流的主要物质除H2O 外还有 (填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有 、 (填仪器名称)。②滤渣的主要成分有 、 (填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是 。
(1)NaOH 溶液 (2)①快速搅拌 ②HCHO
(3)①吸滤瓶 布氏漏斗 ②Zn(OH)2 Zn
5.实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇
1,2-二溴乙烷
乙醚
状态
色液体
无色液体
无色液体
密度/g·cm-3
0.79
2.2
0.71
沸点/℃
78.5
132
34.6
熔点/℃
一l30
9
-1l6
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
6.草酸是一种重要的化工产品。实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6 +8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为 。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是 。
(3)装置C用于尾气吸收,当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,原因是 (用化学方程式表示)
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是 。
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
7.二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
+2FeCl3+2FeCl2+2HCl
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答下列问题:
(1)写出装置图中玻璃仪器的名称:a___________,b____________。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:____。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用__________等方法促进晶体析出。
(3)抽滤所用的滤纸应略_______(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是________。
A.无水乙醇 B.饱和NaCl溶液 C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:___________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是________。
A.15min B.30min C.45min D.60min
(2)AD 用玻璃棒摩擦容器内壁 加入晶种
(3)小于 D
(4)趁热过滤 C
8.某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CO的制备原理:HCOOHCO↑+H2O,并设计出原料气的制备装置(如下图)
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式: , 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , ;
C和d中承装的试剂分别是 , 。若用以上装置制备H2, 气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水
④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______________。
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1—丁醇粗品,为纯化1—丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1—丁醇118℃,并设计出如下提纯路线:
试剂1为_________,操作1为________,操作2为_______,操作3为_______。
【答案】(1)Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOHCH2=CHCH3↑+H2O;
(2)恒压 防倒吸 NaOH溶液 浓硫酸 分液漏斗 蒸馏烧瓶
(3)④⑤①②③(或④⑤①③②);
(4)b
(5)饱和NaHSO3溶液 过滤 萃取 蒸馏