- 81.25 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
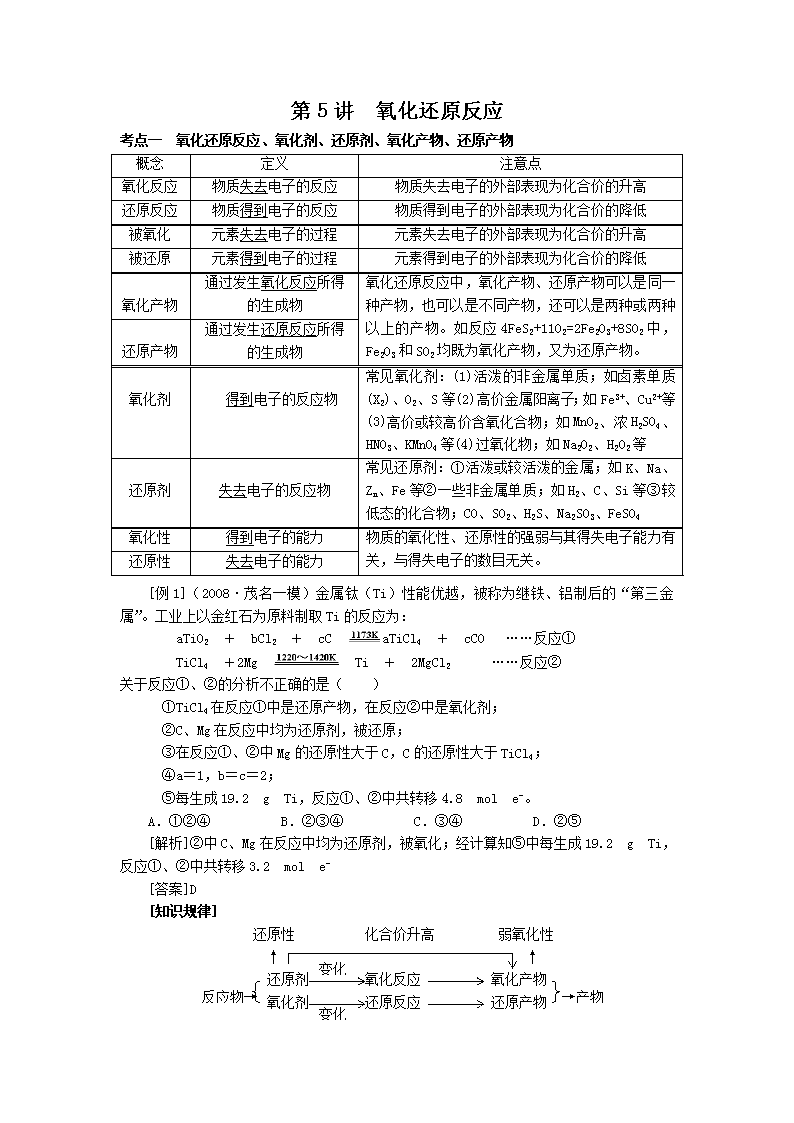
第5讲 氧化还原反应
考点一 氧化还原反应、氧化剂、还原剂、氧化产物、还原产物
概念
定义
注意点
氧化反应
物质失去电子的反应
物质失去电子的外部表现为化合价的升高
还原反应
物质得到电子的反应
物质得到电子的外部表现为化合价的降低
被氧化
元素失去电子的过程
元素失去电子的外部表现为化合价的升高
被还原
元素得到电子的过程
元素得到电子的外部表现为化合价的降低
氧化产物
通过发生氧化反应所得的生成物
氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物
通过发生还原反应所得的生成物
氧化剂
得到电子的反应物
常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等
还原剂
失去电子的反应物
常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4
氧化性
得到电子的能力
物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性
失去电子的能力
[例1](2008·茂名一模)金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2 + bCl2 + cC aTiCl4 + cCO ……反应①
TiCl4 +2Mg Ti + 2MgCl2 ……反应②
关于反应①、②的分析不正确的是( )
①TiCl4在反应①中是还原产物,在反应②中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成19.2 g Ti,反应①、②中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
[解析]②中C、Mg在反应中均为还原剂,被氧化;经计算知⑤中每生成19.2 g Ti,反应①、②中共转移3.2 mol e-
[答案]D
[知识规律]
还原性 化合价升高 弱氧化性
变化
↑ ↑
→产物
反应物→
还原剂 氧化反应 氧化产物
变化
氧化剂 还原反应 还原产物
↓ ↓
氧化性 化合价降低 弱还原性
考点二 物质的氧化性强弱、还原性强弱的比较。
氧化性→得电子性,得到电子越容易→氧化性越强
还原性→失电子性,失去电子越容易→还原性越强
由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。
1.根据金属活动性顺序来判断:
一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。
2.根据非金属活动性顺序来判断:
一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
3.根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:
规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。
4.根据氧化还原反应发生的条件来判断:
如:Mn02+4HCl(浓) MnCl2+C12↑+2H20
2KMn04+16HCl(浓)=2MnCl2+5C12↑+8H2O
后者比前者容易(不需要加热),可判断氧化性 KMn04>Mn02
5.根据反应速率的大小来判断:
如:2Na2SO3+O2=2Na2SO4(快), 2H2SO3+O2=2H2SO4(慢), ,
其还原性: Na2SO4>H2SO3>SO2
6.根据被氧化或被还原的程度来判断:
如:,, 即氧化性:。
又如:,,
即有还原性:。
7.根据原电池的正负极来判断:
在原电池中,作负极的金属的还原性一般比作正极金属的还原性强。
8.根据电解池中溶液里阴、阳离子在两极放电顺序来判断。
如:Cl-失去电子的能力强于OH-,还原性:。
9.根据元素在周期表中位置判断:
(1)对同一周期金属而言,从左到右其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
(2)对同主族的金属而言,从上到下其金属活泼性依次增强。如Li、Na、K、Rb、Cs金属活泼性依次增强,其还原性也依次增强。
(3)对同主族的非金属而言,从上到下其非金属活泼性依次减弱。如F、Cl、Br、I非金属活泼性依次减弱,其氧化性也依次减弱。
10.根据(氧化剂、还原剂)元素的价态进行判断:
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
一般来说,同种元素价越高,氧化性越强;价越低还原性越强。如氧化性:Fe3+>Fe2+>Fe,
S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4< HClO34< HClO24< HClO。
注意:①物质的氧化性、还原性不是一成不变的。同一物质在不同的条件下,其氧化能力或还原能力会有所不同。如:氧化性:HNO3(浓)>HNO3(稀);Cu与浓H2SO4常温下不反应,加热条件下反应;KMnO4在酸性条件下的氧化性比在中性、碱性条件下强。
②原子的氧化性一般都强于分子的氧化性。如:氧化性等。
[例2](2007·聊城二模)常温下,在下列溶液中发生如下反应
①16H++10Z-+2XO4-=2x2++5Z2+8H2O ②2A2+ +B2=2A3++2B- ③2B-+Z2=B2+2Z- 由此判断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行。 B.Z元素在①③反应中均被还原
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
[解析]根据上述规律4可得:氧化性顺序:XO4->Z2>B2>A3+,还原性顺序:A2+>B->Z->X2+。
[答案]B
考点三 氧化还原反应方程式的配平方法
1.配平原则:电子守恒、原子守恒、电荷守恒
2.配平步骤(以高锰酸钾和浓盐酸反应制氯气为例):
①标出化合价变化了的元素的化合价。如:
+7 -1 +4 0
KMnO4+HCl==KCl+MnCl2+Cl2↑+H2O
②根据元素存在的实际形式调整发生了氧化还原反应的物质的系数,使之成1︰1的关系。如:+7 -1 +4 0
KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
③调整系数,使化合价升降总数相等。
化合价↓ 5×②
KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
化合价↑2×⑤
④根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。如:2KMnO4+10HCl==KCl+2MnCl2+5Cl2↑+H2O
⑤利用元素守恒,用观察方法配平没有参加氧化还原反应的其他物质的系数。如:
2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O
⑥检查方程式两边各原子的个数是否相等,离子方程式还要检查方程式两边的离子所带的电荷数是否相等。
[例3](2008·江西信丰中学)对于反应KMnO4+HCl→KCl+MnCl2+Cl2+H2O(未配平),若有0.1mol KMnO4参加反应,下列说法正确的是( )
A.其转移电子0.5mol B.生成Cl20.5mol
C.参加反应HCl为16mol D.Cl2是还原产物
[解析]配平该方程式为:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O ,Mn由+7→+2,得到5电子,则0.1mol KMnO4参加反应消耗HCl为1.6mol,转移的电子为0.5mol,生成的Cl2为0.25mol,故A正确,B、C不正确;Cl2是氧化产物,故D不正确。
[答案]A
考点四 电子转移守恒应用
电子转移守恒法是依据氧化剂与还原剂得失电子数目相等这一原则进行计算的。电子转移守恒法是氧化还原反应计算的最基本的方法。
[例4](2007·广州·学业水平测试)在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A.l∶1∶1 B.2∶2∶1 C.2∶3∶1 D.4∶3∶2
[解析]用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢制氧气,O则由-1价转化为0价。现要制得相同的O2,所以用过氧化氢制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半。
[答案]B