- 396.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
钠、镁、铝、铁和铜等金属单质及其化合物的化学性质
【本讲教育信息】
一、教学内容:
高考第二轮复习《专题8》
二、教学目的
1、关注钠、铝、铁、铜等金属及其重要化合物在生产、生活中的应用实例,通过对钠、铝、铁、铜等金属及其重要化合物性质的实验探究,增强学习化学的兴趣,发展科学探究能力。
2、了解钠、铝、铁、铜等金属及其重要化合物的主要物理性质。
3、了解钠、铝、铁、铜等金属分别与氧气、水、酸、碱、盐等物质的反应情况,了解其共性和个性。
4、了解氧化钠、氧化铝、氧化铁、氧化铜等金属氧化物分别与水、酸、碱等物质反应的情况。
5、了解氢氧化铝、氢氧化铁、氢氧化亚铁的制备方法,了解氢氧化铝的两性,了解氢氧化铝、氢氧化铁的受热分解。
6、比较碳酸钠、碳酸氢钠的溶解性、热稳定性、与酸的反应,掌握鉴别碳酸钠和碳酸氢钠的方法。
7、了解Fe3+的氧化性,认识Fe3+和Fe2+之间的相互转化,了解Fe3+的检验。
8、了解钠、钾的焰色反应。
9、能列举钢、铝合金等合金材料的重要应用。
三、重点、难点
1、钠、镁、铝、铁和铜等金属单质的主要物理性质。
2、钠、镁、铝、铁、铜等金属单质的主要化学性质。
3、钠、镁、铝、铁、铜等金属的氧化物的主要物理性质和化学性质。
4、钠、镁、铝、铁、铜等金属的氢氧化物的主要物理性质和化学性质。
5、碳酸钠、碳酸氢钠的溶解性、热稳定性、与酸的反应,鉴别碳酸钠和碳酸氢钠的方法。
6、Fe3+的氧化性,Fe3+和Fe2+之间的相互转化,Fe3+的检验。
四、考点分析
本专题内容在高考中的主要考查点是:
1、钠、镁、铝、铁和铜等金属单质的主要物理性质。
2、钠、镁、铝、铁、铜等金属单质的主要化学性质。
3、钠、镁、铝、铁、铜等金属的氧化物的主要物理性质和化学性质。
4、钠、镁、铝、铁、铜等金属的氢氧化物的主要物理性质和化学性质。
5、碳酸钠、碳酸氢钠的溶解性、热稳定性、与酸的反应,鉴别碳酸钠和碳酸氢钠的方法。
6、Fe3+的氧化性,Fe3+和Fe2+之间的相互转化,Fe3+的检验。
五、知识网络
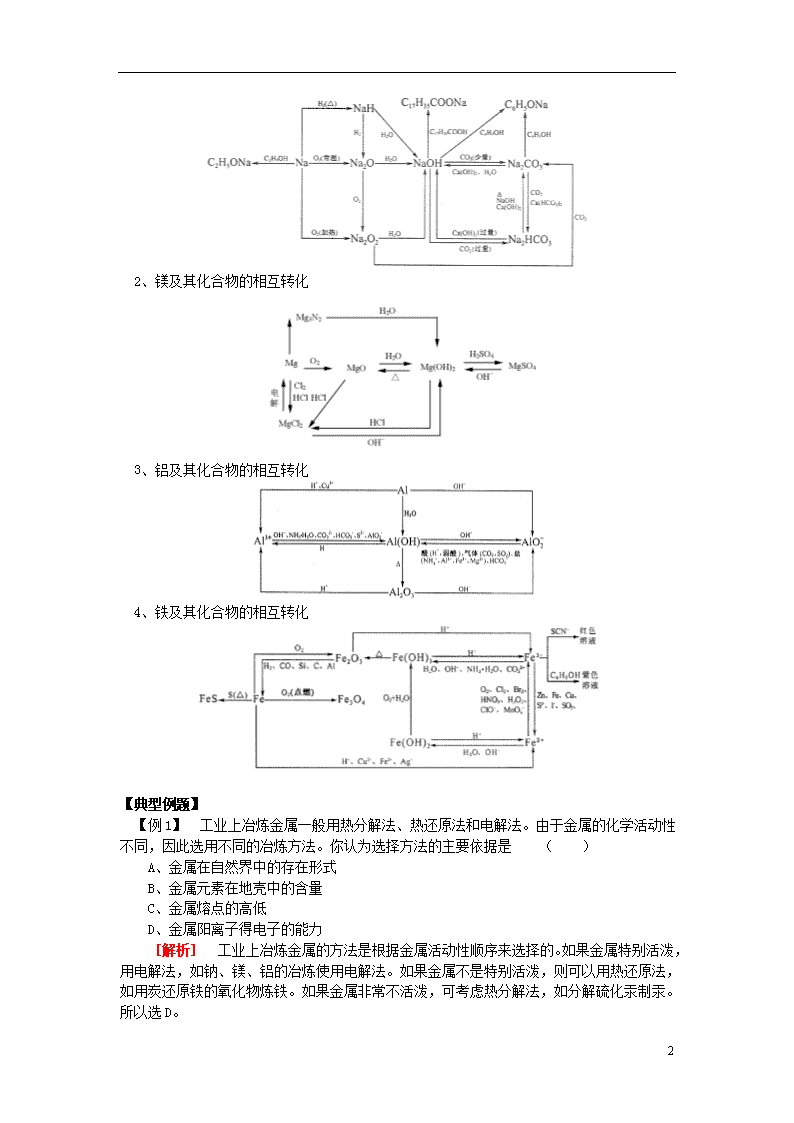
1、钠及其化合物的相互转化
5
2、镁及其化合物的相互转化
3、铝及其化合物的相互转化
4、铁及其化合物的相互转化
【典型例题】
【例1】 工业上冶炼金属一般用热分解法、热还原法和电解法。由于金属的化学活动性不同,因此选用不同的冶炼方法。你认为选择方法的主要依据是 ( )
A、金属在自然界中的存在形式
B、金属元素在地壳中的含量
C、金属熔点的高低
D、金属阳离子得电子的能力
[解析] 工业上冶炼金属的方法是根据金属活动性顺序来选择的。如果金属特别活泼,用电解法,如钠、镁、铝的冶炼使用电解法。如果金属不是特别活泼,则可以用热还原法,如用炭还原铁的氧化物炼铁。如果金属非常不活泼,可考虑热分解法,如分解硫化汞制汞。所以选D。
5
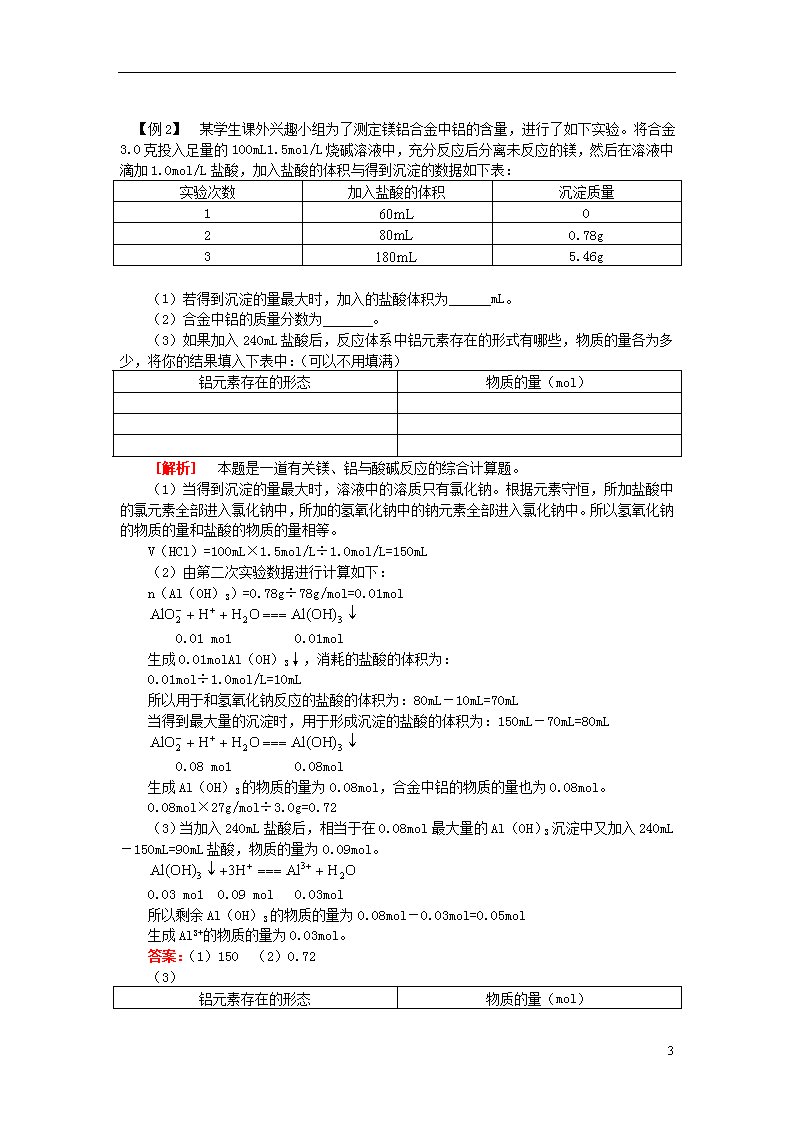
【例2】 某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验。将合金3.0克投入足量的100mL1.5mol/L烧碱溶液中,充分反应后分离未反应的镁,然后在溶液中滴加1.0mol/L盐酸,加入盐酸的体积与得到沉淀的数据如下表:
实验次数
加入盐酸的体积
沉淀质量
1
0
2
0.78g
3
5.46g
(1)若得到沉淀的量最大时,加入的盐酸体积为 mL。
(2)合金中铝的质量分数为 。
(3)如果加入240mL盐酸后,反应体系中铝元素存在的形式有哪些,物质的量各为多少,将你的结果填入下表中:(可以不用填满)
铝元素存在的形态
物质的量(mol)
[解析] 本题是一道有关镁、铝与酸碱反应的综合计算题。
(1)当得到沉淀的量最大时,溶液中的溶质只有氯化钠。根据元素守恒,所加盐酸中的氯元素全部进入氯化钠中,所加的氢氧化钠中的钠元素全部进入氯化钠中。所以氢氧化钠的物质的量和盐酸的物质的量相等。
V(HCl)=100mL×1.5mol/L÷1.0mol/L=150mL
(2)由第二次实验数据进行计算如下:
n(Al(OH)3)=0.78g÷78g/mol=0.01mol
0.01 mo1 0.01mol
生成0.01molAl(OH)3↓,消耗的盐酸的体积为:
0.01mol÷1.0mol/L=10mL
所以用于和氢氧化钠反应的盐酸的体积为:80mL-10mL=70mL
当得到最大量的沉淀时,用于形成沉淀的盐酸的体积为:150mL-70mL=80mL
0.08 mo1 0.08mol
生成Al(OH)3的物质的量为0.08mol,合金中铝的物质的量也为0.08mol。
0.08mol×27g/mol÷3.0g=0.72
(3)当加入240mL盐酸后,相当于在0.08mol最大量的Al(OH)3沉淀中又加入240mL-150mL=90mL盐酸,物质的量为0.09mol。
0.03 mo1 0.09 mol 0.03mol
所以剩余Al(OH)3的物质的量为0.08mol-0.03mol=0.05mol
生成Al3+的物质的量为0.03mol。
答案:(1)150 (2)0.72
(3)
铝元素存在的形态
物质的量(mol)
5
Al3+(或AlCl3)
0.03
Al(OH)3
0.05
【例3】 将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是 ( )
A、HCl B、K2SO4
C、CuCl2 D、饱和NaOH溶液
[解析] 钠遇水或水溶液均能发生反应置换出氢气,故以上四个选项均能满足题干中有气体放出这一条件。解题的关键在于题干中的最后“溶液质量减轻”。若投入金属钠的质量小于脱离溶液的物质的质量,则溶液的质量必定减轻。选项A、B中每有23g钠进入溶液均生成lgH2,溶液质量增加22g。C选项中由于钠与水反应生成的氢氧化钠还能进一步与CuCl2反应,析出氢氧化铜沉淀,所以溶液质量减轻,D选项中氢氧化钠溶液是饱和溶液,投入钠后消耗水,析出氢氧化钠固体,溶液质量也减轻。
答案:CD
【例4】 向含有下列离子的溶液中通入Cl2时,该离子的浓度没有减小的是 ( )
A、Fe2+ B、OH-
C、Ag+ D、Fe3+
[解析] Cl2可和溶液中的Fe2+、OH-反应,故A、B离子浓度减小;C项,Cl2+H2O===H++Cl-+HClO,Cl-+Ag+===AgCl↓,Ag+浓度减小。
答案:D
【例5】 氧化铜在高温下可以与一氧化碳反应,若一氧化碳过量,可以生成红色的单质铜;若一氧化碳不足量,可以生成红色的氧化亚铜(Cu2O)。
(1)试写出这两个反应的化学方程式。
(2)ag氧化铜与一氧化碳反应后得到bg红色固体,则当a、b满足什么关系时,产物中一定没有氧化亚铜。
[解析] 氧化铜与一氧化碳反应的两个化学方程式是
。
当恰好发生第一个反应时:
80 64
ag bg
即当时,产物中一定没有氧化亚铜。
答案:(1)
(2)当a/b=5/4时,产物中一定没有Cu2O。
5
【例6】 某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag,称量时应该使用的主要仪器的名称是 。
(2)将样品溶解于足量的稀盐酸,过滤,滤液中主要含有 ,滤渣中含有 ,溶解、过滤用到的玻璃仪器是 。
(3)滤液中加过量氢氧化钠溶液、过滤。有关的离子方程式是 。
(4)步骤(3)的滤液中通入足量二氧化碳气体,过滤,有关的离子方程式是 。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称重,其质量为bg,有关的化学方程式是 ,原样品中铝的质量分数是 。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果偏 (填“高”、“低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏 ;若滤渣灼烧不充分,则实验结果偏 。
[解析] 由实验过程中的化学反应原理可知,质量为bg的物质是Al2O3,ag合金与bgAl2O3所含Al元素的质量相同。ag合金中所含Al元素的质量:
ag合金中Al的质量分数:
本题是集Mg、Cu、Si及其重要化合物基础知识、化学仪器的功能、定量实验误差分析为一体的综合题,解题需有全面、牢固的基础知识。
答案:(1)托盘天平
(2)MgCl2、AlCl3 Cu、Si 烧杯、玻璃棒、普通漏斗
(3)Mg2++2OH-===Mg(OH)2↓,Al3++4OH-===[Al(OH)4]-
(4)[Al(OH)4]-+CO2===A1(OH)3↓+
(5)
(6)低 高 高
5