- 245.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2009届高考有机化学复习题五
班级 姓名 学号
1.下列实验能达到预期目的是
A.向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热——检验混合物中是否含有甲醛
B.向米汤中加入含碘的食盐,观察是否有颜色的变化——检验含碘食盐中是否含碘酸钾
C.向淀粉溶液中加入稀硫酸加热后,再NaOH中和并做银镜反应实验——检验淀粉是否水解
D.向乙酸乙酯加入碱石灰再蒸馏——提纯纯乙酸乙酯
2.水杨酸是重要的精细化工原料,它的结构简式如下图,水杨酸的芳香族同分异构体
A.可能含有两个醛基
B.可能含有三个羟基
C.都能溶于氢氧化钠溶液
D.分子式都是C7H7O3
3.北京奥运火炬的外壳主要采用高品质的铝合金材料制造,燃烧系统内装环保型燃料——丙烷。下列有关说法中正确的是
A.丙烷的沸点比丁烷的沸点高
B.丙烷燃烧时的耗氧量比等体积的其他烷烃少
C.燃料燃烧时主要是将热能转化为光能
D.铝合金制作的火炬质量轻、不易腐蚀
4.香柠檬油可用于化妆品。香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如右图。下列说法正确的是
A.香柠檬醚的分子式为C13H6O4
B.1mol香柠檬酚最多可与2molBr2发生反应
C.香柠檬酚通过取代反应可转化成香柠檬醚
D.1mol香柠檬酚在NaOH溶液中水解时能消耗2molNaOH
5.中国国家主席胡锦涛在中非合作论坛北京峰会上承诺:“提供3亿元人民币无偿援款帮助非洲防治疟疾,用于提供青蒿素药品及设立30个抗疟中心”。中国研制成功的全球唯一的治疗疟疾特效药——青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示。目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求。下列关于青蒿素的说法正确的是
A. 是一种烃 B.属于高分子化合物
C.属于芳香族化合物 D.分子式是C15H22O5
6.右下图是一燃料电池化学原理示意图,该燃料电池总反应化学方程式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O以下判断不合理的是
A.电极A为电池负极
B.电极B表面上发生还原反应
C.溶液pH保持不变
D.燃料电池工作时不会出现火焰
7.乙酸橙花酯是一种食用香料,结构如图所示。下列关于该物质的说法有:
①该化合物属于酯类;②分子式C11H18O2;③1 mol该化合物最多可与2 mol H2反应;④化合物能发生的反应类型有:加成、取代、氧化、聚合;⑤该化合物有一种同分异构体属于酚类。其中正确的是
A.①③④ B.②③⑤ C.①④⑤ D.①③⑤
8.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式如下:
CH3COOH+C2H5OHCH3COOC2H5+H2O
为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号
试管Ⅰ中的试剂
试管Ⅱ中试剂
测得有机层的厚度/cm
A
2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸
饱和碳酸钠溶液
5.0
B
3mL乙醇、2mL乙酸
0.1
C
3mL乙醇、2mL乙酸、6mL 3mol/L硫酸
1.2
D
3mL乙醇、2mL乙酸、盐酸
1.2
(1).实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
(2).分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 。
(3).加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 。
A
Cu/O2
加热①
B
Cu(OH)2
加热②
C
浓硫酸
加热 ③
D
G(高分子化合物)
⑥
NaOH 加热 乙醇 ④
E
H2
H
NaOH溶液
加热 ⑤
⑦
F
H+
⑧
I
J
⑨
浓硫酸
加热
(六元环状化合物)
9.某有机物A的相对分子质量为94.5,在一定条件下可以发生如下转化(其他产物和水以省略)。请回答下列问题:
(1)按要求写化学式: A的分子式 J的结构简式
(2)在上述反应中①~⑨反应中,属于取代反应的是 ,属于消去反应的是
(3)写出下列反应的化学方程式:
B→C
C→F
(4)有机物I在一定条件下,可合成一种环保型的高分子材料,则该高分子材料的结构简式为
(5)写出 I的一种同分异构体(能与金属钠、NaOH溶液和银氨溶液均能反应)的结构简式
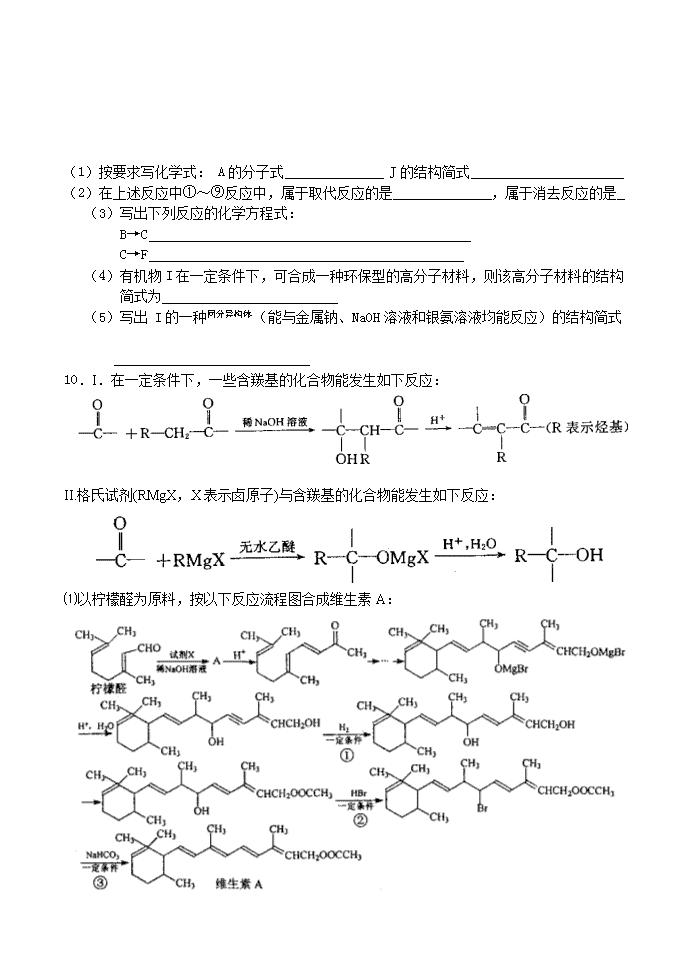
10.I.在一定条件下,一些含羰基的化合物能发生如下反应:
II.格氏试剂(RMgX,X表示卤原子)与含羰基的化合物能发生如下反应:
⑴以柠檬醛为原料,按以下反应流程图合成维生素A:
上述流程中,试剂X的结构简式为 ,①、②、③的反应类型分别是 、 、 。
⑵利用题目所给信息和学府的反应原理,以、CH3CHO和CH3MgBr为有机原料(其他无机试剂任选),可以分5步合成,用反应流程图表示。
。
11.为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水试样10.00mL加水稀释至100mL,加入10.0mL一定浓度的KBrO3和KBr的混合溶液,立即加入5mL盐酸,摇匀后加入1gKI固体(足量),再摇匀,放置5min。用0.01000mol/LNa2S2O3标准溶液滴定至淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去,用去Na2S2O3标准溶液14.46mL。同时以水代替污水试样做对比实验,用去Na2S2O3标准溶液38.46 mL。
⑴已知上述实验中发生的反应有:
KBrO3+5KBr+6HCl=3Br2+3H2O+6KCl 2Na2S2O3+I2Na2S4O6+2NaI
请写出实验中还涉及的另两个反应的化学方程式: 、
。
⑵试计算此污水中苯酚的含量(以mg/L表示,苯酚的相对分子质量为94.00)。
12. 1,3 ―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
CH2=CH2O2/Ag
①
(CO,H2)/Co
②
HOCH2CH2CHOH2/Ni
③
HOCH2CH2CH2OH
⑴通过反应①用乙烯和空气混合气体制备,测得反应前和某一时刻气体的体积分数如下表。
C2H4
O2
N2
反应前体积分数
25.0%
15.0%
60.0%
0
某一时刻体积分数
5.56%
5.54%
66.7%
22.2%
计算此时乙烯的转化率。
⑵某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2OCO+H2 CH4+H2OCO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%。
计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
参考答案
1C 2C 3C 4D 5D 6D 7A
8.(1). 6 、 6 、
(2). AC 、 浓硫酸可以吸收酯化反应 中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动。
(3). 大量乙酸、乙醇末经反应就脱离反应体系;温度过高发生其他反应。 。
9.(16分)解析:因“A的相对分子质量为94.5”,则A中必含有一个氯原子(若含有3个氯原子,则A的相对分子质量要大于35.5×5=177.5),再结合反应条件,A能在“ Cu/O2加热时反应”,则判断A中含有醇羟基,可设A的分子式为CxHy(Cl)(OH)n,所以CxHy-的式量为94.5-35.5-17 n=59-17n,当n=1时,M(CxHy-)=42,CxHy-为C3H6-;当n=2时,M(CxHy-)=59-34=25,CxHy-为C2H1-,显然不合题意,舍去。故A的分子式为C3H7OCl(分子中不含其它的不饱和键)。因为A能被连续氧化成羧酸,所以A中必含有片断-CH2OH。则A是CH3CH(Cl)CH2OH(若是Cl-CH2CH2CH2OH,则J是八元环,不符合题意)。
(1)C3H7OCl,J的结构简式见图1。(每空2分,共4分)
图1
图2
(2)取代反应的是⑤⑨,消去反应的是③④。(每空2分,共4分)
(3)CH3CH(Cl)CHO+ 2Cu(OH)2→CH3CH(Cl)COOH+Cu2O↓+2H2O
CH3CH(Cl)COOH+2NaOH→CH3CH(OH)COONa+NaCl+ H2O(每个方程式2分,共4分)
(4) I为聚乳酸,如图2。(2分)
(5)I的同分异构体应含有甲酸酯基和醇羟基,符合要求的同分异构体很多,如HCO-O-CH2CH2OH。(2分)
10.⑴CH3COCH3 加成 取代 消去
⑵
⑶4
11.⑴ Br2+2KI=2KBr+I2
⑵根据化学方程式,有如下转化关系:6Na2S2O3~ 3I2~3Br2~C6H5OH
12.⑴设反应前气体共有100L
则反应前V(C2H4)=100L×25.0%=25L
V(N2)=100L×60.0%=60L
因为N2的体积不发生变化,则此时气体的体积为60L÷66.7%=90L
V(C2H4)=90L×5.56%=5.00L
则此时乙烯的转化率=×100%=80.0% (4分)
⑵反应②中 C2H4 ~ CO ~ H2 ~ HOCH2CH2CHO
28 28 2 74
14t m(CO)× m(H2)× m(HOCH2CH2CHO)
则m(CO)=16.8 t m(H2)=1.2t m(HOCH2CH2CHO) =37 t
反应③中 HOCH2CH2CHO ~ H2
74 2
37t m(H2)×
则m(H2)=1.2t
反应②、③中共需CO16.8 t、H22.4t。 (2分)
C + H2OCO + H2 CH4 + H2OCO + 3H2
12 28 2 16 28 6
m(C) m(CH4)
得方程组=16.8 t 和 =2.4t
解得m(C)=3.6t m(CH4)=4.8t
所以需要焦炭3.6t、甲烷4.8t。
(4分)
相关文档
- 全国各地高考文科数学试题分类汇编2021-05-1420页
- 上海高考物理试题以及答案详细解析2021-05-1411页
- 高考英语浙江卷Word版含答案2021-05-1413页
- 高考真题——理科数学北京卷Word版2021-05-1410页
- 高考专题一高中物理实验总结大全2021-05-1424页
- 2020版高考地理一轮复习 第二部分2021-05-146页
- 高考语文复习备考策略专题12名著导2021-05-142页
- 空间向量与立体几何知识总结高考必2021-05-148页
- 全国高考地理模拟新题筛选专题汇编2021-05-1430页
- 2019人教版高考地理一轮训练选1及2021-05-146页