- 472.00 KB
- 2021-05-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
广东省佛山市第一中学2020届高三上学期期中考试 理综化学 Word版含答案
7.化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A. “华为麒麟980”手机中芯片的主要成分是二氧化硅
B.流感疫苗要冷藏存放,以免蛋白质变性
C.“地沟油”经分馏可得汽油,用作汽车燃料
D.国产大飞机C919使用的“现代工业骨骼”碳纤维是一种新型的有机高分子材料
8.设阿伏加德罗常数的值为NA,下列说法正确的是
A.标准状况下,2.24LCCU分子中共价键的数目为0.4NA
B. 2 L 0.5 mol/LH2S03溶液中含有的H+数目为2NA
C. 7.8gNa202固体中含有的离子总数为0.37NA
D.常温下,1 molFe与足量浓硝酸反应,电子转移数目为3NA
9. M是一种治疗济疮的新型药物,合成路线如下:
下列说法不正确的是
A.X的分子式为CiaH1602
B.Y分子中所有碳原子不可能在同一平面上
C.Y生成M的反应类型为取代反应
D.可用NaHCCb溶液或溴水鉴别X和M
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法正确的是
A.原子半径:Y>Z>X>W
B.简单氢化物的热稳定性:W>X>Z
C. Y、Z形成的化合物溶于水会促进水的电离
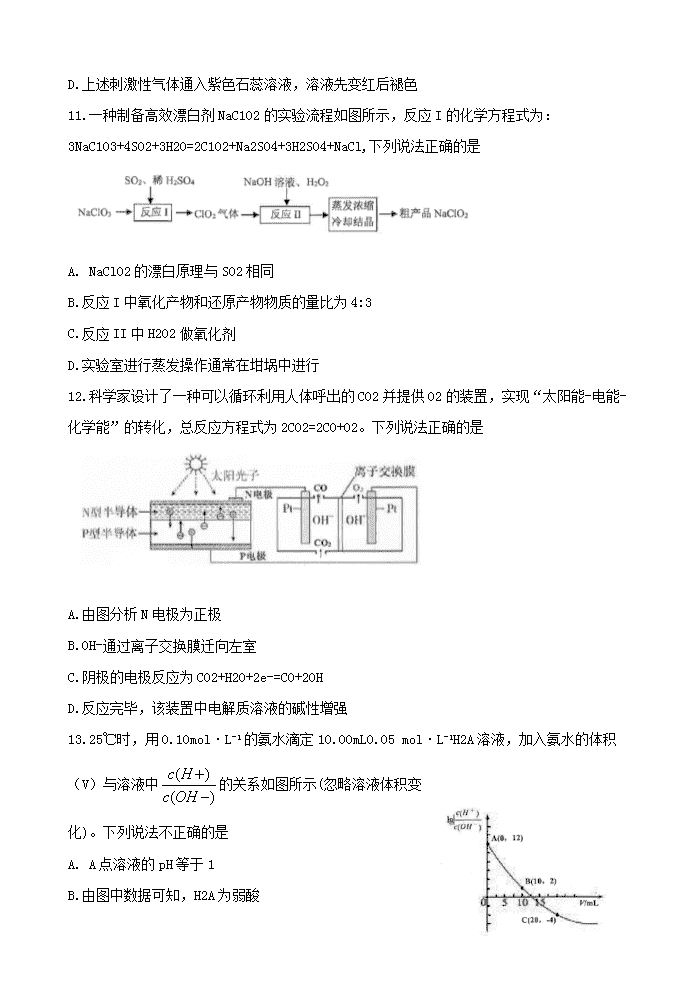
D.上述刺激性气体通入紫色石蕊溶液,溶液先变红后褪色
11.一种制备高效漂白剂NaC102的实验流程如图所示,反应I的化学方程式为: 3NaC103+4S02+3H20=2C102+Na2S04+3H2S04+NaCl,下列说法正确的是
A. NaClO2的漂白原理与SO2相同
B.反应I中氧化产物和还原产物物质的量比为4:3
C.反应II中H202做氧化剂
D.实验室进行蒸发操作通常在坩埚中进行
12.科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,实现“太阳能-电能-化学能”的转化,总反应方程式为2C02=2C0+02。下列说法正确的是
A.由图分析N电极为正极
B.OH-通过离子交换膜迁向左室
C.阴极的电极反应为CO2+H2O+2e-=CO+2OH
D.反应完毕,该装置中电解质溶液的碱性增强
13.25℃时,用0.10mol·L-1的氨水滴定10.00mL0.05 mol·L-1H2A溶液,加入氨水的体积(V)与溶液中的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
A. A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为l.OxlO-6 mol·L-1
D.C 点溶液中 c(NH4+)> c(A2-)> c(OH-)> c(H+)
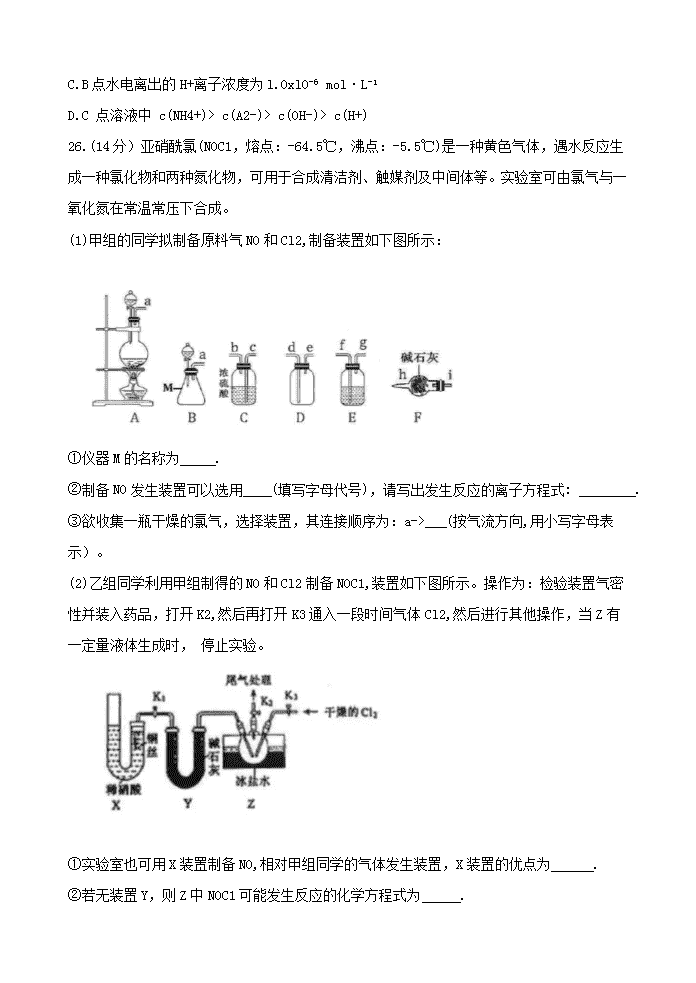
26.(14分)亚硝酰氯(NOC1,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水反应生成一种氯化 物和两种氮化物,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
①仪器M的名称为 .
②制备NO发生装置可以选用 (填写字母代号),请写出发生反应的离子方程式: .
③欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a-> (按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOC1,装置如下图所示。操作为:检验装置气密性并装入药品,打开K2,然后再打开K3通入一段时间气体Cl2,然后进行其他操作,当Z有一定量液体生成时, 停止实验。
①实验室也可用X装置制备NO,相对甲组同学的气体发生装置,X装置的优点为 .
②若无装置Y,则Z中NOC1可能发生反应的化学方程式为 .
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用 cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是 ;亚硝酰氯(N0C1)的质量分数为 (用代数式表示)。
[已知:Ag2Cr04为砖红色固体;Ksp(AgCl)= 1.56x10-10, Ksp(Ag2CrO4)=lxl012]
27.(13分)碲(Te)具有两性特征,铜阳极泥是提取碲的主要原料,碲在铜阳极泥中主要以MezTeCMe表 示金属Cu、Pb、Au、Ag等)的形式存在。
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。
①浸出液的主要成分为CuSO4、HAuCu、H2Te03,则浸出渣的主要成分 为 (填化学式);“浸出”过程中有少量污染性气体生成,该气体是 (填物质名称)
②已知HAuCU是一种强酸,则“一级还原”过程中发生反应的离子方程式为 。
③欲得到64g碲,则“二级还原”过程中至少需通入 mol S02。
“氧化碱浸-电解法”指的是在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2Te03和Cu(OH)2,经电解即可获得Te。
①以空气为氧化剂进行“氧化碱浸”的化学方程式为 。
②电解过程中,阴极的电极反应式为 。
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是 (任写一点)
28.(16分)S02的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理S02。
(1)在复合组分催化剂作用下,CH4可使S02转化为S,同时生成C02和液态H20。
已知:CH4(g)+202(g) = C02(g)+2H2O(l) =-890.3 kJ/mol
S(s)+02(g) = S02(g) AH=-291.2 kJ/mol
则CH4和SO2反应的热化学方程式为 。
(2)在恒容密闭容器中,用H
2还原S02生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
①分析可知X为 (填化学式),0〜h时间段的温度为 .
②用H2还原S02生成S的总反应的化学方程式为 .
(3)焦炭催化还原S02生成S2,化学方程式为2C(s)+2S02(g)= S2(g)+2C02(g)。在恒容密闭容器中,1 mol/LS02与足量的焦炭反应,S02的转化率随温度的变化如图3所示。
①该反应的△H (填“ > ”或“<”)0。
②计算a点的平衡常数为 .
(4)工业上用Na2S03溶液处理硫酸厂的废气S02得NaHS03溶液。
①某温度下,用1.0mol/LNa2SO3溶液吸收纯净的S02,当溶液pH降至5时,吸收能力显著下降,应更换吸收剂。此时溶液中 。(已知该温度下H2S03的电离平衡常数:Ka1=1.50x10-2,Ka2=1.25xl0-6)
②用惰性电极电解NaHS03废水可使吸收液再生,原理如下图所示,M和N为离子交换膜。阳极的电极反应式为: 。
35.【化学——物质结构与性质】(15分)
离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的 E
MIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
碳原子价层电子的轨道表达式为 ;基态碳原子中,核外电子占据的最高能级的电子云轮廓图为 形。
(2)根据价层电子对互斥理论,NH3、N03-、N02-中,中心原子价层电子对数不同于其他两种粒子的是 。NH3比PH3的沸点高,原因是 .
(3)氮元素的第一电离能比同周期相邻元素都大的原因是 。
(4)己知分子中的大键可用符号表示,其中n代表参与形成大键的原子数,m代表参与形成大键的电子数(如苯分子中的大键可表示为)。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+ 离子中碳原子杂化方式有: ,其中的大键应表示为 .
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于晶体,其中硼原子的配位数为 。已知:立方氮化硼密度为dg/cm3, B原子半径为xpm,N原子半径为xpm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为 (列
出化简后的计算式)。
36.【化学——有机化学基础】(15分)略
参考答案及评分标准化学部分
7~13 B C D C B C B
26.(14分)(1)①锥形瓶(1分)
②B(1分) 3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O(2分)
③f→g→c→ b→d→e→i→h(2分)
(2)①排除装置内空气的干扰,制得的NO更纯净(2分)
②2NOCl+H2O=2HCl+NO↑+NO2↑(2分)
(3)当滴入最后一滴AgNO3标准溶液,溶液中有砖红色沉淀产生,且30s不消失。(2分)(2分)
27.(13分)(1)①PbSO4和AgCl (2分) 氯气(2分)
②[AuCl4]- + 3Fe2+ = 3Fe3+ + Au + 4Cl-(2分) ③1 (1分)
(2)①Cu2Te + 2O2 + 2NaOH + H2O = Na2TeO3 + 2Cu(OH)2(2分)
②TeO32- + 4e- + 3H2O = Te + 6OH-(2分)
③不生成氯气等污染性气体(或工艺简单)(2分)
28.(16分)(1)CH4(g)+2SO2(g) = CO2(g)+2S(s)+2H2O(l) ΔH=-295.9kJ/mol (2分)
(2)①H2S(2分) 300℃(2分)②2H2+SO2S+2H2O(2分)
(3)①<(2分)②36.45(2分)
(4)①1/8(2分)②HSO3- - 2e- + H2O = SO42- + 3H+ (2分)
35.(15分)(1)(2分) 哑铃(1分)
(2)NH3(1分) NH3间存在氢键,分子间作用力大于PH3(2分)
(3)基态氮原子电子占据的最高能级为半充满,较稳定(2分)
(4) sp2、sp3(2分)(1分)
(5)原子(1分) 4(1分)×100%(2分)
相关文档
- 师大二附中 2016-2017 学年第一学2021-05-268页
- 2020-2021学年高二物理上学期期中2021-05-2518页
- 2020-2021学年高三英语上学期期中2021-05-2025页
- 2020-2021学年高三英语上学期期中2021-05-2023页
- 2020-2021学年高三英语上学期期中2021-05-2025页
- 2020-2021学年高三英语上学期期中2021-05-2025页
- 2020-2021学年高三英语上学期期中2021-05-2025页
- 2020-2021学年高三英语上学期期中2021-05-1924页
- 福建省莆田市第二十四中学2019-2022021-05-1811页
- 数学计划总结之六年级数学期中测试2021-04-132页