- 228.50 KB
- 2021-06-01 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1. 电子的发现 2. 原子的核式结构 3. 氢原子光谱 4. 玻尔的原子模型
二. 知识归纳、总结:
(一)电子的发现
1、阴极射线
(1)产生:在研究气体导电的玻璃管内有阴、阳两极,当两极间加一定电压时,阴极便
发出一种射线,这种射线为阴极射线。(2)阴极射线的特点:碰到荧光物质能使其发光。
2、汤姆孙的发现
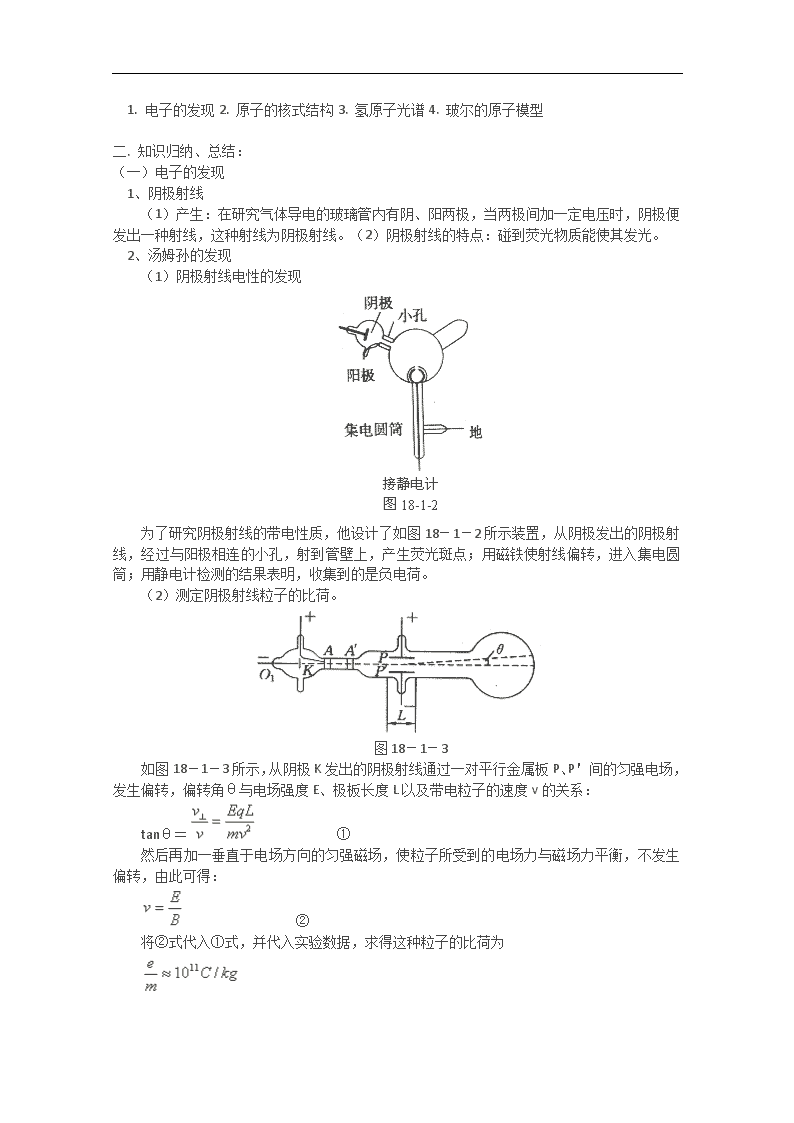
(1)阴极射线电性的发现[来源:学科网 ZXXK]
为了研究阴极射线的带电性质,他设计了如图 18-1-2 所示装置,从阴极发出的阴极射
线,经过与阳极相连的小孔,射到管壁上,产生荧光斑点;用磁铁使射线偏转,进入集电圆
筒;用静电计检测的结果表明,收集到的是负电荷。
(2)测定阴极射线粒子的比荷。
图 18-1-3
如图 18-1-3 所示,从阴极 K 发出的阴极射线通过一对平行金属板 P、P'间的匀强电场,
发生偏转,偏转角θ与电场强度 E、极板长度 L 以及带电粒子的速度 v 的关系:
tanθ= ①
然后再加一垂直于电场方向的匀强磁场,使粒子所受到的电场力与磁场力平衡,不发生
偏转,由此可得:
②
将②式代入①式,并代入实验数据,求得这种粒子的比荷为
说明:①汤姆孙通过进一步的实验,发现当改变阴极材料时,测得的比荷都相同,表明
这种粒子是各种材料的共有成分,1898 年,汤姆孙测出这种粒子所带电荷与氢离子的电荷数
值接近,从而证明这种粒子的质量约是氢离子的千分之一,至此,这种粒子的“身份”已经
明确;它是一种带负电的质量很小的粒子,物理学家把这种粒子叫做电子。
②现在测得电子的比荷为 e/m=1.75881×1011C/kg.
电子的电荷量为 e=1.60219×10-19C,
从而计算出电子的质量为 m=9.10953×10-31kg.
③电子的质量约为氢原子质量的
(二)原子的核式结构
1、汤姆孙的枣糕式模型
图 18-2-1
J·J·汤姆孙于 1904 年提出来的模型,汤姆孙在发现电子后,便投入了对原子内部结构
的探索,他运用丰富的想象,提出了原子枣糕模型(图 18-2-1),在这个模型里,汤姆孙
把原子看作一个球体,正电荷均匀地分布在整个球内,电子像枣糕上的枣子一样嵌在球中,
被正电荷吸引着,原子内正、负电荷相等,因此原子的整体呈中性,汤姆孙的模型是第一个
有一定科学依据的原子结构模型,而不是哲学思辨的产物。
2、 粒子散射实验
1909~1911 年卢瑟福和他的助手做了用α粒子轰击金箔的实验,获得了重要的发现。
(1)实验装置(如图 18-2-2 所示)
图 18-2-2
(2)实验结果
绝大多数α粒子穿过金箔后基本上仍沿原来的方向前进,但是有少数 α粒子发生了较大
的偏转,极少数粒子被反向弹回。
3、原子的核式结构
卢瑟福依据α粒子散射实验的结果,提出了原子的核式结构:在原子中心有一个很小的
核,叫原子核,原子的全部正电荷和几乎全部质量都集中在核里,带负电的电子在核外空间
绕核旋转。
图 18-2-3
按照卢瑟福的核式结构学说,可以很容易地解释α粒子的散射实验现象,如图 18-2-3
所示。按照这个模型,由于原子核很小,大部分α粒子穿过金箔时都离核很远,受到的斥力
很小,它们的运动几乎不受影响;只有极少数α粒子从原子核附近飞过,明显地受到原子核
的库仑斥力而发生大角度的偏转。
(三)氢原子光谱
1、发射光谱:物质发光直接产生的光谱
从实际观察到的物质发光的发射光谱可分为连续谱和线状谱。
(1)连续谱:连续分布着的包含着从红光到紫光的各种色光的光谱。[来源:学科网 ZXXK]
产生:是由炽热的固体、液体、高压气体发光而产生的。
(2)线状谱:只含有一些不连续的亮线的光谱,线状谱中的亮线叫谱线。
产生:由稀薄气体或金属蒸气(即处于游离态下的原子)发光而产生的,观察稀薄气体
放电用光谱管,观察金属蒸气发光可把含有该金属原子的物质放到煤气灯上燃烧,即可使它
们汽化后发光。
2、吸收光谱:高温物体发出的白光通过物质后,某些波长的光波被物质吸收后产生的光谱。
产生:由炽热物体(或高压气体)发出的白光通过温度较低的气体后产生。
例如:让弧光灯发出的白光通过低温的钠气,可以看到钠的吸收光谱。
若将某种元素的吸收光谱和线状谱比较可以发现:各种原子吸收光谱的暗线和线状谱和
亮线相对应,即表明某种原子发出的光和吸收的光的频率是特定的,故吸收光谱和线状谱中
的暗线比线状谱中的亮线要少一些。
3、光谱分析
各种元素的原子都有自己的特征谱线,如果在某种物质的线状谱或吸收谱中出现了若干
种元素的特征谱线,表明该物质中含有这种元素的成分,这种对物质进行化学组成的分析和
鉴别的方法称为光谱分析。
其优点:灵敏、快捷、检查的最低量是 10-10 克。
4、光谱分析的应用
(1)光谱分析在科学技术中有着广泛的应用,例如,在检测半导体材料硅和锗是不是达
到高纯度要求时,就要用到光谱分析。
(2)历史上,光谱分析还帮助人们发现了许多新元素,例如,铷和铯就是人们通过分析
光谱中的特征谱线而发现的。
(3)利用光谱分析可以研究天体的物质成分,19 世纪初在研究太阳光谱时,人们发现它
的连续光谱中有 许多暗线,通过仔细分析这些暗线,并把它们跟各种原子的特征谱线对照,
人们知道了太阳大气层中含有氢、氦、氮、碳、氧、铁、镁、硅、钙、钠等几十种元素。
(4)光谱分析还能鉴定食品的优劣。例如,通过分析茶叶的近红外光谱,测定其各种化
学成分的含量,就可以鉴定茶叶的优劣、级别、真假以及品种等。
(5)用光谱分析还可以鉴定文物,例如:1978 年在新石器时代遗址浙江省余姚县河姆渡
村,人们挖掘出一件木质漆碗,器壁外涂有一层朱红色的涂料,且微有光泽,借助光谱分析,
鉴定出这种涂料与马王堆出土的漆皮类似,因此漆工艺的历史可追溯至 7000 年前。
5、氢原子光谱的实验规律
氢原子是自然界中最简单的原子,对它的光谱线的研究获得的原子内部结构的信息,对
于研究更复杂的原子的结构有指导意义。
(1)氢原子的光谱
图 18-3-3
从氢气放电管可以获得氢原子光谱,如图 18-3-3 所示,氢原子的光谱为线状谱。
(2)巴耳末公式: n = 3,4,5…
6、经典理论的困难
按经典理论原子是不稳定的,原子发光的光谱应为连续光谱,事实原子不但稳定而且发
光的光谱为线状光谱。
图 18-3-4
(1)按照经典物理学,核外电子受到原子核的库仑引力的作用,不可能是静止的,它一
定在以一定的速度绕核转动,既然电子在运动,它的电磁场就在变化,而变化的电磁场会激
发电磁波,也就是说,它将自己绕核转动的能量以电磁波的形式辐射出去,因此,电子绕核
转 动这个系统是不稳定的,电子会失去能量,最后一头栽到原子核上,但是事实不是这样,
原子是个很稳定的系统如图 18-3-4 所示。
(2)根据经典电磁理论,电子辐射的电磁波的频率,就是它绕核转动的频率,电子越转
能量越小,它离原子核就越来越近,转得也就越来越快,这种变化是连续的,也就是说,我
们应该看到原子辐射的各种频率(波长)的光,即原子的光谱应该总是连续的,而实际上我
们看到的是分立的线状谱。
(四)玻尔的原子模型
1、玻尔模型
玻尔认为,围绕原子核运动的电子轨道半径只能是某些分立的数值,这种现象叫做轨道
量子化;不同的轨道对应着不同的状态,在这些状态中,尽管电子在做 变速运动,却不辐射
能量,因此这些状态是稳定的;原子在不同的状态中具有不同的能量,所以原子的能量也是
量子化的。
将以上内容进行归纳,玻尔理论有三个要点:
(1)原子只能处于一系列的不连续的能量状态中,在这些状态中原子是稳定的,电子虽
然绕核旋转,但并不向外辐射能量,这些状态叫定态。
(2)原子从一种定态(能量为 E1)跃迁到另一定态(能量为 E2)时,它辐射(或吸收)
一定频率的光子,光子的能量由这两个定态的能量差决定,即 hv=E2-E1。
可见,电子如果从一个轨道到另一个轨道,不是以螺旋线的形状改变半径大小的,而是
从一个轨道上“跳跃”到另一个轨道上,玻尔将这种现象称为跃迁。
(3)原子的不同能量状态对应于电子沿不同圆形轨道运动,原子的定态是不连续的,因
而电子的可能轨道是分立的,(满足 mvr= ,n 叫量子数,这种轨道的不连续现象叫轨
道量子化),轨道半径 rn=n2r1。
2、能级
在玻尔模型中,原子的可能状态是不连续的,因此各状态对应的能量也是不连续的,这
些能量值叫做能级。
各状态的标号 1、2、3……叫做量子数,通常用 n 表示,能量最低的状态叫做基态,其他
状态叫做激发态,基态和各激发态的能量分别用 E1、E2、E3…代表。
(1)氢原子的能级及玻尔对氢光谱的解释
对氢原子而言,核外的一个电子绕核运行时,若半径不同,则对应着的原子能量也不同,
若使原子电离,外界必须对原子做功,使电子摆脱它与原子核之间的库仑力的束缚,所以原
子电离后的能量比原子其他状态的能量都高,我们把原子电离后的能量记为 0,则其他状态下
的能量值就是负的。
原子各能级的关系为: (n=1、2、3…)
对于氢原子而言,基态能量:E1=-13.6eV
其他各激发态的能级为:E2=-3.4 eV
E3=-1.51 eV
(2)能级图
氢原子的能级图如图 18-4-1 所示
18-4-1
3、光子的发射和吸收
(1)能级的跃迁
根据玻尔模型,原子只能处于一系列的不连续的能量状态中,这些状态分基态和激发态
两种,其中原子在基态时是稳定的,原 子在激发态时是不稳定的,当原子处于激发态时会自
发地向较低能级跃迁,经过一次或几次跃迁到达基态。
(2)光子的发射
原子能级跃迁时以光子的形式放出能量,原子在始末两个能级 Em 和 En(m>n)间跃迁时
发射光子的频率可由下式表示:
hv=Em-En
由上式可以看出,能级差越大,放出光子的频率就越高。
(3)光子的吸收
光子的吸收是光子发射的逆过程,原子在吸收了光子后会从较低能级向较高能级跃迁,
两个能级的差值仍是一个光子的能量,其关系式仍为 hv=Em-En
4、原子能级跃迁问题
跃迁是指电子从某一轨道跳到另一轨道,而电子从某一轨道跃迁到另一轨道对应着原子
就从一个能量状态(定态)跃迁到另一个能量状态(定态)。
(1)跃迁时电子动能、原子势能与原子能量的变化
原子中原子核带电荷量为+Ze,核外电子带电荷量为-e,电子在半径为 r 的轨道上绕核
做匀速圆周运动时,库仑力提供向心力,则有:
则
电子绕核运动的动量
在原子中,由于原子核与核外电子库仑引力的作用而具有电势能,电势能属于相互作用
的系统——原子,由库仑力所做的功与电势能变化的关系可知:电子绕核运动的轨道半径 r
增大时,库仑引力 F 做负功,原子的电势能 Ep 增大。
通常取 r→∞时的电势能为零,电子在半径为 r 的轨道上的电势能:
(2)使原子能级跃迁的两种粒子——光子与电子
原子若是吸收光子的能量而被激发,其光子的能量必须等于两能级的能量差,否则不被
吸收,不存在激发到 n=2 时能量有余,而激发到 n=3 时能量不足,则可激发到 n=2 的问题。
原子还可吸收外来电子(自由电子)的能量而被激发,只要入射电子的能量大于或等于
两能级的能差差值(E=Em-En),均可使原子发生能级跃迁。
5、原子光谱
稀薄的气体通电后能够发光,利用分光镜可 以得到气体发光的光谱。不过,这种光谱并
不是连续光谱,它只有分立的几条亮线,也就是说,稀薄气体通电时只发出几种确定频率的
光,不同气体光谱的亮线位置不同,这表明不同气体发光的频率是不一样的,这种分立的线
状光谱又叫原子光谱。
6、玻尔理论的局限性
玻尔理论只能解释氢原子光谱,而对外层电子较多的原子,理论与实际相差很多,玻尔
理论不再成立,取而代之的是量子力学,量子力学是一种彻底的量子理论,它不但成功地解
释了玻尔理论所能解释的现象,而且能够解释大量玻尔理论所不能理解的现象,玻尔理论中
的三点假设,在量子力学中也变成理论上推导出来的直接结果,建立在量子力学基础上的原
子理论认为,核外电子的运动服从统计规律,而没有固定的轨道,我们只能知道它们在核外
某处出现的概率大小,结果发现电子在某些地方出现的概率较大,在另一些地方出现的概率
较小,电子频繁地出现在这些概率大的地方,我们可以想像在那里有一团“电子云”包围着
原子核,这些电子云形成许多层,在不同层中运动的电子具有不同的能量,因而形成了原子
的定态和能级,这样量子力学就根本抛弃了从经典物理引用来的电子运动轨道的概念,所谓
玻尔理论中的电子轨道,只不过是电子云中电子出现概率最大的地方。
【典型例题】
例 1. 有一群氢原子处于量子数 n=3 的激发态,当它们跃迁时,(1)有可能放出几种能量
的光子?(2)在哪两个能级间跃迁时,所发出的光子的波长最长?波长是多少?
分析:由 n=3 的激发态向低能级跃迁的路径为 n3→n2→n1 或 n3→n1,其中由 n3→n2 的跃
迁能级差最小,辐射的光子能量最小,波长最长。[来源:Z,xx,k.Com]
解:(1)共能放出三种能量的光子,即三种频率的光子。
(2)由氢原子能级图,E2=-3.4Ev,E3=-1.51eV.
hv=E3-E2=1.89eV,又知 v= ,则有:
例 2. 如图 18-4-2 所示,一群处于基态的氢原子吸收某种光子后,向外辐射 f1、f2、f3 三
种频率的光子,且 f1>f2>f3 则( )
图 18-4-2
A. 被氢原子吸收的光子的能量为 hf1
B. 被氢原子吸收的光子的能量为 hf2
C. f1=f2+f3
D. h f1=h f2+h f3
解析:氢原子吸收光子能向外辐射出三种频率的光子,说明氢原子从基态跃迁到了第三
激发态,在第三激发态不稳定,又向低能级跃迁,发出光子,其中从第三能级跃迁到第一能
级的光子能量最大,为 hf1,从第二能级跃迁到第一能级的光子能量比从第三能级跃迁到第二
能级的光子能量大,由能量守恒可知,氢原子一定是吸收了能量为 h f1 的光子,且关系式 h f1
=h f2+h f3,f1=f2+f3 存在,故答案为 A、C、D。
答案:ACD
【模拟试题】
1. 氢原子处于基态时,原子的能量为 E1=-13.6 eV,问:
(1)氢原子在 n=4 的定态时,可放出几种光子?
(2)若要使处于基态的氢原子电离,要用多大频率的电磁波照射此原子?
2. 根据玻尔理论,氢原子核外电子在 n=1 和 n=2 的轨道上运动时,其运动的( )
A. 轨道半径之比为 1:4 B. 动能之比为 4:1
C. 速度大小之比为 4:1 D. 周期之比为 1:8
3. 卢瑟福α粒子散射实验的结果( )
A. 证明了质子的存在
B. 证明了原子核是由质子和中子组成的。
C. 证明了原子的全部正电荷和几乎全部质量都集中在一个很小的核里。
D. 说明了原子中的电子只能在某些轨道上运动。[来源:学|科|网]
4. α粒子散射实验中,不考虑电子和α粒子的碰撞影响,是因为( )
A. α粒子与电子根本无相互作用。
B. α粒子受电子作用的合力为零,是因为电子是均匀分布的。
C. α粒子和电子 碰撞损失能量极少,可忽略不计。
D. 电子很小,α粒子碰撞不到电子。[来源:Z#xx#k.Com]
5. 在卢瑟福α粒子散射实验中,有少数α粒子发生大角度偏转,其原因是( )
A. 原子的正电荷和绝大部分质量集中在一个很小的核上。
B. 正电荷在原子内是均匀分布的。
C. 原子中存在着带负电的电子。
D. 原子只能处于一系列不连续的能量状态中。
【试题答案】
1. 解析:(1)原子处于 n=1 的定态,这时原子对应的能量最低,这一定态是基态,其他
的定态均是激发态,原子处于激发态时,不稳定,会自动地向基态跃迁,而跃迁的方式多种
多样,当氢原子从 n=4 的定态向基态跃迁时,可释放出如图 18-4-3 所示的 6 种不同频率
的光子。
图 18-4-3
(2)要使处于基态的氢原子电离,就是要使氢原子第一条可能轨道上的电子获得能量脱
离原子核的引力束缚。则
得
2. 解析:玻尔的原子理论表明:氢原子核外电子绕核做匀速圆周运动,其向心力由原子核
对它的库仑引力来提供。
因为:rn=n2r1, 所以 r1: r2=1:4
由 得:电子在某条轨道上运动时,电子运动的动能
Ekn=
电子运动的速度
电子绕核做圆周运动的周期
上述选项 A、B、D 正确
答案:ABD
3. 解析:该题要考查的是α粒子散射实验对人类认识原子结构的贡献,只要考生了解α粒
子散射实验的结构及核式结构的建立过程,不难得出正确答案。
α粒子散射实验发现了原子内存在一个集中了全部正电荷和几乎全部质量的核,数 年后
卢瑟福发现核内有质子并预测核内存在中子。
答案:C
4. 解析:α粒子与电子之间存在着相互作用力,这个作用力是库仑引力,但由于电子质量
很小,只有粒子质量的七千分之一,碰撞时对α粒子的运动影响小到几乎不改变运动方向,
就像一颗子弹撞上一粒尘埃一样,故正确答案为 C。
答案:C
5. 解析:本题考查了考生对α粒子散射实验结果与原子的核式结构的关系的理解,原子的
核式结构正是建立在α粒子散射实验结果的基础上的,明白了这一点,本题的正确答案也就
明白了,C、D 的说法没有错,但与题意不符。
答案:A
【励志故事】
半杯理论
亨利福特被美国人称为“汽车之父”。1913 年他率先采用流水线组装汽车,第一次实现
了 10 秒钟组装一部汽车的神话。几年后民用汽车的价格降低了一半,小轿车不再是富豪的专
属。福特的思想对全世界的制造业也产生了极大的影响。今天,大到一架飞机,小到一包糖
果,都可以在流水线上生产。福特汽车公司初具规模后,有一次,福特在高层会议中建议改
进现有的装配线,从而提高生产效率。这个提议遭到很多人反对:有人觉得改进装配线,既
要投资购买机器,又得重新培训工人,风险太大了;另一部分人则认为公司的生产能力已经
够强,效益也很好,没必要花力气去提高效率。
听完大家的意见,福特举起桌上的玻璃杯问:“你们看到了什么?”有人担忧地说:“半
杯水被喝了,杯子空了一半。”“别担心,”有人乐观地说,“杯子里还有一半水,渴了还
有半杯水可喝。”“和你们不同,我看到杯子容积是水的 2 倍。”福特说,“这里的水用个
一半大小的杯子就能盛下。用一只大杯子做一只小杯子能做到的事,是对资源的浪费,是低
效率。现在生产线上的员工们就像这个大杯子,有一半的潜力没发挥出来。我要做的是换个
小杯子,然后我们就可以用大杯子来盛更多、更好的东西了!”
相关文档
- 2019-2020学年安徽省定远县育才学2021-06-018页
- 2019-2020学年浙江省绍兴市诸暨中2021-06-0111页
- 高中物理 第三章 液体 第1节 表面2021-06-012页
- 上海市虹口区2019-2020学年高一上2021-06-0116页
- 物理卷·2018届江西省九江市重点高2021-06-017页
- 【物理】安徽省六安市舒城中学20192021-06-0114页
- 【物理】安徽省安庆市桐城中学20202021-06-0120页
- 福建省师范大学附属中学2019-20202021-06-019页
- 广东省揭阳市第一中学高中物理 模2021-06-0110页
- 2017-2018学年陕西省西安中学高二2021-06-016页