- 714.36 KB
- 2021-06-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
山西大学附中2020届高三第一学期模块诊断化学试题
考试时间:80分钟 考查范围:综合
相对原子质量:H-1 C-12 N-14 O-16 Fe-56 Cu-64 I-127 Pb-207
一、选择题(本题包括18小题,每小题2.5分,共45分。每小题只有一个选项符合题意)
1.化学与社会、科学、技术、环境密切相关。下列说法不正确的是
A.T-碳是一种新型三维碳结构晶体,与C60互为同素异形体
B.推广利用CO2合成聚碳酸酯可降解塑料符合低碳经济理念
C.将金属钛、铝混合后在空气中熔化可制得强度较大的钛铝合金材料
D.为汽车安装尾气催化转化装置,可将尾气中的部分CO和NO转化为无毒气体
2.下列各组物质能相互反应得到Al(OH)3的是
A.铝跟NaOH溶液 B.Al(NO3)3跟过量的NaOH溶液
C.Al2O3和热水 D.Al2(SO4)3溶液跟过量的氨水
3.某研究小组通过实验探究Cu及其化合物的性质,下列操作正确且能达到实验目的的是
A.将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
4.将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-2Fe2++I2的是
A.向混合液中滴入KSCN溶液,溶液变红色
B.向混合液中滴入AgNO3溶液,有黄色沉淀生成
C.向混合液中滴入K3[Fe(CN)6]溶液,有蓝色沉淀生成
D.向混合液中滴入淀粉溶液,溶液变蓝色
5.已知CuO经高温灼烧生成Cu2O,Cu2O与H+发生反应:Cu2O+2H+===Cu+Cu2++H2O。将经高温灼烧后的CuO样品投入足量的热的稀硝酸溶液中,下列有关说法中正确的是
A.如果溶液变为蓝色,同时有紫红色固体出现,说明样品全部生成Cu2O
B.溶液中最终可能有紫红色固体出现
C.该实验的结果无法说明CuO分解的程度
D.如果溶液中出现蓝色,最终没有紫红色固体出现,说明CuO没有分解
6.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
选项
操作及现象
溶液
A
通入足量CO2,溶液变浑浊
饱和Na2CO3
B
通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失
Na2SiO3溶液
C
通入CO2,溶液变浑浊;再加入品红溶液,红色褪去
Ca(ClO)2溶液
D
通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失;再加入足量NaOH溶液,又变浑浊
Ca(OH)2溶液
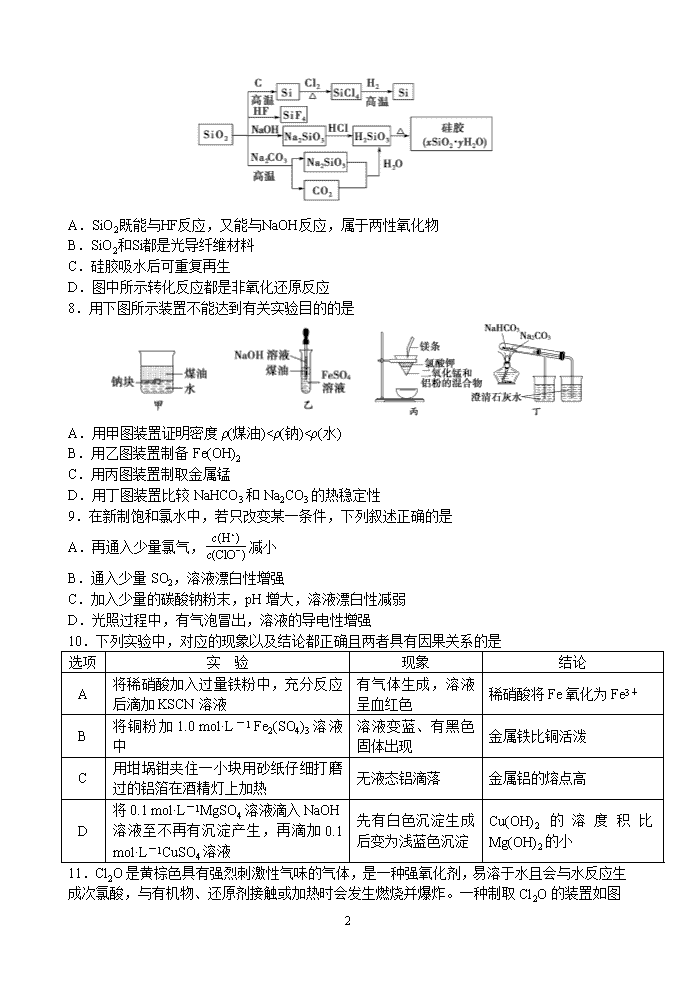
7.二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(各种转化见下图)。下列说法正确的是
11
A.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B.SiO2和Si都是光导纤维材料
C.硅胶吸水后可重复再生
D.图中所示转化反应都是非氧化还原反应
8.用下图所示装置不能达到有关实验目的的是
A.用甲图装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
B.用乙图装置制备Fe(OH)2
C.用丙图装置制取金属锰
D.用丁图装置比较NaHCO3和Na2CO3的热稳定性
9.在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A.再通入少量氯气,减小
B.通入少量SO2,溶液漂白性增强
C.加入少量的碳酸钠粉末,pH增大,溶液漂白性减弱
D.光照过程中,有气泡冒出,溶液的导电性增强
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实 验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加1.0 mol·L-1 Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
无液态铝滴落
金属铝的熔点高
D
将0.1 mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液
先有白色沉淀生成后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
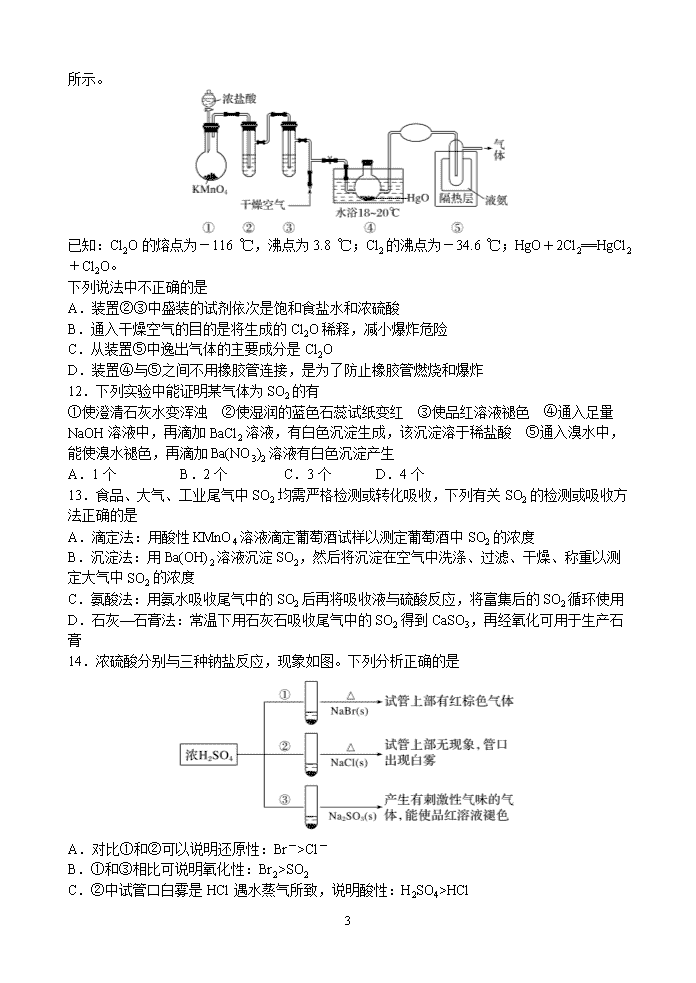
11.Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2
11
O的装置如图所示。
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2==HgCl2+Cl2O。
下列说法中不正确的是
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
12.下列实验中能证明某气体为SO2的有
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色 ④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中,能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生
A.1个 B.2个 C.3个 D.4个
13.食品、大气、工业尾气中SO2均需严格检测或转化吸收,下列有关SO2的检测或吸收方法正确的是
A.滴定法:用酸性KMnO4溶液滴定葡萄酒试样以测定葡萄酒中SO2的浓度
B.沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重以测定大气中SO2的浓度
C.氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循环使用
D.石灰—石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化可用于生产石膏
14.浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是
A.对比①和②可以说明还原性:Br->Cl-
B.①和③相比可说明氧化性:Br2>SO2
C.②中试管口白雾是HCl遇水蒸气所致,说明酸性:H2SO4>HCl
11
D.③中浓H2SO4被还原成SO2
15.已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是
A.①中发生的化学反应为NaNO2+NH4ClNaCl+N2↑+2H2O
B.④、⑥中依次盛装的试剂可以是浓H2SO4、碱石灰
C.③中盛放的试剂是NaOH溶液
D.实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
16.向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1 的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6 mol·L-1
C.产生的NO在标准状况下的体积为4.48 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
17.以氯酸钠等为原料制备亚氯酸钠的工艺流程如下,下列说法错误的是
A.NaClO3在发生器中作氧化剂
B.吸收塔中1mol H2O2得到2mol电子
C.吸收塔中温度不宜过高,会导致H2O2的分解
D.从“母液”中可回收的主要物质是Na2SO4
18.ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是
A.该装置可以在高温下工作
11
B.X、Y依次为阳离子、阴离子选择性交换膜
C.负极反应为CH3COO− +2H2O− 8e− =2CO2↑+7H+
D.该装置工作时,电能转化为化学能
非选择题:共55分。包括必考题和选考题两部分。第19~21题为必考题,每个试题考生都必须作答。第22~23题为选考题,考生根据要求作答。
(一)必考题:包括3题,共37分。
19.(13分)工业上可以用废铁屑制备活性Fe3O4,流程如下图:
(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________。
(2)在合成池里生成Fe3O4的离子方程式为__________________________。
(3)假如在反应池中几乎没有气体产生,根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________。
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):
操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
①操作Ⅱ中“……”的内容是___________________,烧杯中的现象是_____________________,相应的方程式是________________、________________。(是离子反应的写离子方程式)
11
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
20.(13分)以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在 (填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是 。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是 (选填编号)。
a.2NaCl(s)+MnO2+2H2SO4(浓)MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是 。装置C中NaOH的作用是 。
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。
萃取Ⅱ和酸化过程发生的离子反应方程式分别是:
3I2+6OH-=5I-+IO+3H2O; ;
萃取剂X应选择 (选填编号)。
a.100 mL苯 b.10 mL乙醇 c.10 mL CCl4 d.10 mL己烯
实验室进行萃取操作的仪器是 。操作Ⅰ的名称是 。
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是 (填写化学式);②要测定的物理量是 。
11
21.(14分)环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应:,△H=—100.5kJ/mol
副反应:,△H=—109.4kJ/mol
解聚反应:,
回答下列问题:
(1)反应的△H= _____ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
①0~4h氢化反应速率比副反应快的可能原因是_____________________________________。
②最佳的反应时间为_________h。若需迅速减慢甚至停止反应,可采取的措施有____________________________________(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_________________________________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是____________(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=_______kPa (Kp为以分压表示的平衡常数)。
(二)选考题:共15分。请考生从2道题中任选一题作答。如果多做,则按所做的第一题计分。
22.(15分)为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是 。
11
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因: 。
元素
Fe
Cu
第一电离能I1/kJ·mol-1
759
746
第二电离能I2/kJ·mol-1
1561
1958
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是 。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为 。
23.(15分)G是一种新型香料的主要成分之一,其结构中含有三个六元环。G的合成路线如下(部分产物和部分反应条件略去):
已知:①;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子;
③D和F是同系物。
请回答下列问题:
11
(1)(CH3)2C=CH2的系统命名法名称为 ,该分子中最多有 个原子在同一平面内。
(2)A→B反应过程中涉及的反应类型依次为 、 。
(3)D分子中含有的含氧官能团名称是 ,G的结构简式为 。
(4)生成E的化学方程式为 。
(5)同时满足下列条件:①与FeCl3溶液发生显色反应;②苯环上有两个取代基、含C=O的F的同分异构体有多种,其中核磁共振氢谱为4组峰、能水解的物质的结构简式为 。
(6)模仿由苯乙烯合成F的方法,写出由丙烯制取α-羟基丙酸() 的合成路线:
11
化学试题 参考答案
一、选择题(本题包括18小题,每小题2.5分,共45分。每小题只有一个选项符合题意)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
C
D
D
A
C
B
C
D
D
D
C
A
C
A
C
B
B
C
二、非选择题(共55分)
19.(13分)
(1)增大反应物之间的接触面积,增加反应速率,提高生产效率(2分)
(2)Fe2++2Fe3++8OH-Fe3O4↓+4H2O(2分)
(3)4∶1(2分)
(4)①当A中固体完全消失(1分) 无色溶液逐渐变黄,有气泡产生(2分) 2Fe2++H2O2+2H+2Fe3++2H2O(1分) 2H2O22H2O+O2↑(1分) ②Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少(2分)
20.(13分)
(1)坩埚(1分) 加快溶解速率(1分)
(2)bc(2分) Cl2+2I-===I2+2Cl-(1分) 吸收未反应的氯气,防止污染(1分)
(3)5I-+IO+6H+=3I2+3H2O(1分) c(1分) 分液漏斗(1分) 过滤(1分)
(4)①BaCl2或CaCl2(1分) ②样品质量和干燥沉淀质量(2分)
21.(14分)
(1)-209.9(2分)
(2)①氢化反应的活化能小或反应物的浓度大(2分) ②4(1分) 排出氢气或急剧降温(1分) ③副反应增加(2分)
(3)①CD(2分) ②50(2分) 3200(2分)
22.(15分)
(1)ds(1分) 直线形 (1分)
(2)失去第二个电子时,Cu 失去的是全充满 3d10 电子,Fe 失去的是 4s1 电子(2分)
(3)(1分) 12 NA(2分) BCD(2分)
(4)二者均为离子晶体,O2-半径小于 S2-半径,MnO 的晶格能大于 MnS(2分)
(5)体心(1分) 面心(1分) 620/(a´×10-7)3d (2分)
23.(15分)
(1)2-甲基-1-丙烯(或2-甲基丙烯,或甲基丙烯)(1分) 8个(1分)
(2)取代反应、加成反应(顺序不正确不给分)(2分,各1分)
一定条件
(3)羟基、羧基(顺序可以颠倒)(2分,各1分)(2分)
11
(4)(2分)
(5) 和 (2分,各1分)
(6)(3分)
11
相关文档
- 山西省运城市高中联合体2021届高三2021-06-0711页
- 四川省遂宁市射洪县柳树中学2019-22021-06-0720页
- 吉林省辽源市第五中学2019-2020学2021-06-0713页
- 辽宁省沈阳市第一七〇中学2020-2022021-06-0716页
- 山西省忻州市静乐县第一中学2021届2021-06-0718页
- 黑龙江省2021届高三上学期期初检测2021-06-0719页
- 安徽省淮南市寿县第二中学2019-2022021-06-0717页
- 四川省广元川师大万达中学2019-2022021-06-0717页
- 云南省2020届高三适应性考试语文试2021-06-0735页
- 2021届高三全国卷高考模拟试卷 语2021-06-079页