- 7.72 MB
- 2021-06-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
北京市西城区2018—2019学年度第一学期期末试卷高三化学 2019.1
本试卷共8页,共100分。考试时长120分钟。考生务必将答案写在答题纸上,在试卷上作答无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32
第Ⅰ卷(选择题 共42分)
每小题只有1个选项符合题意。
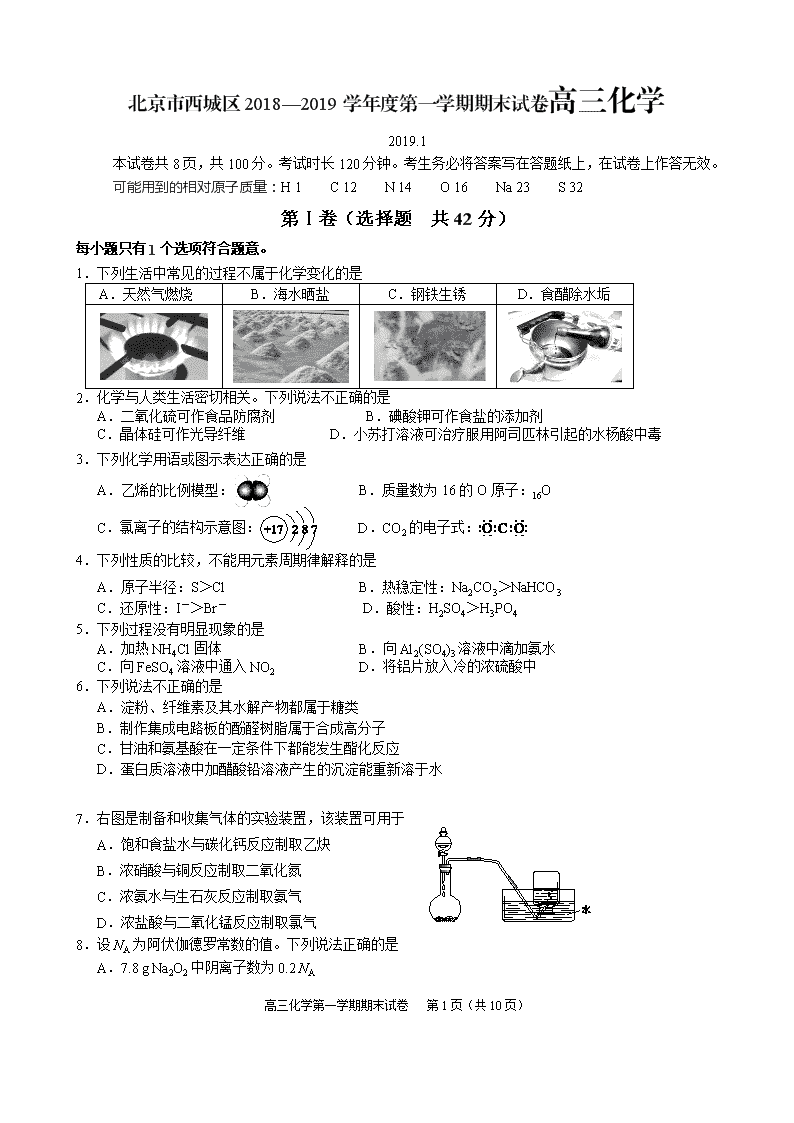
1.下列生活中常见的过程不属于化学变化的是
A.天然气燃烧
B.海水晒盐
C.钢铁生锈
D.食醋除水垢
2.化学与人类生活密切相关。下列说法不正确的是
A.二氧化硫可作食品防腐剂 B.碘酸钾可作食盐的添加剂
C.晶体硅可作光导纤维 D.小苏打溶液可治疗服用阿司匹林引起的水杨酸中毒
3.下列化学用语或图示表达正确的是
A.乙烯的比例模型: B.质量数为16的O原子:16O
C.氯离子的结构示意图: D.CO2的电子式:
4.下列性质的比较,不能用元素周期律解释的是
A.原子半径:S>Cl B.热稳定性:Na2CO3>NaHCO3
C.还原性:I->Br- D.酸性:H2SO4>H3PO4
5.下列过程没有明显现象的是
A.加热NH4Cl固体 B.向Al2(SO4)3溶液中滴加氨水
C.向FeSO4溶液中通入NO2 D.将铝片放入冷的浓硫酸中
6.下列说法不正确的是
A.淀粉、纤维素及其水解产物都属于糖类
B.制作集成电路板的酚醛树脂属于合成高分子
C.甘油和氨基酸在一定条件下都能发生酯化反应
D.蛋白质溶液中加醋酸铅溶液产生的沉淀能重新溶于水
7.右图是制备和收集气体的实验装置,该装置可用于
A.饱和食盐水与碳化钙反应制取乙炔
B.浓硝酸与铜反应制取二氧化氮
C.浓氨水与生石灰反应制取氨气
D.浓盐酸与二氧化锰反应制取氯气
8.设NA为阿伏伽德罗常数的值。下列说法正确的是
A.7.8 g Na2O2中阴离子数为0.2 NA
高三化学第一学期期末试卷 第10页(共10页)
B.1 mol OH-含有的电子数为10 NA
C.常温常压下,2.24 L乙烯中含有的氢原子数为0.4 NA
D.0.1 L 0.5 mol·L− 1 CH3COOH溶液中含有的氢离子数为0.05 NA
9.下列反应方程式书写不正确的是
电解
A.用氢氟酸雕刻玻璃:SiO2 + 4HF == SiF4↑+ 2H2O
B.工业上用电解法制镁:MgCl2(熔融) ==== Mg + Cl2↑
C.将铝片打磨后放入氢氧化钠溶液中:2Al + 2OH-== 2AlO2- + H2↑
D.氢氧化亚铁暴露于空气中:4Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3
10.K2FeO4是优良的水处理剂,一种制备方法是将Fe2O3、KNO3、KOH混合共熔,反应为Fe2O3 + 3KNO3 + 4KOH == 2K2FeO4 + 3KNO2 + 2H2O。下列关于该反应的说法不正确的是
A.铁元素被氧化,氮元素被还原 B.氧化性:KNO3>K2FeO4
C.每生成1 mol K2FeO4,转移6 mol e− D.K2FeO4具有氧化杀菌作用
11.下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是
A.将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4
B.将TiCl4加入水中并加热使其转化为TiO2·xH2O
C.将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3
D.将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀
12.一种在工业生产中有广泛用途的有机高分子结构片段如下图。
下列关于该高分子的说法正确的是
A.能水解成小分子
B.单体只含有一种官能团
C.氢键对该高分子的性能没有影响
D.结构简式为:
13.下图是一种新型的光化学电源,当光照射光电极时,通入O2和H2S即产生稳定的电流(H2AQ和AQ是两种有机物)。下列说法不正确的是
光照
A.负极的电极反应为2I- − 2e-== I2
B.总反应为 H2S + O2 ==== H2O2 + S
C.H+通过阳离子交换膜从正极区进入负极区
D.电源工作时发生了光能、化学能、电能间的转化
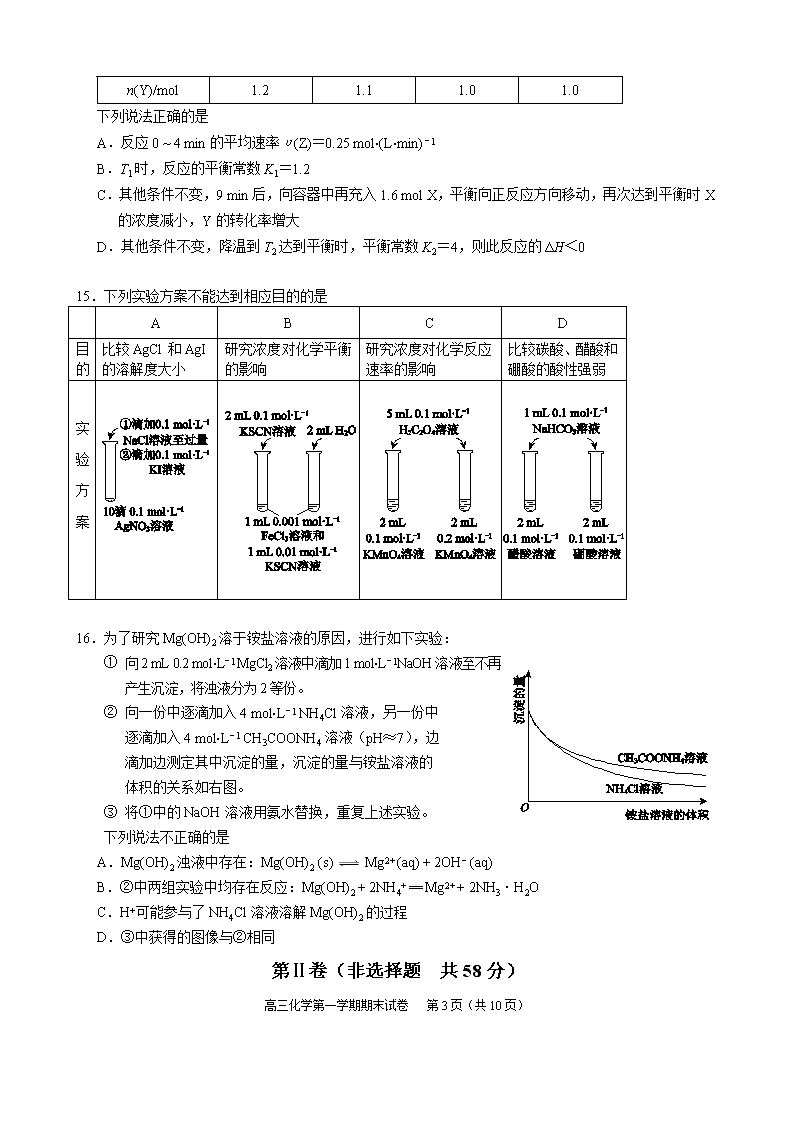
14.温度为T1时,将气体X和气体Y各1.6 mol充入10 L恒容密闭容器中,发生反应
X (g) + Y(g) 2Z(g),一段时间后达到平衡。反应过程中测定的数据如下表:
t /min
2
4
7
9
高三化学第一学期期末试卷 第10页(共10页)
n(Y)/mol
1.2
1.1
1.0
1.0
下列说法正确的是
A.反应0 ~ 4 min的平均速率υ(Z)=0.25 mol·(L·min) − 1
B.T1时,反应的平衡常数K1=1.2
C.其他条件不变,9 min后,向容器中再充入1.6 mol X,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D.其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的ΔH<0
15.下列实验方案不能达到相应目的的是
A
B
C
D
目的
比较AgCl和AgI的溶解度大小
研究浓度对化学平衡的影响
研究浓度对化学反应速率的影响
比较碳酸、醋酸和硼酸的酸性强弱
实验方案
16.为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
① 向2 mL 0.2 mol·L− 1 MgCl2溶液中滴加1 mol·L− 1NaOH溶液至不再产生沉淀,将浊液分为2等份。
② 向一份中逐滴加入4 mol·L− 1 NH4Cl溶液,另一份中
逐滴加入4 mol·L− 1 CH3COONH4溶液(pH≈7),边
滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的
体积的关系如右图。
③ 将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是
A.Mg(OH)2浊液中存在:Mg(OH)2 (s) Mg2+ (aq) + 2OH− (aq)
B.②中两组实验中均存在反应:Mg(OH)2 + 2NH4+ == Mg2+ + 2NH3·H2O
C.H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D.③中获得的图像与②相同
第Ⅱ卷(非选择题 共58分)
高三化学第一学期期末试卷 第10页(共10页)
17.(6分)溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如下:
(1)Cl2和苦卤中的Br−反应生成Br2的离子方程式是________。
(2)结合元素周期律解释Cl的非金属性强于Br的原因:________。
(3)吸收塔中,A吸收了Br2后的溶液中含有Br−和BrO3−,则A是________(填序号)。
a.NaCl溶液 b.Na2CO3溶液 c.SO2气体
(4)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是________。
18.(6分)实验小组研究稀硝酸与铁粉的反应,进行如下实验:
向2.0 mL 0.5 mol·L− 1HNO3中加入过量铁粉,生成无色气体,遇空气不变色。充分反应后,溶液几乎无色。
(1)N在元素周期表中的位置是________。
(2)经检验,反应后的溶液中含有NH4+,检验NH4+的实验方案是________。
(3)实验中,生成NH4+的离子方程式是________。
(4)若反应后溶液中含有2×10−5 mol NH4+, HNO3得到的电子的物质的量为n(e−),则n(e−)________1.6×10−4 mol(填“>”、“=”或“<”)。
高三化学第一学期期末试卷 第10页(共10页)
19.(10分)直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可
吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
图1
已知: H2SO3、HSO3−、SO32−在水溶液中的物质的量分数随pH的分布如图2,
Na2SO3·7H2O 和Na2SO3的溶解度曲线如图3。
图2 图3
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:________。
(2)吸收烟气
① 为提高NaHSO3的产率,应控制吸收塔中的pH为________。
② NaHSO3溶液中c(SO32−)>c(H2SO3),结合方程式解释其原因:________。
③ 已知下列反应:
SO2(g) + 2OH− (aq) == SO32− (aq) + H2O(l) ΔH1=−164.3 kJ·mol− 1
CO2(g) + 2OH− (aq) == CO32− (aq) + H2O(l) ΔH2=−109.4 kJ·mol− 1
2HSO3− (aq) == SO32− (aq) + SO2(g) + H2O(l) ΔH3=+34.0 kJ·mol− 1
吸收塔中Na2CO3溶液吸收SO2生成HSO3−的热化学方程式是________。
④ 吸收塔中的温度不宜过高,可能的原因是________(写出1种即可)。
(3)制备无水Na2SO3
将中和塔中得到的Na2SO3溶液________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
高三化学第一学期期末试卷 第10页(共10页)
20.(12分)KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是________。
(2)Ⅰ中,生成K2MnO4的化学方程式是________。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是________。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是________。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4。装置如下图:
① b极是______极(填“阳”或“阴”),D是________。
② 结合电极反应式简述生成KMnO4的原理:________。
③ 传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是________。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 + H2SO4 == H2C2O4 + Na2SO4
5H2C2O4 + 2MnO4−+ 6H+ == 2Mn2+ + 10CO2↑+ 8H2O
摩尔质量:Na2C2O4 134 g·mol− 1 KMnO4 158 g·mol− 1
ⅰ.称取a g产品,配成50 mL溶液。
ⅱ.称取b g Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液V mL(杂质不参与反应)。
产品中KMnO4的质量分数的表达式为________。
高三化学第一学期期末试卷 第10页(共10页)
21.(10分)实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。
【实验Ⅰ】向盛有H2O2溶液的试管中,加入过量的K2Cr2O7溶液和硫酸,振荡,溶液立即变为紫红色,此时pH=1。溶液中持续产生气泡,最终溶液变为绿色。
资料:
ⅰ.Cr2(SO4)3溶液呈绿色。
ⅱ.酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2。
ⅲ.CrO5是一种+6价Cr的过氧化物,其结构如右图,CrO5可溶于水,
易溶于乙醚得到蓝色溶液。
ⅳ.乙醚是一种无色、不溶于水、密度比水小的有机溶剂,化学性质稳定。
(1)实验Ⅰ中产生的气体是O2,检验的方法是________。
(2)实验Ⅰ的紫红色溶液中含有CrO5。
① 验证紫红色溶液中含有CrO5的操作及现象是________。
② 生成CrO5的反应不是氧化还原反应,反应的离子方程式是________。
(3)对实验Ⅰ中溶液变为绿色和产生O2的原因,作出如下假设:
a.CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。
b.CrO5在酸性条件下氧化了溶液中的H2O2,生成Cr3+和O2。
为验证上述假设,用下图装置进行实验Ⅱ和实验Ⅲ(夹持装置已略,B中石蜡油
用于吸收挥发出的乙醚)。实验操作及现象如下:
【实验Ⅱ】
ⅰ.将20 mL CrO5的乙醚溶液加入A中的20 mL
pH=1的稀硫酸中,不断搅拌,乙醚层由蓝色
变为无色,水层变为绿色,O2体积为V mL。
ⅱ.步骤ⅰ结束后向A中加入少量K2Cr2O7溶
液,轻轻搅拌,静置,乙醚层又显出蓝色。
【实验Ⅲ】
仅将实验Ⅱ中的pH=1的稀硫酸替换为等量的含H2O2的pH=1的稀硫酸,重复实验。
现象与实验Ⅱ相同,且O2体积仍为V mL。
① 实验Ⅱ步骤ⅰ中消耗的CrO5与生成的O2的物质的量之比为2∶3,补全离子方程式:
2CrO5 +________ == 2Cr3+ + 3O2↑+ ________ + ________。
② 甲同学认为依据实验Ⅱ和Ⅲ中生成O2的体积相同,无法说明假设b是否成立,其理由是________。
(4)实验Ⅰ中总反应的离子方程式是________。
高三化学第一学期期末试卷 第10页(共10页)
22.(14分)M是合成某药物的中间产物,其合成路线如下:
已知:
Ⅰ.
Ⅱ.
Ⅲ.
(1)A分子无支链,只含有一种官能团,官能团的名称是________。
(2)B→E的反应类型是________。
(3)D的结构简式是________。
(4)F→G的化学方程式是________。
(5)已知J的分子式是C5H10O3,核磁共振氢谱有两个峰,峰面积比为2∶3,
且1 mol J可与2 mol NaOH溶液发生水解反应,J的结构简式是________。
(6)L的结构简式是________。
(7)L→M时,L发生了________(填“氧化”或“还原”)反应。
高三化学第一学期期末试卷 第10页(共10页)
北京市西城区2018—2019学年度第一学期期末试卷
高三化学参考答案及评分标准
第Ⅰ卷(选择题 共42分)
1~6小题,每小题2分;7~16小题,每小题3分。
题号
1
2
3
4
5
6
7
8
答案
B
C
A
B
D
D
A
B
题号
9
10
11
12
13
14
15
16
答案
C
C
A
D
C
D
C
D
第Ⅱ卷(非选择题 共58分)
说明:其他合理答案均可参照本标准给分。
17.(共6分)
(1)Cl2 + 2Br− == Br2 + 2Cl− (2分)
(2)Cl和Br均为第ⅦA族元素,原子最外层电子数均为7,电子层数Cl<Br,原子半径Cl<Br,得电子能力Cl>Br,非金属性Cl>Br(1分)
(3)b(1分)
(4)5Br−+ BrO3− + 6H+ == 3Br2 + 3H2O(2分)
18.(共6分)
(1)第二周期第ⅤA族(1分)
(2)取少量溶液于试管中,加入浓NaOH溶液,加热,将湿润的红色石蕊试纸接近试管口,若试纸变蓝,则含有NH4+(2分)
(3)4Fe + 10H+ + NO3− == 4Fe2+ + NH4+ + 3H2O(2分)
(4)>(1分)
19.(每空2分,共10分)
(1)CO32− + H2O OH− + HCO3−(1分)
(2)① 4~5(1分)
② 溶液中,HSO3−存在:HSO3− H+ + SO32−和HSO3− + H2O H2SO3 + OH−,HSO3−的电离程度强于水解程度
③ 2SO2(g) + CO32− (aq) + H2O(l) == 2HSO3−(aq) + CO2 (g) ΔH=− 88.9 kJ·mol− 1
④ 防止SO2的溶解度下降;防止HSO3−受热分解;防止HSO3−的氧化速率加快等
(3)隔绝空气,加热浓缩至有大量固体析出,高于34℃过滤
高三化学第一学期期末试卷 第10页(共10页)
20.(共12分)
焙烧
(1)增大反应物接触面积,加快反应速率(1分)
(2)2MnO2 + 4KOH + O2 ===== 2K2MnO4 + 2H2O(2分)
(3)保持溶液呈强碱性,防止K2MnO4发生歧化反应(1分)
(4)3K2MnO4 + 2CO2 == 2KMnO4 + MnO2↓+ 2K2CO3(2分)
(5)① 阴(1分) 较浓的KOH溶液(1分)
② a极:MnO42− − e− == MnO4−,部分K+通过阳离子交换膜进入阴极区,阳极区生成KMnO4(1分)
③ 用阳离子交换膜可防止MnO4−、MnO42−在阴极被还原(1分)
(6) (2分)
21.(共10分)
(1)将带火星的木条伸入试管中,木条复燃,说明生成的气体是O2(1分)
(2)① 取少量紫红色溶液于试管中,加入乙醚,振荡,静置,液体分为两层,上层呈蓝色(2分)
② Cr2O72− + 4H2O2 + 2H+ == 2CrO5 + 5H2O(2分)
(3)① 2CrO5 + 6H+== 2Cr3+ + 3O2↑+ H2O2 + 2H2O(2分)
② 实验Ⅱ、Ⅲ中,O2来源于CrO5、H2O2中的−1价O,且−1价O过量,当CrO5的量相同时,生成O2的体积相同,因而由实验Ⅱ和Ⅲ中生成O2的体积相同无法说明假设b是否成立(1分)
(4)Cr2O72− + 3H2O2 + 8H+ == 2Cr3+ + 3O2↑+ 7H2O(2分)
22.(每空2分,共14分)
(1)羧基 (2)加成反应
(3)
(4)
(5)
(6)
(7)还原
高三化学第一学期期末试卷 第10页(共10页)