- 174.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一节 最简单的有机化合物——甲烷
第1课时
教学目标:1、了解自然界中甲烷的存在及储量情况
2、通过实践活动掌握甲烷的结构式和甲烷的正四面体结构
3、通过实验探究理解并掌握甲烷的取代反应原理
4、了解甲烷及其取代反应产物的主要用途
5、培养学生实事求是、严肃认真的科学态度,培养学生的实验操作能力
重点、难点:甲烷的结构和甲烷的取代反应
教学过程:
通过简单计算确定甲烷的分子式
画出碳原子的原子结构示意图,推测甲烷分子的结构。
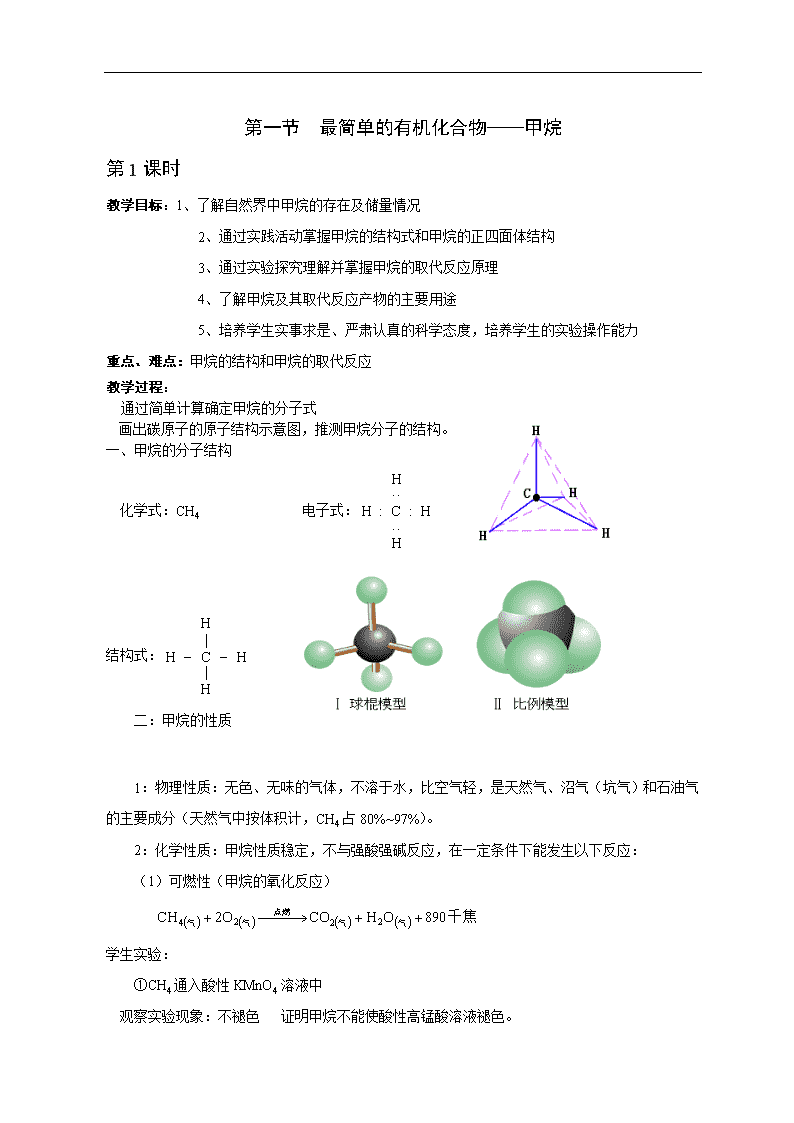
一、甲烷的分子结构
化学式:CH4 电子式:
结构式:
二:甲烷的性质
1:物理性质:无色、无味的气体,不溶于水,比空气轻,是天然气、沼气(坑气)和石油气的主要成分(天然气中按体积计,CH4占80%~97%)。
2:化学性质:甲烷性质稳定,不与强酸强碱反应,在一定条件下能发生以下反应:
(1)可燃性(甲烷的氧化反应)
学生实验:
①CH4通入酸性KMnO4溶液中
观察实验现象:不褪色 证明甲烷不能使酸性高锰酸溶液褪色。
结论: 一般情况下,性质稳定,与强酸、强碱及强氧化剂等不起反应
(2)取代反应:
② 取代反应实验
观察现象:色变浅、出油滴、水上升、有白雾、石蕊变红。
在室温下,甲烷和氯气的混合物可以在黑暗中长期保存而不起任何反应。但把混合气体放在光亮的地方就会发生反应,黄绿色的氯气就会逐渐变淡,有水上升、有白雾、石蕊试液变红,证明有HCl气体生成,出油滴,证明有不溶于水的有机物生成。
定义——有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应叫取代反应。
CH4 CH3Cl CH2Cl2 CHCl3 CCl4 均不溶于水
化学式
CH3Cl
CH2Cl2
CHCl3
CCl4
名称(俗名)
溶解性
常温状态
用途
取代反应与置换反应的比较:
取代反应
置换反应
可与化合物发生取代,生成物中不一定有单质
反应物生成物中一定有单质
反应能否进行受催化剂、温度、光照等外界条件的影响较大
在水溶液中进行的置换反应遵循金属或非金属活动顺序。
分步取代,很多反应是可逆的
反应一般单向进行
3、用途:
甲烷是一种很好的气体燃料,可用于生产种类繁多的化工产品。
4.补充练习
1.下列有关甲烷的说法中错误的是 ( )
A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的
B.天然气的主要成分是甲烷
C.甲烷是没有颜色、没有气味的气体,极易溶于水
D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂
2.下列关于甲烷性质的说法中,错误的是 ( )
A.甲烷是一种非极性分子 B.甲烷分子具有正四面体结构
C.甲烷分子具有极性键 D.甲烷分子中H-C—H的键角为90℃
3.下列物质在一定条件下可与CH4发生化学反应的是 ( )
A.氯气 B.溴水 C.氧气 D.酸性KMnO4溶液
4.将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,所得产物中物质的量最大的是 ( )
A.CH3Cl B.CH2Cl2 C.CCl4 D.HCl
5.下列气体在氧气中充分燃烧后 ,其产物既可使无水硫酸铜变蓝,又可使澄清石灰水变浑浊的是 ( )
A.H2S B.CH4 C.H2 D.CO
6.甲烷的电子式为________,结构式为________。1 g甲烷含_______个甲烷分子,4 g 甲烷与____________ g水分子数相等,与___________g一氧化碳原子数相等。
7.甲烷和氯气发生的一系列反应都是________反应,生成的有机物中常用作溶剂的____________,可用作灭火剂的是_____________,氯仿的化学式是___________。参照此类反应,试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式____________________________________________________________。
8.在标准状况下,1.12 L某气态烃(密度为0.717g/L)充分燃烧后,将生成的气体先通过无水氯化钙,再通过氢氧化钠溶液,经测定前者增重1.8 g,后者增重2.2 g,求该烃的分子式。
[第2课时]
教学目标:1、掌握烷烃、同系物、同分异构体、同分异构现象等概念
2、了解常温下常见烷烃的状态
3、通过探究了解烷烃与甲烷结构上的相似性和差异性
4、培养学生的探究精神及探究能力
重点、难点:同分异构体的写法
教学过程:
一:烷烃:结构特点和通式:
烃的分子里碳原子间都以单键互相连接成链状,碳原子的其余的价键全部跟氢原子结合,达到饱和状态。所以这类型的烃又叫饱和烃。由于C-C连成链状,所以又叫饱和链烃,或叫烷烃。(若C-C连成环状,称为环烷烃。)
分别书写甲烷、乙烷、丙烷等烷烃的结构式。
同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
甲烷、乙烷、丙烷等都是烷烃的同系物。
关于烷烃的知识,可以概括如下:
① 烷烃的分子中原子全部以单键相结合,它们的组成可以用通式CnH2n+2表示。
② 这一类物质成为一个系统,同系物之间彼此相差一个或若干个CH2原子团。
③ 同系物之间具有相似的分子结构,因此化学性质相似,物理性质则随分子量的增大而逐渐变化。
(烃基:烃分子失去一个或几个氢原子所剩余的部分叫烃基,用“R-”表示;烷烃失去氢原子后的原子团叫烷基,如-CH3叫甲基、-CH2CH3叫乙基;一价烷基通式为 CnH2n+1- )
二:同分异构现象和同分异构体
定义:化合物具有相同的化学式,但具有不同结构的现象,叫做同分异构现象。具有同分异构现象的化合物互称同分异构体。如正丁烷与异丁烷就是丁烷的两种同分异构体,属于两种化合物。
正丁烷 异丁烷
熔点(℃) -138.4 -159.6
沸点(℃) -0.5 -11.7
我们以戊烷(C5H12)为例,看看烷烃的同分异构体的写法:
先写出最长的碳链:C-C-C-C-C 正戊烷 (氢原子及其个数省略了)
然后写少一个碳原子的直链:()
然后再写少两个碳原子的直链:把剩下的两个碳原子当作一个支链加在主链上:
(即)
探究C6H14的同分异构体有几种?
补充练习
1.下列有机物常温下呈液态的是 ( )
A.CH3(CH2)2CH3 B.CH3(CH2)15CH3
C.CHCl3 D.CH3Cl
2.正己烷的碳链是 ( )
A.直线形 B.正四面体形 C.锯齿形 D.有支链的直线形
3.下列数据是有机物的式量,其中可能互为同系物的一组是 ( )
A.16、30、58、72 B.16、28、40、52
C.16、32、48、54 D.16、30、42、56
4.在同系物中所有同系物都是 ( )
A.有相同的分子量 B.有相同的通式
C.有相同的物理性质 D.有相似的化学性质
5.在常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,其中消耗氧气最多的是 ( )
A.CH4 B.C2H6 C.C3H8 D.C4H10
6.请用系统命名法命名以下烷烃
︱
C2H5
︱
CH3
⑴ C2H5-CH-CH-(CH2)3-CH3 ⑵
CH3-CH-CH-C-H
CH3︱
C2H5︱
︱
CH3
︱
CH3
C2H5︱
︱
CH2-CH2-CH3
︱
CH2
︱
CH3
⑶ ⑷
CH3-CH-C-CH3 CH3-C-CH2-C-CH3
7.根据有机化学命名原则,判断下列命名是否有错误,若有错误请根据所要反映的化合物的结构给予重新命名。
(1)2-乙基丙烷:
(2)2,4-二乙基戊烷
(3)3,3-二甲基-4-乙基己烷
(4)2,4-二甲基-6,8-二乙基壬烷
8.室温时20 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复
至室温,气体体积减少了50 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了
40 mL 。求气态烃的分子式
参考答案:
6.(1)4-甲基-3-乙基辛烷 (2)2,3,4-三甲基己烷
(3)3,4-二甲基-4-乙基庚烷 (4) 2,2,4,4-四甲基己烷
7.(1)错 2-甲基丁烷 (2)错 3,5-二甲基庚烷
(3)对 (4)错 2,4,6-三甲基-6-乙基癸烷
8.C2H6
相关文档
- 高中化学水溶液中的离子平衡第节盐2021-07-0228页
- 高中化学 2_1_2 键参数 等电子体2021-07-025页
- 人教版高中化学选修五 2_2芳香烃第2021-07-0221页
- 高中化学比热容单元测试题2021-07-024页
- 2020高中化学第二章化学键化学反应2021-07-026页
- 高中人教版化学选修1课件:第3章 第2021-07-0222页
- 2020版新教材高中化学第3章简单的2021-07-028页
- 2020高中化学 第一章 从实验学化学2021-07-024页
- 2020高中化学 每日一题之快乐暑假 2021-07-023页
- 高中化学 2_3《化学平衡》课件1 新2021-07-0271页