- 1.73 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二单元
含硅矿物与信息材料
考点
1:
碳、硅及其氧化物的性质及应用
一、碳、硅的性质
(a
、
b)
1.
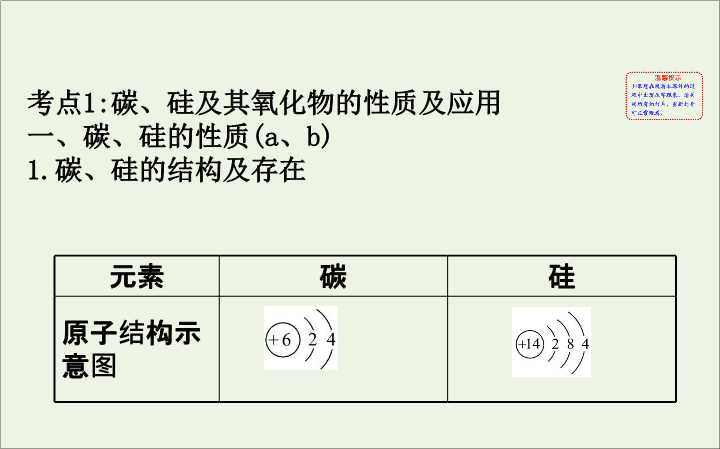
碳、硅的结构及存在
元素
碳
硅
原子结构示意图
元素
碳
硅
单质的结构
金刚石
:_________
结构
石墨
:
层状结构
晶体硅
:
与金刚石
类似的空间网状
结构
元素在自然
界中的存在
形式
既有游离态又有化
合态
只有
_____
态
空间网状
化合
2.
碳、硅的物理性质和用途
物质
石墨
金刚石
晶体硅
外观
黑色鳞片
状固体
无色晶体
有金属光泽的
灰黑色固体
硬度
很小
自然界中
硬度最大
硬度大
物质
石墨
金刚石
晶体硅
导电性
导体
不能导电
半导体
用途
用作电极、
铅笔芯
制作
首饰等
制作信息技术材料
,
是半导体晶体管、硅芯片及太阳能电池等的主要成分
3.
碳和硅的化学性质
——
还原性
写出①~⑥的化学方程式
:
①______________;②______________;
③_________________;
④_____________________________
⑤______________________;
⑥____________________________
。
2C+O
2
2CO
CO
2
+C
2CO
CuO+C Cu+CO↑
C+H
2
O(g) CO+H
2
(
制水煤气
);
Si+4HF====SiF
4
↑+2H
2
↑
Si+2NaOH+H
2
O====Na
2
SiO
3
+2H
2
↑
点燃
====
高温
====
△
====
高温
====
4.
硅的工业制法及提纯
涉及的化学方程式
:
①_____________________;
②__________________;
③______________________
。
SiO
2
+2C Si+2CO↑
Si+2Cl
2
SiCl
4
SiCl
4
+2H
2
Si+4HCl
高温
====
△
====
△
====
二、碳、硅的氧化物
(a
、
b)
1.
性质迥异的两种氧化物
——CO
2
与
SiO
2
物质
二氧化硅
二氧化碳
与水反应
不反应
CO
2
+H
2
O H
2
CO
3
物质
二氧化硅
二氧化碳
与酸反应
只与氢氟酸反应
:SiO
2
+4HF====
SiF
4
↑+2H
2
O
不反应
物质
二氧化硅
二氧化碳
与碱
(NaOH)
溶液反应
SiO
2
+2NaOH====
Na
2
SiO
3
+H
2
O(
盛
碱液的试剂瓶用
_____
塞
)
CO
2
少量
:
CO
2
+2NaOH
====
Na
2
CO
3
+H
2
O
CO
2
足量
:CO
2
+NaOH
====
NaHCO
3
橡胶
物质
二氧化硅
二氧化碳
与盐反应
如与
Na
2
CO
3
反
应
:SiO
2
+Na
2
CO
3
Na
2
SiO
3
+
CO
2
↑
如与
Ca(ClO)
2
反应
:Ca(ClO)
2
+CO
2
+H
2
O====CaCO
3
↓+
2HClO
高温
====
物质
二氧化硅
二氧化碳
与碱性氧化物反应
如与
CaO
反应
:SiO
2
+CaO CaSiO
3
如与
Na
2
O
反应
:CO
2
+Na
2
O
====Na
2
CO
3
高温
====
2.
硅及其氧化物的特性
物质
一般规律
特性
Si
硅的还原性比碳强
SiO
2
+2C
Si+2CO↑
非金属单质与强碱反应一般不生成氢气
Si+2NaOH+H
2
O====
Na
2
SiO
3
+2H
2
↑
高温
====
物质
一般规律
特性
Si
非金属单质一般不与非氧化性酸反应
Si+4HF====SiF
4
↑
+2H
2
↑
一般非金属单质为绝缘体
硅为半导体
物质
一般规律
特性
SiO
2
酸性氧化物一般与水反应生成相应的酸
SiO
2
不溶于水
,
不与水反应
酸性氧化物一般不与酸发生复分解反应
SiO
2
+4HF====
SiF
4
↑+2H
2
O
物质
一般规律
特性
SiO
2
“
较强酸制较弱酸”是复分解反应的一般规律
,
碳酸酸性大于硅酸
Na
2
SiO
3
+CO
2
+
H
2
O====H
2
SiO
3
↓+
Na
2
CO
3
Na
2
CO
3
+SiO
2
Na
2
SiO
3
+CO
2
↑
高温
====
【
典例精析
】
【
典例
】
二氯二氢硅
(SiH
2
Cl
2
)
常用于外延法工艺中重要的硅源。易燃、有毒
,
与水接触易水解
,
沸点为
8.2 ℃
。在铜催化作用下
,HCl
与硅在
250
~
260 ℃
反应可以制得
SiH
2
Cl
2
。 世纪金榜导学号
(1)
利用浓硫酸、浓盐酸为原料
,
选用
A
装置制取
HCl,
利用了浓硫酸的
__________
性。
(2)D
装置中生成二氯二氢硅的化学方程式为
______________________________________
。
(3)
按照气体从左到右的方向
,
制取
SiH
2
Cl
2
的装置
(h
处
用止水夹夹好
)
连接顺序为
a (
) (
)
(
) (
) (
) (
) (
)(
填仪
器接口的字母
,
其中装置
C
用到
2
次
)
。
(4)
按从左到右的顺序
,
前面装置
C
中装的药品为
________________,
后面装置
C
的作用为
____________
________________________
。
(5)
反应除生成二氯二氢硅之外
,
还会生成
H
2
和
____________
、
____________
等。
(6)
新的制取
SiH
2
Cl
2
的方法是往硅粉中先通入
Cl
2
,
在
300
~
350 ℃
反应生成
SiCl
4
,
然后再与
HCl
在
250
~
260 ℃
反应
,
可以大大提高产率。如果通入气体顺序相反
,
结果会
____________________________(
用化学方程式表示
)
。
【
解析
】
(1)
浓硫酸有吸水性
,
使浓盐酸更易挥发出
HCl
。
(2)
利用原子守恒法配平。
(3)A
装置制取
HCl,
连接
C
装
置干燥
,
从
f
进入
D
中反应
,SiH
2
Cl
2
从
g
处挥发
,
在
B
装置中
收集
,SiH
2
Cl
2
的密度比空气大
,
导气管应长进短出
,
为防
止空气中的水进入
B
中
,
则应在
B
后接干燥管。
(4)
前面
的装置
C
是用来干燥氯化氢气体的
,
应选用
P
2
O
5
或无水
CaCl
2
,
后面装置
C
的作用为尾气处理和防止空气中的水
进入
B
中
,
应选碱石灰。
(6)
如果通入气体顺序相反
,SiH
2
Cl
2
会与
Cl
2
继续反应
,
生成
SiCl
4
、
SiHCl
3
。
答案
:
(1)
吸水
(2)Si+2HCl SiH
2
Cl
2
(3)d
e
f
g
b
c
d
(4)P
2
O
5
或无水
CaCl
2
尾气处理和防止空气中的水进入
B
中
(5)SiCl
4
SiHCl
3
(6)SiH
2
Cl
2
+2Cl
2
SiCl
4
+2HCl(
或
SiH
2
Cl
2
+Cl
2
SiHCl
3
+HCl)
△
====
△
====
【
强化训练
】
1.
思维诊断
(
正确的打“√”
,
错误的打“
×”)
(1)CO
2
通入
CaCl
2
或
BaCl
2
溶液有白色沉淀生成。
(
)
提示
:
×
。
CO
2
通入
CaCl
2
或
BaCl
2
溶液不会产生白色沉淀
,
因为碳酸的酸性弱于盐酸。
(2)
可以将氢氟酸放在玻璃试剂瓶存放。
(
)
提示
:
×
。因为氢氟酸与玻璃中的
SiO
2
反应生成气体
SiF
4
,
强烈腐蚀玻璃
,
氢氟酸应保存在塑料瓶或铅皿中。
(3)
硅的化学性质不活泼
,
常温下不与任何物质反应。
(
)
提示
:
×
。
Si
与
O
2
反应。
(4)
单质硅是将太阳能转变为电能的常用材料。
(
)
提示
:
√
。硅是良好的半导体。
(5)
石英砂可用于生产单晶硅。
(
)
提示
:
√
。石英砂的成分为
SiO
2
,
可用碳还原得到粗硅
,
经提纯得单晶硅。
2.
硅及其化合物的应用范围很广。下列说法正确的是
(
)
A.
硅是人类将太阳能转换为电能的常用材料
B.
粗硅制备单晶硅不涉及氧化还原反应
C.
反应
Si+2NaOH+H
2
O====Na
2
SiO
3
+2H
2
↑
中
,Si
为还原剂
,NaOH
和
H
2
O
为氧化剂
D.
硅能与氢氟酸反应
,
则硅可以与盐酸反应
【
解析
】
选
A
。由粗硅制备单晶硅的过程一般为
Si
SiCl
4
Si+HCl,
都是氧化还原反应
,B
项错误
;Si
与烧
碱溶液反应时
,H
2
O
是氧化剂
,C
项错误
;
硅不能与盐酸反
应
,D
项错误。
3.
诺贝尔物理学奖曾授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德
·
博伊尔和乔治
·
史密斯。光导纤维的主要成分是二氧化硅
,
下列关于二氧化硅的说法正确的是
(
)
A.
二氧化硅是酸性氧化物
,
因此能与水反应生成硅酸
B.
用二氧化硅制取单质硅时
,
当生成
2.24 L
气体
(
标准状况
)
时
,
得到
2.8 g
硅
C.6 g
二氧化硅中含有
0.2 mol
共价键
D.
二氧化硅不能与碳酸钠溶液反应
,
但能与碳酸钠固体在高温时发生反应
【
解析
】
选
D
。
A
项
,SiO
2
不与水反应
;B
项
,SiO
2
+2C
Si+2CO↑,
可知当生成标准状况下
2.24 L
气体时
,
得到
1.4 g Si;C
项
,6 g SiO
2
为
0.1 mol,
含有
0.4 mol
Si—O
键
;D
项正确。
高温
====
4.SiO
2
是一种重要的化工原料。下列说法错误的是 世纪金榜导学号
(
)
A.
图中所含反应都不属于氧化还原反应
B.
纯净二氧化硅和单晶硅都是信息产业的重要材料
C.
用盐酸可除去石英砂
(
主要成分为
SiO
2
)
中的碳酸钙
D.
炼铁时用石灰石将矿石中的脉石转化为易熔的炉渣
【
解析
】
选
A
。
C
与
SiO
2
反应、
Si
与
Cl
2
反应、
SiCl
4
与
H
2
反应
,
都属于氧化还原反应。
5.
单质
Z
是一种常见的半导体材料
,
可由
X
通过如图所示的路线制备
,
其中
X
为
Z
的氧化物
,Y
为氢化物
,
分子结构与甲烷相似
,
回答下列问题
:
(1)
能与
X
发生化学反应的酸是
________;
由
X
制备
Mg
2
Z
的化学方程式为
______________
。
(2)
由
Mg
2
Z
生成
Y
的化学方程式为
________________,
Y
分子的电子式为
______________
。
【
解析
】
Z
为半导体单质
,
则
Z
是
Si;
其氧化物为二氧化
硅
,
即
X
为
SiO
2
,
可与氢氟酸反应
,
根据反应的流程图可
知
,
二氧化硅与
Mg
反应生成
Mg
2
Si,Mg
2
Si
与盐酸反应生成
的
Y
为氢化物
,
则
Y
的分子式是
SiH
4
,
其电子式为
,
加热分解可得到
Si
单质。
答案
:
(1)
氢氟酸
SiO
2
+4Mg 2MgO+Mg
2
Si
(2)Mg
2
Si+4HCl====2MgCl
2
+SiH
4
△
====
6.
下列各单质和化合物之间有以下转化关系
,
而且各单质和化合物组成的元素皆为
1
~
18
号元素。
根据上述关系判断
:
(1)
单质
A
是
________(
填名称
)
。
(2)
各化合物的化学式
:
甲
_______,
乙
______,
丙
_______,
丁
________
。
(3)
单质
A
和
NaOH
溶液反应的离子方程式为
________
______________
。
(4)
化合物乙与过量盐酸反应的离子方程式为
______
______________
。
【
解题指南
】
解答本题需注意以下两点
:
(1)
注意突破口
:
单质
A
能与
NaOH
溶液反应生成
H
2
,A
形成化合物甲也能与
NaOH
反应且生成
2
种化合物
,
可推知
A
为
Al
或
Si
。
(2)
乙与过量盐酸反应生成丁
,
丁分解生成甲和丙
,
则乙只能是
Na
2
SiO
3
。
【
解析
】
解题的突破口是
1
~
18
号元素的单质
A
与
NaOH
溶液反应生成氢气
C,
此元素可能是
Al
或
Si,
而产生的化
合物乙与过量盐酸反应生成的化合物丁能失去化合物
丙生成化合物甲
,
则进一步推断出
A
单质只能是
Si
。又
由于单质
A
和化合物甲都能跟
NaOH
溶液反应
,
都生成化
合物乙
(Na
2
SiO
3
),
只不过
A
的另一种产物是氢气
,
而
化合物甲的另一种产物为化合物丙
,
丙又可通过氢气与单质
B
反应生成
,
故单质
B
为
O
2
,
甲为
SiO
2
,
乙为
Na
2
SiO
3
,
丙为
H
2
O,
丁为
H
2
SiO
3
。
答案
:
(1)
硅
(2)SiO
2
Na
2
SiO
3
H
2
O
H
2
SiO
3
(3)Si+2OH
-
+H
2
O==== +2H
2
↑
(4) +2H
+
====H
2
SiO
3
↓
【
归纳总结
】
制备高纯硅涉及的知识
(1)
高温下用碳还原二氧化硅制得粗硅
:
SiO
2
+2C Si(
粗
)+2CO↑
(2)
粗硅与干燥
HCl
气体反应制得
SiHCl
3
:
Si(
粗
)+3HCl SiHCl
3
+H
2
高温
====
高温
====
(3)
粗硅与干燥
Cl
2
反应制得
SiCl
4
:
Si(
粗
)+2Cl
2
SiCl
4
(4)SiHCl
3
与过量
H
2
在高温下反应制得纯硅
:
SiHCl
3
+H
2
Si(
纯
)+3HCl
高温
====
高温
====
(5)SiCl
4
与过量
H
2
在高温下反应制得纯硅
:
SiCl
4
+2H
2
Si(
纯
)+4HCl
(6)
高温下用金属镁还原二氧化硅制得粗硅
:
SiO
2
+2Mg 2MgO+Si
高温
====
高温
====
(7)SiHCl
3
、
SiCl
4
能与水发生反应
:
SiHCl
3
+3H
2
O====H
2
SiO
3
↓+3HCl+H
2
↑
SiCl
4
+3H
2
O====H
2
SiO
3
↓+4HCl
(8)SiH
4
在空气中易自燃
:
SiH
4
+2O
2
====SiO
2
+2H
2
O
考点
2:
硅酸、硅酸盐和无机非金属材料
一、硅酸、硅酸盐
1.
硅酸的性质、制备与应用
(a
、
b)
2.
硅酸盐
(a)
(1)
概念
:
由
_______
和金属组成的化合物的总称
,
是构成
地壳岩石的主要成分。
(2)
表示方法
:
硅酸盐矿物的成分复杂
,
常用氧化物的形
式表示它们的组成
,
如硅酸钠
(Na
2
SiO
3
)
写成
__________,
钾云母
(KH
2
Al
3
Si
3
O
12
)
写成
_______________________
。
硅、氧
Na
2
O·SiO
2
K
2
O·3Al
2
O
3
·6SiO
2
·2H
2
O
(3)
硅酸钠
(Na
2
SiO
3
)——
又称泡花碱。
①白色、可溶于水的粉末状固体
,
其水溶液俗称
_______,
有黏性
,
水溶液显
___
性。
②与较强的酸反应生成硅酸
:
如
Na
2
SiO
3
溶液与稀硫酸反
应
:______________________________;
与
CO
2
水溶液反
应
:________________________________
。
水玻璃
碱
Na
2
SiO
3
+H
2
SO
4
====H
2
SiO
3
↓+Na
2
SO
4
Na
2
SiO
3
+CO
2
+H
2
O====H
2
SiO
3
↓+Na
2
CO
3
③
用途
:
黏合剂、耐火阻燃材料。
二、传统无机非金属材料
(a)
玻璃
水泥
陶瓷
主要
原料
纯碱、石灰石、石英
石灰石、黏土
黏土
设备
玻璃熔炉
水泥回转窑
陶瓷窑
玻璃
水泥
陶瓷
生产过程中的主要变化
SiO
2
+Na
2
CO
3
Na
2
SiO
3
+CO
2
↑,
CaCO
3
+SiO
2
CaSiO
3
+CO
2
↑
复杂的物理、化学变化
复杂的物理、化学变化
主要成分
Na
2
SiO
3
,
CaSiO
3
,SiO
2
3CaO·SiO
2
、
2CaO·SiO
2
、
CaO·Al
2
O
3
高温
====
高温
====
三、新型无机非金属材料
(a)
材料类别
主要特性
示例
用途
高温结构陶瓷
能承受高温
,
强度高
氮化硅陶瓷
汽轮机叶片、轴承、永久性模具等
半导体
陶瓷
具有电学特性
二氧化锡
陶瓷
集成电路中的半导体
材料类别
主要特性
示例
用途
光学材料
具有光学特性
光导纤维
光缆通讯、医疗、照明等
生物陶瓷
具有生物功能
氧化铝陶瓷
人造骨骼、人造关节、接骨螺钉
【
强化训练
】
1.
思维诊断
(
正确的打“√”
,
错误的打“
×”)
(1)
硅胶多孔
,
吸水能力强
,
常用作袋装食品的干燥剂和抗氧化剂
(
)
提示
:
×
。硅胶只能作干燥剂
,
不能作抗氧化剂。
(2)
用
SiO
2
制取硅酸
,
将
SiO
2
溶解在水中一段时间后可得到硅酸
(
)
提示
:
×
。
SiO
2
不溶于水也不和水反应。
(3)
硅胶是硅酸钠的水溶液失去水后形成的凝胶
(
)
提示
:
×
。硅胶是硅酸钠的水溶液与酸反应生成的。
(4)
光导纤维、碳纳米管、氮化硅结构陶瓷等都是新型无机非金属材料
(
)
提示
:
√
。
(5)
普通玻璃、石英玻璃、水泥、玛瑙都属于硅酸盐产品。
(
)
提示
:
×
。石英玻璃、玛瑙的主要成分为
SiO
2
,
不是硅酸盐产品。
(6)
水玻璃是一种特殊的玻璃。
(
)
提示
:
×
。水玻璃是硅酸钠的水溶液
,
不是玻璃。
2.
下列说法正确的是
(
)
A.
单质 氧化物 酸或碱 盐
,
硅单质可以按上
述关系进行转化
B.
若
a
、
b
、
c
分别为
Si
、
SiO
2
、
H
2
SiO
3
,
则可以通过一步反应实
现如图所示的转化关系
C.
二氧化碳和二氧化硅都可溶解在
NaOH
溶液中
D.
青花瓷胎体的原料为高岭土
[Al
2
Si
2
O
5
(OH)
4
],
若以氧化物形
式可表示为
Al
2
O
3
·SiO
2
·H
2
O
【
解析
】
选
C
。
A
项
,Si
与
O
2
反应生成
SiO
2
,SiO
2
不与
H
2
O
反
应
,“
氧化物 酸或碱”不能实现
,
错误
;B
项
, b→c,
c→a
均不能通过一步反应实现
,
错误
;C
项
,
二氧化碳和
二氧化硅都属于酸性氧化物
,
都能与
NaOH
溶液反应生成
盐和水
,
正确
;D
项
,
硅酸盐可以用盐的形式或氧化物的
形式表示
,[Al
2
Si
2
O
5
(OH)
4
]
可表示为
Al
2
O
3
·2SiO
2
·2H
2
O,
错误。
3.
有些科学家提出硅是“
21
世纪的能源”
,
下列说法正确的是
(
)
A.
晶体硅具有半导体性质
,
可用于生产光导纤维
B.
玻璃中含有的
SiO
2
可与
NaOH
溶液反应
,
故常用
NaOH
溶液雕刻玻璃纹饰
C.
陶瓷、水泥、石英玻璃都属于硅酸盐材料
D.
硅酸盐
Na
2
Fe
2
Si
3
O
9
用氧化物的形式可表示为
Na
2
O · 2FeO · 3SiO
2
【
解析
】
选
D
。
A.
晶体硅具有半导体性质
,
可用于生产电脑芯片
,
二氧化硅可用于制造光导纤维
,A
不正确
;B.
玻璃中含有的
SiO
2
可与
NaOH
溶液反应
,
但不能用
NaOH
溶液雕刻玻璃纹饰
,
因为玻璃表面是光滑的
,
该反应太慢
,B
不正确
;C.
陶瓷、水泥属于硅酸盐材料
,
石英玻璃的主要成分是二氧化硅
,C
不正确
;D.
硅酸盐
Na
2
Fe
2
Si
3
O
9
用氧化物的形式可表示为
Na
2
O · 2FeO · 3SiO
2
,D
正确。
4.
下列叙述正确的是
(
)
A.
红宝石、珍珠、水晶、钻石等装饰的主要成分都是硅酸盐
B.
硅酸钠的水溶液俗名为水玻璃
,
可用于制备硅胶和木材防火剂
C.
制造玻璃是复杂的物理过程
,
玻璃的组成不同
,
性能不同
D.
可用磨口玻璃瓶保存
NaOH
溶液
【
解析
】
选
B
。红宝石的主要成分为
Al
2
O
3
,
珍珠的主要成分为
CaCO
3
,
水晶的主要成分为
SiO
2
,
钻石为碳单质
,A
选项错误
;
制造玻璃包含复杂的物理变化和化学变化
,C
选项错误
;
玻璃的成分中含有二氧化硅
,
可与氢氧化钠溶液反应生成硅酸钠
,
会使磨口玻璃塞与瓶口粘合在一起
,D
选项错误。
5.
世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说
:“
至少在距今
3 000
年以前
,
中国就已经使用玻璃了。”下列关于普通玻璃的叙述中
,
正确的是
(
)
A.
玻璃是人类最早使用的硅酸盐材料
B.
玻璃在加热熔化时有固定的熔点
C.
制普通玻璃的原料主要是纯碱、石灰石和石英
D.
普通玻璃的成分主要是
Na
2
O
、
CaO
和
SiO
2
【
解析
】
选
C
。我国古代就开始使用陶瓷制品
,
玻璃的出现要晚很多
,A
错误
;
玻璃无固定的熔点
,B
错误
;
制普通玻璃的原料主要是纯碱、石灰石和石英
,C
正确
;
普通玻璃的成分主要是
Na
2
SiO
3
、
CaSiO
3
和
SiO
2
,D
错误。
6.A
、
B
、
C
、
D
、
E
五种物质中均含有同一种非金属元素
,
它们能发生如图所示的转化关系
,
该元素
(
用
R
表示
)
的单质能与
NaOH
溶液反应生成盐
(Na
2
RO
3
)
和氢气。
请回答下列问题
:
世纪金榜导学号
(1)
写出各物质的化学式
:A________;B________;
C________;D________;E________
。
(2)
写出反应①的化学方程式
:_________________,
该反应中氧化剂与还原剂的物质的量之比为
__________________
。
(3)
写出反应④的离子方程式
:____________
。
(4)
写出反应⑤的离子方程式
:____________
。
(5)H
2
CO
3
的酸性强于
E,
请用离子方程式予以证明
:
___________________________
。
【
解析
】
非金属元素
R
的单质能与
NaOH
溶液反应生成盐
(Na
2
RO
3
)
和氢气
,
说明是硅及其化合物之间的转化。
A
在高温条件下
,
能与焦炭、
CaCO
3
发生反应
,
则
A
为
SiO
2
。从而推知
B
为
CaSiO
3
,D
为
Si,E
为
H
2
SiO
3
。
答案
:
(1)SiO
2
CaSiO
3
Na
2
SiO
3
Si
H
2
SiO
3
(2)SiO
2
+2C Si+2CO↑
1
∶
2
(3)Si+2OH
-
+H
2
O==== +2H
2
↑
(4) +Ca
2+
====CaSiO
3
↓
(5) +CO
2
+H
2
O====H
2
SiO
3
↓+
高温
====
【
归纳总结
】
1.
硅及其化合物的转化关系
2.
硅酸盐改成氧化物形式的方法
(1)
氧化物的书写顺序
:
活泼金属氧化物→较活泼金属氧化物→二氧化硅→水
,
不同氧化物之间以“
·
”
隔开。
(2)
各元素的化合价保持不变
,
且满足化合价代数和为零
,
各元素原子个数比符合原来的组成。
(3)
当计量数配置出现分数时应化为整数。如钾长石
:
KAlSi
3
O
8
不能写成
K
2
O
·
Al
2
O
3
·
3SiO
2
,
应写成
K
2
O
·
Al
2
O
3
·
6SiO
2
。
相关文档
- 2019届二轮复习非金属及其化合物学2021-07-0215页
- 全国通用2021高考化学一轮复习第四2021-07-026页
- 金属、非金属及其化合物化学方程式2021-05-144页
- 高考化学试题分类汇编——非金属及2021-05-1413页
- 高考化学二轮复习收尾练非金属及其2021-05-148页
- 金新学案高考化学大二轮复习专题突2021-05-149页
- 2020版高考化学大一轮复习专题4非2021-05-1418页
- 0912高考化学分类汇编非金属及其化2021-05-1411页
- 备考2020高考化学第一轮复习 第4章2021-05-146页
- 高考化学非金属及其化合物知识点练2021-05-1418页