- 424.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
元素周期表 元素周期律
1.如图中横坐标均表示11~17号元素顺序排列的原子序数。根据图象变化趋势判断,纵坐标表示其最高化合价的是 ( )
【解析】选C。11~17号元素,随原子序数的递增,最高化合价从+1→+7。
【加固训练】
核反应不仅能发电也能制造元素。2016年初国际上确认,利用原子核间的撞击已制造出原子序数分别为113、115、117和118四种新元素,填补了目前元素周期表的空白,其中113号元素与Al元素处于同一主族。下列说法中正确的是
( )
A.核反应发电实现了化学能到电能的转化
B.115号元素一定是处于ⅤA族的非金属元素
C.117号元素与F、Cl、Br、I均处于ⅦA族
D.四种新元素位于元素周期表中的不同周期
【解析】选C。 A项,核反应发电是将核能转化为电能。B项,115号元素是位于ⅤA族的金属元素。D项,四种新元素均位于第7周期。
2.物理学家根据原子核结构理论计算,人工合成的元素将会完成元素周期表的第七周期(零族元素的原子序数应为118),并进入第八周期,甚至第九周期。若第八周期元素种类是第五、六周期元素种类之和,依照已有的规律,可以推知第九周期将有元素种类的数目是 ( )
A.32 B.50 C.64 D.82
【解析】选B。人工合成的元素完成元素周期表的第七周期(零族元素的原子序数应为118)后,1至7周期的元素种类分别为2、8、8、18、18、32、32,依照已有的规律,第八周期和第九周期元素种类相同,第八周期元素种类是第五、六周期元素种类之和,可以推知第九周期将有元素种类的数目是50。
3.(2018·浙江11月选考真题)元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q
12
位于第四周期,X、Y、Z原子的最外层电子数之和为17,下列说法不正确的是 ( )
X
Y
Z
Q
A.原子半径(r):r(Q)>r(Y)>r(Z)
B.元素X有-4、+2、+4等多种价态
C.Y、Z的氧化物对应的水化物均为强酸
D.可以推测H3QO4是Q的最高价氧化物的水化物
【解析】选C。设X原子的最外层电子数为x,则Y、Z原子的最外层电子数分别为x+2、x+3,根据X、Y、Z原子的最外层电子数之和为17,得x+x+2+x+3=17,x=4,且由位置关系可知Y位于第3周期,即Y为硫元素,则X、Z和Q分别是碳、氯、砷元素。同一主族从上到下,原子半径逐渐增大,同一周期从左到右,原子半径逐渐减小,可得原子半径(r):r(砷)>r(硫)>r(氯),A正确;碳元素有-4、+2、+4等多种价态,B正确;SO2对应的H2SO3不是强酸,C错误;H3QO4中的Q是+5价,H3QO4是砷元素的最高价氧化物的水化物,D正确。
4.现有X、Y、Z、W是短周期主族元素,X原子最外层电子数是其内层电子数的3倍;Y的原子序数是其最外层电子数的6倍;Z的一种单质是自然界中最硬的物质;自然界中,W的单质多出现在火山口附近,且为淡黄色晶体。下列叙述正确的是
( )
A.原子半径的大小:Z>X>Y
B.Z的氢化物的沸点一定比X的低
C.W的最高价氧化物对应水化物的酸性在同主族中最强
D.Y与X形成的化合物与Z单质反应可冶炼金属
【解析】选C。根据题中信息推断元素,X原子最外层电子数是其内层电子数的3倍,X为O,Y的原子序数是其最外层电子数的6倍,Y为Mg,Z的一种单质是自然界中最硬的物质,Z为C,W的单质多出现在火山口附近,且为淡黄色晶体,W为S。A项,电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径的大小:Mg>C>O,故A错误;B项,C的氢化物可能为固态烃,其的沸点可能比H2O高,故B错误;C项,W的最高价氧化物对应水化物为硫酸,其酸性在同主族中最强,故C正确;D项,MgO和C不能反应,故D错误。
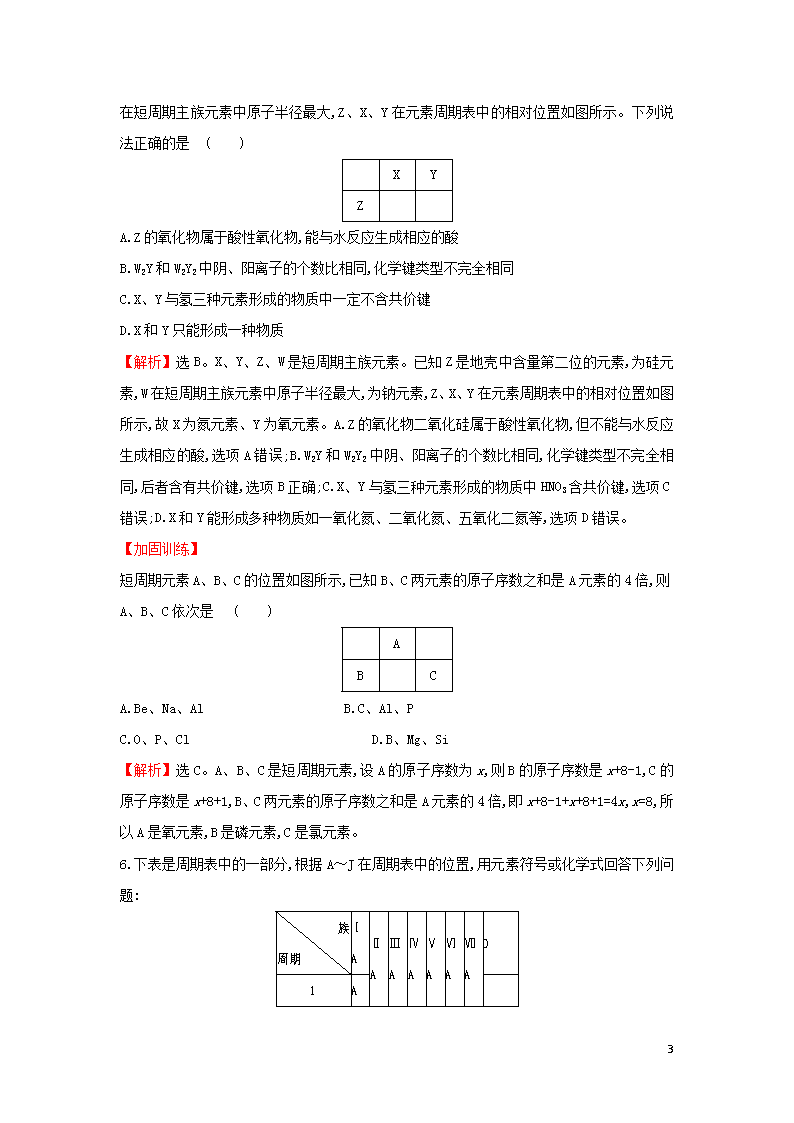
5.(2020·延安模拟)X、Y、Z、W是短周期主族元素。已知Z是地壳中含量第二位的元素,W
12
在短周期主族元素中原子半径最大,Z、X、Y在元素周期表中的相对位置如图所示。下列说法正确的是 ( )
X
Y
Z
A.Z的氧化物属于酸性氧化物,能与水反应生成相应的酸
B.W2Y和W2Y2中阴、阳离子的个数比相同,化学键类型不完全相同
C.X、Y与氢三种元素形成的物质中一定不含共价键
D.X和Y只能形成一种物质
【解析】选B。X、Y、Z、W是短周期主族元素。已知Z是地壳中含量第二位的元素,为硅元素,W在短周期主族元素中原子半径最大,为钠元素,Z、X、Y在元素周期表中的相对位置如图所示,故X为氮元素、Y为氧元素。A.Z的氧化物二氧化硅属于酸性氧化物,但不能与水反应生成相应的酸,选项A错误;B.W2Y和W2Y2中阴、阳离子的个数比相同,化学键类型不完全相同,后者含有共价键,选项B正确;C.X、Y与氢三种元素形成的物质中HNO3含共价键,选项C错误;D.X和Y能形成多种物质如一氧化氮、二氧化氮、五氧化二氮等,选项D错误。
【加固训练】
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是 ( )
A
B
C
A.Be、Na、Al B.C、Al、P
C.O、P、Cl D.B、Mg、Si
【解析】选C。A、B、C是短周期元素,设A的原子序数为x,则B的原子序数是x+8-1,C的原子序数是x+8+1,B、C两元素的原子序数之和是A元素的4倍,即x+8-1+x+8+1=4x,x=8,所以A是氧元素,B是磷元素,C是氯元素。
6.下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
A
12
2
D
E
G
3
B
C
J
F
H
I
(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的是________, 可用于制半导体材料的元素是________。
(2)最高价氧化物的水化物碱性最强的是___________________________,
酸性最强的是________,呈两性的是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是__________。
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是_____________。
【解析】根据题意可知,A、B、C、D、E、F、G、H、I、J 分别为H、Na、Al、C、N、P、F、Cl、Ar、Si。
(1)表中元素,化学性质最不活泼的是Ar,只有负价而无正价的是F, 可用于制半导体材料的元素是Si。
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是HF。
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是Na。
答案:(1)Ar F Si
(2)NaOH HClO4 Al(OH)3
(3)HF (4)Na
1.第3周期元素,浓度均为0.01 mol·L-1的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是 ( )
A.气态氢化物的稳定性:M>W
B.M的最高正价为+3
12
C.Y和W形成的化合物既含离子键又含共价键
D.X和Z两者最高价氧化物对应的水化物反应后溶液的pH>7
【解析】选D。由图象知,X、Y、Z、M、N、W分别是Na、Mg、Si、P、S、Cl元素。稳定性HCl>PH3,磷元素的最高正价为+5,MgCl2只含离子键,A、B、C均错误;Na2SiO3溶液中,因Si水解溶液呈碱性,pH>7,正确。
2.短周期主族元素X、Y、Z、W的原子序数依次减小。A、B、C、D是由上述元素依次组成的非金属单质,其中B、C、D在常温常压下是气体。E是形成酸雨的污染物之一,F可以使湿润的红色石蕊试纸变蓝。上述物质的转化关系如图所示。下列说法正确的是 ( )
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.元素Y的简单气态氢化物的热稳定性比Z的弱
C.由Y、Z、W三种元素形成的化合物的水溶液可能呈碱性
D.X和Z的氧化物的水化物均为强酸
【解析】选C。E是形成酸雨的污染物之一,由A与气体B生成,则A为S,B为O2,E为SO2,F可以使湿润的红色石蕊试纸变蓝,即F为NH3,则C为N2,D为H2。X、Y、Z、W四种元素依次为S、O、N、H。A.原子半径大小顺序:r(W)>r(Y)>r(Z)>r(X),错误;B.H2O的稳定性强于NH3,错误;C.NH3·H2O的水溶液呈碱性,正确;D.S和N的最高价氧化物的水化物均为强酸,亚硫酸、亚硝酸都不是强酸,错误。
【加固训练】
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是 ( )
A.金属性:Y>Z
B.氢化物的稳定性:X>W
C.离子的还原性:X>W
D.最高价氧化物对应水化物碱性:Y>Z
【解析】选B。根据题设条件推知W为氯元素,X与W同主族,且均为短周期元素,所以X为氟元素。Y的原子序数是W和X的原子序数之和的一半,即Y的原子序数为13,Y
12
为铝元素。含Z元素的物质焰色反应为黄色,则Z为钠元素。A选项,Al、Na 同周期,根据同周期元素递变规律,Na的金属性大于Al。B选项,F的非金属性比Cl的非金属性强,HF的稳定性高于HCl。选项C,Cl-的还原性大于F-。D选项,Y、Z最高价氧化物对应水化物分别为Al(OH)3、NaOH,所以碱性强弱为Al(OH)3r(C)>r(B)
【解析】选C。0.1 mol·L-1 丁溶液的pH为13(25 ℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有氢、氧、钠元素,辛是由C组成的单质,由反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素,A.A为H、B为碳元素,碳氢形成的化合物烃中有气态、液态、固态,选项A错误;B.戊是碳酸钠,在碳酸钠溶液中,C水解生成HC和OH-,溶液中阴离子总的物质的量大于0.1 mol,选项B错误;C.甲与足量的乙完全反应的方程式为2Na2O2+2H2O4NaOH+O2↑,1 mol Na2O2反应转移的电子为1 mol,约6.02×1023个电子,选项C正确;D.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径大小顺序为Na>C>O,即:D>B>C,选项D错误。
5.(新题预测)短周期元素W、X、Y、Z的原子序数依次增大,由它们组成的化合物YZWX的水溶液因为遇Fe3+变血红色可用于检验Fe3+,若已知灼烧该化合物的焰色为黄色。下列推断正确的是 ( )
A.简单氢化物的熔沸点:W>X
B.原子半径和离子半径均满足:XW
D.常温下,pH为12的Y2Z溶液中水电离的c(H+)为10-12 mol·L-1
【解析】选C。化合物YZWX的水溶液因为遇Fe3+变血红色,所以YZWX是硫氰酸盐,灼烧该化合物的焰色为黄色,YZWX是硫氰酸钠,W、X、Y、Z的原子序数依次增大,W、X、Y、Z分别是C、N、Na、S;熔沸点NH3>CH4,故A错误;原子半径NNa+,故B错误;最高价氧化物对应的水化物的酸性:H2SO4>H2CO3,故C正确;Na2S水解促进水电离,常温下,pH为12的Y2Z溶液中水电离的c(H+)为
10-2 mol·L-1,故D错误。
【加固训练】
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知四种元素的电子层数之和为10,且它们分别属于连续的四个主族。四种元素中X原子的半径最大。下列说法正确的是 ( )
A.四种元素中有两种元素在第二周期
B.W所在主族元素的原子次外层电子数可能为2或8,不可能为18
12
C.X、Y、Z的最高价氧化物对应的水化物两两之间能反应
D.工业上获得X、Y单质的方法主要是电解其熔融的氯化物
【解析】选B。由四种原子序数依次增大的短周期元素W、X、Y、Z的电子层之和为10,可推断W、X在第二周期Y、Z在第三周期或W在第一周期,X、Y、Z在第三周期;由四种元素分别属于连续四个主族,原子半径最大的是X原子可知,W在第一周期,X、Y、Z在第三周期、综上所述,W为H,X为Mg,Y为Al、Z为Si。四种元素中没有元素在第二周期,A项错误;H为第ⅠA族元素,第ⅠA族元素中锂原子的次外层电子数为2,除H、Li外的其他元素原子的次外层电子数为8,不可能为18,B项正确;Mg、Al、Si的最高价氧化物对应的水化物分别为Mg(OH)2、Al(OH)3、H2SiO3,Al(OH)3与Mg(OH)2、H2SiO3不能反应,C项错误;工业上通过电解熔融的氧化铝来获得单质铝,D项错误。
6.(2019·梅州模拟)X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是 ( )
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
【解析】选C。由题意可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2分子,可推出X、Y、Z分别为C、N、O三种元素;再根据Y与M形成的气态化合物在标准状况下的密度,就可计算出该气态化合物的相对分子质量为17,从而确定M为H,最后根据W的质子数是X、Y、Z、M四种元素质子数之和的1/2,推出W为Na。所以,原子半径应是W>X>Y>Z>M(即Na>C>N>O>H),A选项错。B选项中CO2、C2H2均为直线形共价化合物,而Na2O2是离子化合物,B错误。C选项是正确的,例如石墨、C60、碳纳米管、石墨烯等碳单质就不是原子晶体。D选项中,X、Y、Z、M四种元素可形成化合物CO(NH2)2(尿素)等,尿素为共价化合物,只含共价键,所以D错。
7.下图为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
12
(1)⑤⑥⑦的离子半径由大到小的顺序为______(填离子符号)。
(2)⑧⑨⑩的最高价含氧酸的酸性由强到弱为________(用化学式表示)。
(3)写出⑥在空气中加热生成的产物的电子式:______________________。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式: _______________________________。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,请写出它在碱性溶液中的电离方程式: _____________________________________________。
(5)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:
_________________________________________。
(6)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为________________。
②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为____________。
【解析】(1)⑤号元素是F,⑥号元素是Na,⑦号元素是Al,它们的离子电子层结构相同。对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小,所以离子半径由大到小的顺序为F->Na+>Al3+。
(2)⑧⑨⑩三种元素分别是P、S、Cl。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。由于元素的非金属性:Cl>S>P,所以最高价含氧酸的酸性由强到弱为HClO4>H2SO4>H3PO4。
12
(3)⑥号元素Na在空气中燃烧生成Na2O2,电子式是Na+]2-Na+。
(4)根据物质的性质及相互转化关系可知:A是NaCl;B是Cl2;C是H2;D是NaOH;G是Al;F是NaAlO2。①D溶液与G反应的化学方程式是2Al+2NaOH+2H2O2NaAlO2+3H2↑;②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,则这种物质是Al(OH)3,它在碱性溶液中的电离方程式是Al(OH)3Al+H++H2O。
(5)根据元素在周期表中的位置可知元素②是Be,元素②的氢氧化物与NaOH溶液反应的离子方程式是Be(OH)2+2OH-Be+2H2O。
(6)①33号元素As的原子结构示意图为;②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂,则该物质是NaClO。As可与Y的水溶液反应,产物有As的最高价含氧酸,根据得失电子守恒及原子守恒可得该反应的化学方程式为5NaClO+2As+3H2O2H3AsO4+5NaCl。
答案:(1)F->Na+>Al3+
(2)HClO4>H2SO4>H3PO4
(3)Na+]2-Na+
(4)①2Al+2NaOH+2H2O
2NaAlO2+3H2↑
②Al(OH)3Al+H++H2O
(5)Be(OH)2+2OH-Be+2H2O
(6)①
②5NaClO+2As+3H2O2H3AsO4+5NaCl
【加固训练】
(2019·邯郸模拟)A、B、C、D、E、F六种短周期元素在元素周期表中的位置如图所示。
12
回答下列问题:
(1)在周期表中,E位于第______周期第______族。
(2)A、B能组成既含极性键又含非极性键的化合物,其电子式为________________。
(3)在E、F的气态氢化物中,热稳定性较强的是______(填化学式,下同),还原性较强的是________。
(4)A、C、D、E组成两种酸式盐X、Y,将X、Y溶液混合发生复分解反应,写出离子方程式:____________________________________。
(5)常用(BA4)2E2C8检验废水中的Mn2+,若观察到无色溶液变紫红色,可判断废水中含Mn2+,还原产物与盐酸酸化的BaCl2溶液混合产生白色沉淀。写出无色溶液变紫红色溶液的离子方程式: _______________________________。
【解析】由图可知,A、B、C、D、E、F分别为H、N、O、Na、S、Cl。
(1)在元素周期表中,E位于第三周期第ⅥA族。
(2)A、B能组成既含极性键又含非极性键的化合物为N2H4,其电子式为H。
(3)S、Cl的非金属性相比,S