- 209.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
选择题标准练(五)
满分:42分
每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学是你,化学是我,化学深入我们生活,下列有关说法不正确的是( B )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“青蒿一握,以水二升渍,绞取汁”,该过程对青蒿素的提取属于化学变化
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
解析:雾霾所形成的气溶胶属于胶体,有丁达尔效应,A项正确;该过程对青蒿素的提取属于物理变化,B项错误;题中描述的过程中铁与硫酸铜发生反应置换出铜,C项正确;剂钢指的是铁的合金,具有硬度大、不易断折的特点,D项正确。
2.下列有关有机物的说法正确的是( D )
A.乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色
B.1 mol 苹果酸[HOOCCH(OH)CH2COOH]可与3 mol NaHCO3发生反应
C.酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH
D.乙酸和油脂都能与氢氧化钠溶液反应
解析:聚乙烯的结构简式为CH2—CH2,不含碳碳双键,因此不能使酸性高锰酸钾溶液褪色,A项错误;1 mol 苹果酸含有2 mol —COOH,1 mol —OH,—OH与NaHCO3不反应,故1 mol 苹果酸可与2 mol NaHCO3反应,B项错误;酸性条件下C2H5CO18 OC2H5的水解产物为C2H5COOH、H18OC2H5,C项错误;乙酸含有羧基,油脂含有酯基,羧基、酯基都能与NaOH溶液反应,D项正确。
3.下列实验操作能达到实验目的的是( B )
选项
实验目的
实验操作
A
配制100 mL浓度为0.10 mol·L-1的KMnO4溶液
称取KMnO4固体1.58 g,放入100 mL容量瓶中,加水溶解并稀释至刻度线处
B
用废蚀刻液(含FeCl2、FeCl3、CuCl2、HCl)制备FeCl2溶液
向废蚀刻液中加入过量铁粉、充分搅拌、过滤
C
检验木炭与浓硫酸反应的气态产物中含SO2和CO2
将产生的气体依次通过澄清石灰水和品红溶液
D
检验乙醇中羟基氢的活泼性
将金属钠投入到盛有医用酒精的烧杯中
解析:配制一定物质的量浓度的溶液时,不能在容量瓶中进行溶解操作,故A错误;加入铁粉后,溶液中的FeCl3、CuCl2、HCl均可与铁粉反应生成FeCl2,故B正确;SO2和CO2均可使澄清石灰水变浑浊,不能用澄清石灰水区分SO2和CO2,故C错误;常用的医用酒精为75%的乙醇水溶液,水也能与钠反应,故不能用其检验乙醇中羟基氢的活泼性,D错误。
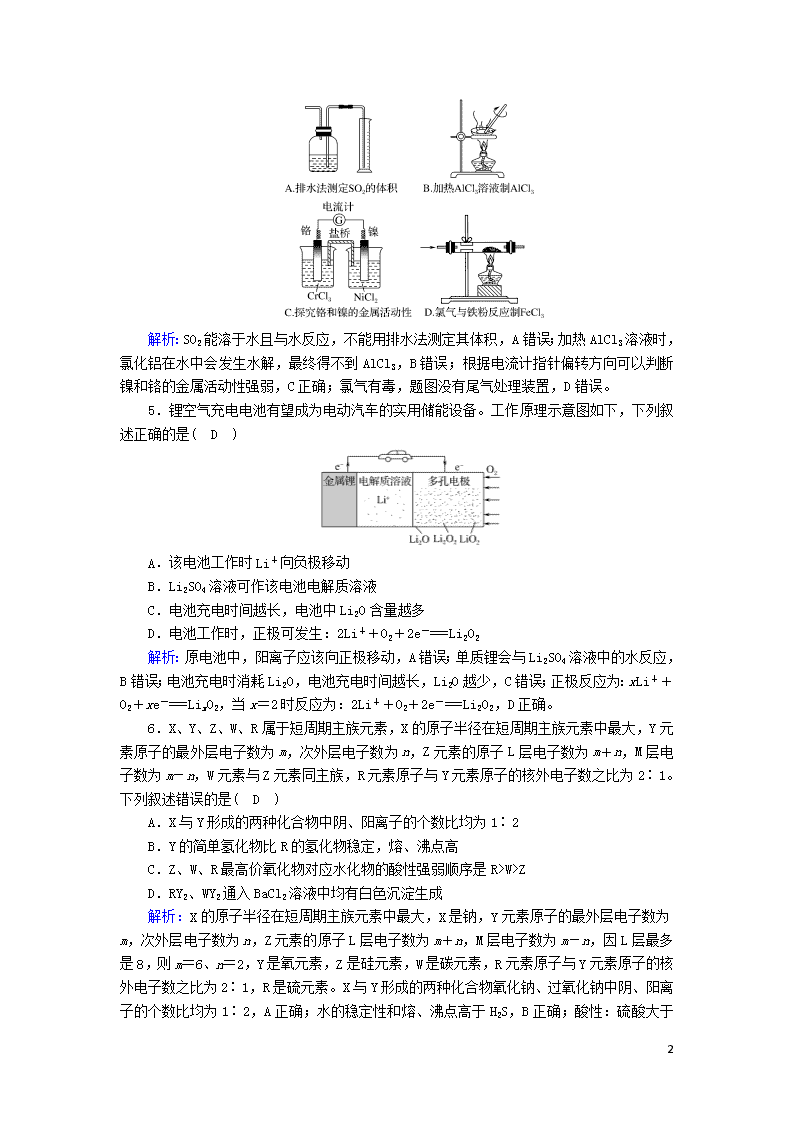
4.下列实验能达到实验目的而且符合实验设计要求的是( C )
3
解析:SO2能溶于水且与水反应,不能用排水法测定其体积,A错误;加热AlCl3溶液时,氯化铝在水中会发生水解,最终得不到AlCl3,B错误;根据电流计指针偏转方向可以判断镍和铬的金属活动性强弱,C正确;氯气有毒,题图没有尾气处理装置,D错误。
5.锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是( D )
A.该电池工作时Li+向负极移动
B.Li2SO4溶液可作该电池电解质溶液
C.电池充电时间越长,电池中Li2O含量越多
D.电池工作时,正极可发生:2Li++O2+2e-===Li2O2
解析:原电池中,阳离子应该向正极移动,A错误;单质锂会与Li2SO4溶液中的水反应,B错误;电池充电时消耗Li2O,电池充电时间越长,Li2O越少,C错误;正极反应为:xLi++O2+xe-===LixO2,当x=2时反应为:2Li++O2+2e-===Li2O2,D正确。
6.X、Y、Z、W、R属于短周期主族元素,X的原子半径在短周期主族元素中最大,Y元素原子的最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述错误的是( D )
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的简单氢化物比R的氢化物稳定,熔、沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是R>W>Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成
解析:X的原子半径在短周期主族元素中最大,X是钠,Y元素原子的最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因L层最多是8,则m=6、n=2,Y是氧元素,Z是硅元素,W是碳元素,R元素原子与Y元素原子的核外电子数之比为2∶1,R是硫元素。X与Y形成的两种化合物氧化钠、过氧化钠中阴、阳离子的个数比均为1∶2,A正确;水的稳定性和熔、沸点高于H2
3
S,B正确;酸性:硫酸大于碳酸大于硅酸,C正确;CO2、SO2与BaCl2溶液不反应,D错误。
7.浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积为V,溶液的pH随lg的变化如图所示,下列叙述错误的是( D )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则增大
解析:由图可以看出ROH为弱碱,A项正确;弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则b的电离程度大于a,B项正确;若两种溶液无限稀释,最终其溶液中氢氧根离子浓度接近纯水中氢氧根离子浓度,所以它们的氢氧根离子浓度相同,C项正确;根据A知,碱性MOH>ROH,当lg=2时,由于ROH是弱电解质,升温促进其电离,所以c(M+)/c(R+)减小,D项错误。
3
相关文档
- 浙江省2020高考物理二轮复习非选择2021-06-028页
- 浙江省2020高考物理二轮复习非选择2021-06-028页
- 浙江省2020高考物理二轮复习非选择2021-06-018页
- 浙江省2020高考物理二轮复习非选择2021-05-257页
- 浙江省2020高考物理二轮复习非选择2021-05-237页
- 浙江省2020高考物理二轮复习非选择2021-05-238页
- 2020版高考生物二轮复习 第二部分 2021-05-146页
- 高考地理二轮复习选择题标准练九2021-05-144页
- 2020版高考生物二轮复习 非选择题2021-05-144页
- 2020版高考生物二轮复习 非选择题2021-05-144页