- 843.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1课时 分子晶体
记一记
探一探
一、分子晶体及其判断
1.非金属氢化物都属于分子晶体吗?非金属单质和非金属氧化物都属于分子晶体吗?
[提示] 非金属氢化物都属于分子晶体。但是非金属单质和非金属氧化物不都属于分子晶体,如C、Si、B、SiO2等属于原子晶体。
2.对于FeCl3属于离子晶体还是分子晶体,某化学兴趣小组有两种看法,一种认为是由金属与非金属形成的物质,所以是离子晶体,一种认为从电负性角度,应该是分子晶体。你能设计一个简单实验判断出FeCl3属于哪种晶体吗?
[提示] 分子晶体与离子晶体显著的差别是是否存在离子,而自由移动的离子可以导电。所以设计的实验为:将氯化铁熔化,做导电性实验,若导电为离子晶体,否则为分子晶体。
二、常见分子晶体及性质
1.二氧化碳、二硫化碳与水均为分子晶体,为何二硫化碳熔、沸点比二氧化碳高?为何水的熔沸点比二氧化碳高?
[提示] 二氧化碳、二硫化碳晶体中只存在范德华力,而范德华力主要与相对分子质量大小有关;而冰晶体中水分子间还存在氢键,所以熔沸点比二氧化碳高。
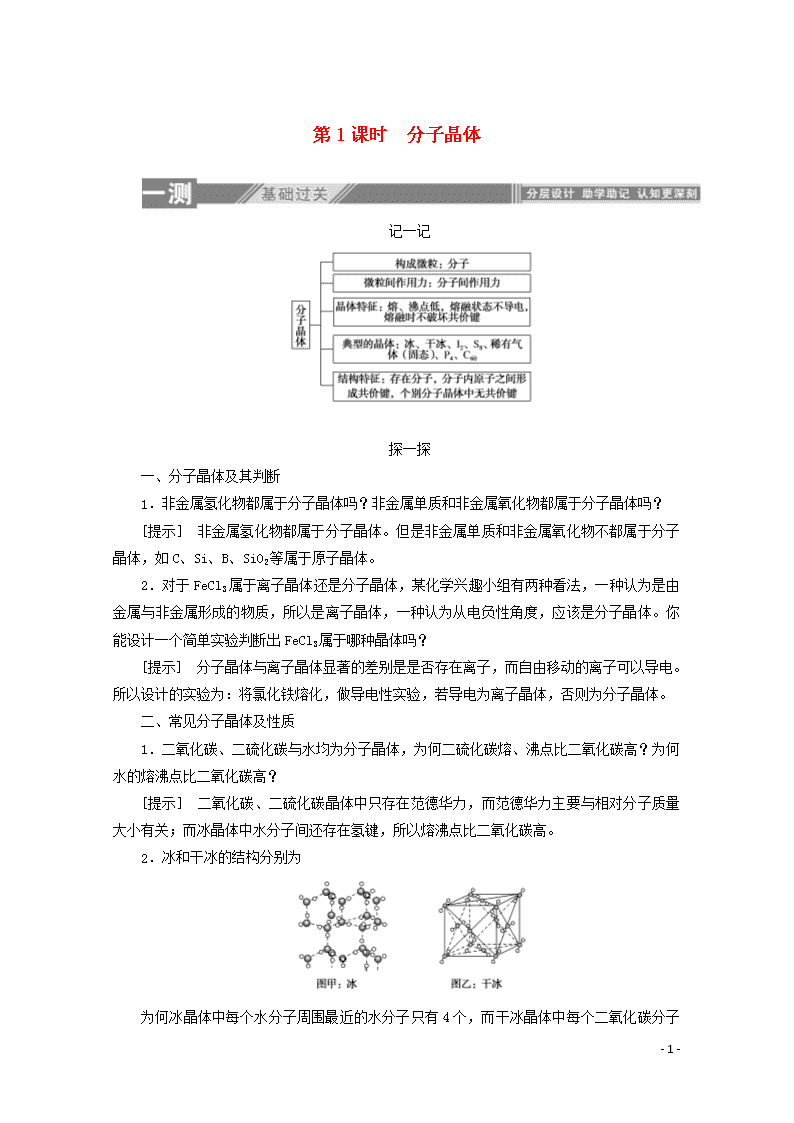
2.冰和干冰的结构分别为
- 14 -
为何冰晶体中每个水分子周围最近的水分子只有4个,而干冰晶体中每个二氧化碳分子周围最近的二氧化碳分子有12个?
[提示] 分子晶体中如果分子间只存在范德华力,则一般采用分子密堆积方式。但是如果分子间存在氢键,因为氢键有方向性,所以每个分子周围最近的分子数目小于12。
判一判
判断正误(正确的打“√”,错误的打“×”)。
(1)分子晶体中,一定存在共价键和分子间作用力。(×)
(2)酸性氧化物都属于分子晶体。(×)
(3)分子晶体熔化时一定会破坏范德华力,有些分子晶体还会破坏氢键。(√)
(4)有些分子晶体的水溶液能导电。(√)
(5)分子晶体的熔、沸点越高,分子晶体中共价键的键能越大。(×)
(6)因水分子间存在着比分子间作用力更强的作用力——氢键,故水分子较稳定。(×)
(7)沸点:H2O>H2S>H2Se。(×)
(8)分子晶体一定全部由非金属元素形成。(×)
(9)分子晶体都采用分子密堆积,每个分子周围通常有12个紧邻的分子。(×)
(10)水在4 ℃时密度最大,是因为此时水分子间形成的氢键最多。(×)
练一练
1.下列物质呈固态时,一定属于分子晶体的是( )
A.非金属单质 B.非金属氧化物
C.含氧酸 D.金属氧化物
解析:非金属单质中的金刚石、非金属氧化物中的SiO2为原子晶体。
答案:C
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、P4、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、H2O、Na2O2
解析:A中,P4(白磷)为单质,不是化合物;C中,SiO2为原子晶体;D中,Na2O2是金属氧化物,不是分子晶体。
答案:B
3.下列有关分子晶体的说法中一定正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
- 14 -
D.其结构一定为分子密堆积
解析:稀有气体元素组成的分子晶体中,不存在由多个原子组成的分子,而是原子间通过范德华力结合成晶体,所以不存在任何化学键,A项错误;分子间作用力包括范德华力和氢键,范德华力存在于所有的分子晶体中,而氢键只存在于含有与电负性较强的N、O、F原子结合的氢原子的分子之间或者分子之内,B项正确、C项错误;只存在范德华力的分子晶体才采取分子密堆积的方式,D项错误。
答案:B
4.SiCl4的分子结构与CCl4相似,对其进行的下列推测不正确的是( )
A.SiCl4晶体是分子晶体
B.常温、常压下SiCl4是气体
C.SiCl4的分子是由极性键形成的非极性分子
D.SiCl4中心原子杂化方式为sp3
解析:由于SiCl4具有分子结构,所以一定属于分子晶体;影响分子晶体熔、沸点的因素是分子间作用力的大小,在这两种分子中都只有范德华力,SiCl4的相对分子质量大于CCl4,所以SiCl4的分子间作用力更大一些,熔、沸点更高一些;CCl4的分子是正四面体结构,SiCl4与它结构相似,因此也应该是正四面体结构,是含极性键的非极性分子。
答案:B
知识点一 分子晶体及其判断
1.某化学兴趣小组,在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
NaCl
MgCl2
AlCl3
SiCl4
CaCl2
熔点/℃
801
712
190
-68
782
沸点/℃
1 465
1 418
230
57
1 600
根据这些数据分析,属于分子晶体的是( )
A.NaCl、MgCl2、CaCl2
B.AlCl3、SiCl4
C.NaCl、CaCl2
D.全部
解析:由分子构成的晶体,分子与分子之间以分子间作用力相互作用,而分子间作用力较小,克服分子间作用力所需能量较低,故分子晶体的熔、沸点较低,表中的MgCl2、NaCl、CaCl2熔、沸点很高,很明显不属于分子晶体,AlCl3、SiCl4熔、沸点较低,应为分子晶体,B项正确,A、C、D三项错误。
- 14 -
答案:B
2.下列性质符合分子晶体特点的是( )
①熔点1 070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软,导电,密度为0.97 g·cm-3
A.①④ B.②③
C.①② D.②④
解析:分子晶体中分子之间是以分子间作用力相结合的,分子晶体具有低熔点、易升华、硬度小等性质。①熔点高,不是分子晶体的性质;④能导电,不是分子晶体的性质,该处所述是金属钠的性质,故选②③。
答案:B
知识点二 常见的分子晶体
3.下列有关冰和干冰的叙述不正确的是( )
A.干冰和冰都是由分子密堆积形成的晶体
B.冰晶体中每个水分子周围只有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中只存在范德华力不存在氢键,一个分子周围有12个紧邻的分子
解析:干冰晶体中CO2分子间作用力只是范德华力,分子采取密堆积,一个分子周围有12个紧邻的分子;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性和饱和性,故每个水分子周围只有4个紧邻的水分子,采取非密堆积的方式,空间利用率小,因而密度小。干冰熔化只需克服范德华力,冰融化需要克服范德华力和氢键,由于氢键作用力比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华。
答案:A
4.干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各有1个CO2分子,在每个CO2周围距离为a(其中a为立方体棱长)的CO2有( )
- 14 -
A.4个 B.8个 C.12个 D.6个
解析:在每个CO2周围距离为a的CO2即为每个面心上的CO2分子,共有4×3=12个。
答案:C
综合考查
5.(1)比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2________CS2
②NH3________PH3
③O3________O2
④Ne________Ar
⑤CH3CH2OH________CH3OH
⑥CO________N2
(2)已知AlCl3的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。请回答:
①AlCl3固体是________晶体。
②设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是________。
解析:
(1)各组物质均为分子晶体,根据分子晶体熔、沸点的判断规律,分子间作用力越大,相对分子质量越大,分子极性越大,则晶体的熔、沸点越高,较容易比较六组物质熔、沸点的高低。
(2)由AlCl3的熔点低以及在180 ℃时开始升华判断AlCl3晶体为分子晶体。若验证一种化合物是共价化合物还是离子化合物,可测其熔融状态下是否导电,若不导电是共价化合物,导电则是离子化合物。
答案:(1)①< ②> ③> ④< ⑤> ⑥>
(2)①分子 ②在熔融状态下,试验其是否导电,若不导电是共价化合物,若导电是离子化合物
6.(1)如图为干冰的晶体结构示意图。
通过观察分析,每个CO2分子周围紧邻等距离的CO2分子有________个,将CO2
- 14 -
分子视作质点,设晶胞边长为a pm,则紧邻的两个CO2分子的距离为________pm。
(2)在冰晶体中,水分子之间的主要作用力是________,还有________,由于其主要作用力与共价键一样具有________性,故1个水分子周围只能有________个紧邻的水分子,这些水分子位于________的顶角。这种排列方式使冰晶体中水分子的空间利用率________(填“较大”或“较小”),故冰的密度比水的密度要________(填“大”或“小”)。
解析:(1)观察并分析干冰和冰的晶体结构,可知在干冰晶体中,CO2分子排列为面心立方堆积,离顶角的CO2分子最近的是面心的分子,两者的距离为面对角线的一半,即a pm。每个CO2分子周围紧邻等距离的CO2共有12个。(2)在冰晶体中,水分子间的主要作用力是氢键,氢键具有方向性,1个水分子周围只有4个紧邻的水分子,使冰晶体中水分子的空间利用率小,密度较小。
答案:(1)12 a (2)氢键 范德华力 方向 4
四面体 较小 小
基础达标
1.支持固态氨是分子晶体的事实是( )
A.氮原子不能形成阳离子 B.铵根离子不能单独存在
C.常温下氨是气态物质 D.氨极易溶于水
解析:分子晶体的熔点和沸点一般比较低,常温下有可能是气态,而其他晶体常温下不可能是气态。注意D不能选,因为离子晶体也有可能极易溶于水。
答案:C
2.下列关于物质熔、沸点高低的比较正确的是( )
A.H2>N2>CO
B.NH3>AsH3>PH3
C.Cl2>Br2>I2
D.C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3
解析:分子晶体的熔、沸点一般随相对分子质量的增大而升高,如果相对分子质量相同,极性分子的熔沸点高于非极性分子,所以熔、沸点:H2AsH3>PH3,B项正确;相对分子质量相同的烷烃,其支链越多,熔、沸点越低,即熔、沸点:C(CH3)4<(CH3)2CHCH2CH3
相关文档
- 2020届一轮复习新课改省份专版8-42021-07-029页
- 高中化学第三章晶体结构与性质第三2021-07-029页
- 2018届一轮复习苏教版晶体结构与性2021-07-0217页
- 2020届高考化学一轮复习晶体结构与2021-07-0211页
- 高中化学选修3第3章《晶体结构与性2021-07-025页
- 2020届高考化学一轮复习晶体结构与2021-07-0221页
- 2019届一轮复习人教版晶体结构与性2021-07-0236页
- 2018届一轮复习人教版晶体结构与性2021-07-029页
- 2021高考化学人教版一轮复习规范演2021-07-0217页
- 2019-2020学年高二人教版化学选修2021-07-029页