- 1.19 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
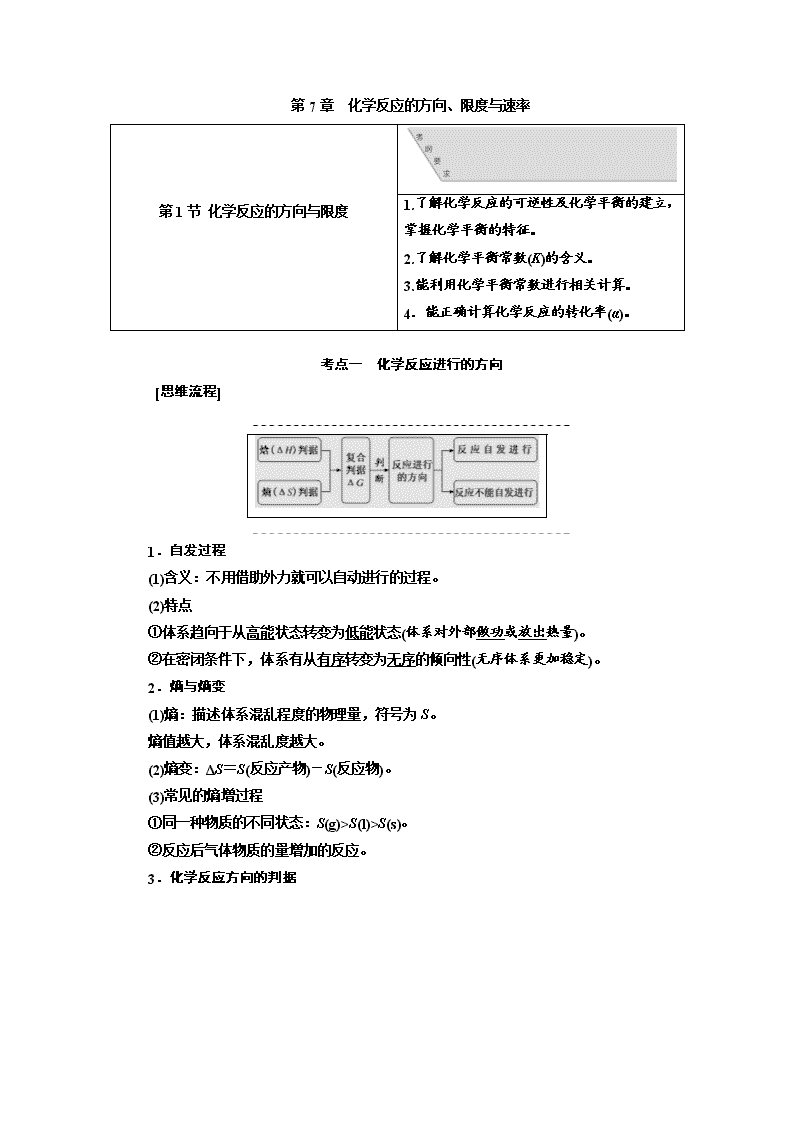
第 7 章 化学反应的方向、限度与速率
第 1 节 化学反应的方向与限度 1.了解化学反应的可逆性及化学平衡的建立,
掌握化学平衡的特征。
2.了解化学平衡常数(K)的含义。
3.能利用化学平衡常数进行相关计算。
4.能正确计算化学反应的转化率(α)。
考点一 化学反应进行的方向
[思维流程]
1.自发过程
(1)含义:不用借助外力就可以自动进行的过程。
(2)特点
①体系趋向于从高能状态转变为低能状态(体系对外部做功或放出热量)。
②在密闭条件下,体系有从有序转变为无序的倾向性(无序体系更加稳定)。
2.熵与熵变
(1)熵:描述体系混乱程度的物理量,符号为 S。
熵值越大,体系混乱度越大。
(2)熵变:ΔS=S(反应产物)-S(反应物)。
(3)常见的熵增过程
①同一种物质的不同状态:S(g)>S(l)>S(s)。
②反应后气体物质的量增加的反应。
3.化学反应方向的判据
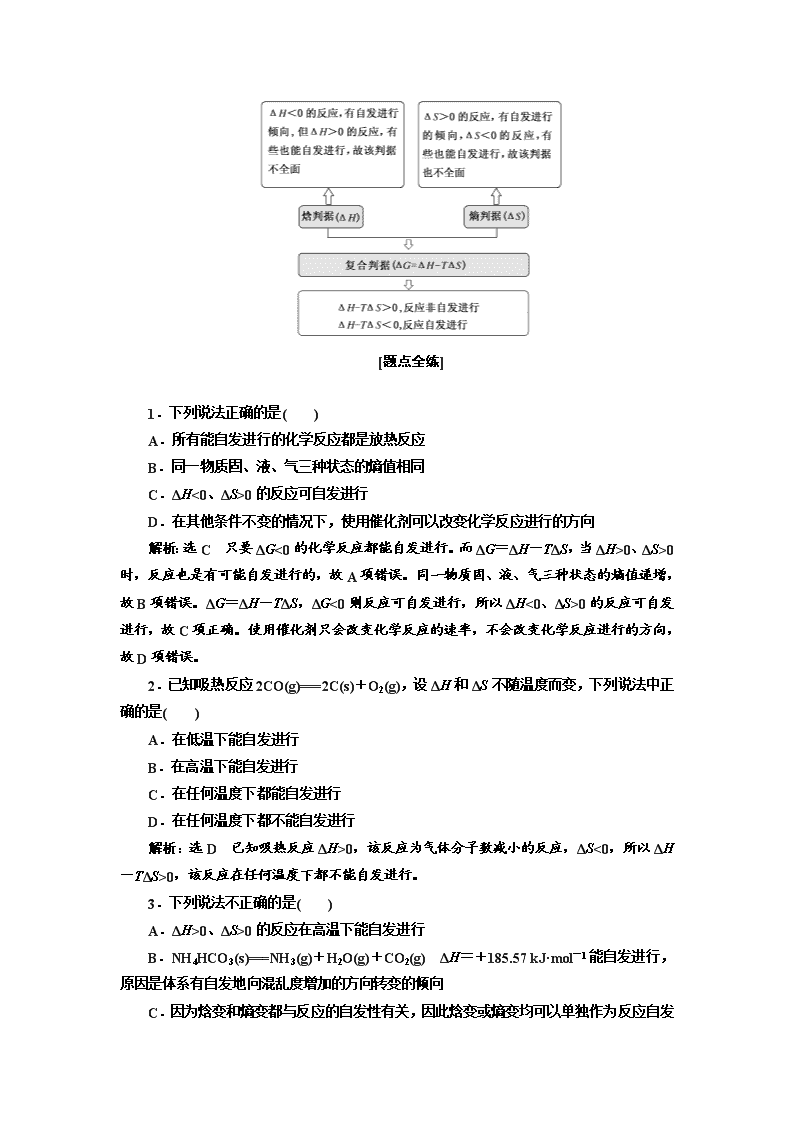
[题点全练]
1.下列说法正确的是( )
A.所有能自发进行的化学反应都是放热反应
B.同一物质固、液、气三种状态的熵值相同
C.ΔH<0、ΔS>0 的反应可自发进行
D.在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向
解析:选 C 只要 ΔG<0 的化学反应都能自发进行。而 ΔG=ΔH-TΔS,当 ΔH>0、ΔS>0
时,反应也是有可能自发进行的,故 A 项错误。同一物质固、液、气三种状态的熵值递增,
故 B 项错误。ΔG=ΔH-TΔS,ΔG<0 则反应可自发进行,所以 ΔH<0、ΔS>0 的反应可自发
进行,故 C 项正确。使用催化剂只会改变化学反应的速率,不会改变化学反应进行的方向,
故 D 项错误。
2.已知吸热反应 2CO(g)===2C(s)+O2(g),设 ΔH 和 ΔS 不随温度而变,下列说法中正
确的是( )
A.在低温下能自发进行
B.在高温下能自发进行
C.在任何温度下都能自发进行
D.在任何温度下都不能自发进行
解析:选 D 已知吸热反应 ΔH>0,该反应为气体分子数减小的反应,ΔS<0,所以 ΔH
-TΔS>0,该反应在任何温度下都不能自发进行。
3.下列说法不正确的是( )
A.ΔH>0、ΔS>0 的反应在高温下能自发进行
B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol -1 能自发进行,
原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发
性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
解析:选 C ΔH>0、ΔS>0,在高温下可满足 ΔG=ΔH-TΔS<0,可自发进行,A 项正
确;ΔH>0,ΔS>0,能够满足 ΔG=ΔH-TΔS<0,原因是体系有自发地向混乱度增加的方向
转变的倾向,B 项正确;反应能否自发进行,取决于焓变和熵变的综合判据,不能用焓变或
熵变单独作为反应自发性的判据,C 项错误;使用催化剂,能改变反应的活化能,反应速率
改变,故 D 项正确。
考点二 化学平衡状态
[思维流程]
1.可逆反应
2.化学平衡的建立
(1)化学平衡的建立过程
(2)化学平衡状态的概念
一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应
的物质的质量或浓度保持不变的状态。
3.化学平衡状态的特点
4.化学平衡状态的判断
化学反应 mA(g)+nB(g)pC(g)+qD(g) 是否平衡
平衡
平衡
平衡
混合物体系中各成
分的含量
①各物质的物质的量或物质的量分数一定
②各物质的质量或质量分数一定
③各气体的体积或体积分数一定
④总体积、总压强、总物质的量一定 不一定平衡
平衡
平衡
不一定平衡正、逆反应速率之间
的关系
①在单位时间内消耗了 m mol A,同时也生成了 m
mol A
②在单位时间内消耗了 n mol B,同时也消耗了 p mol
C
③v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
④在单位时间内生成了 n mol B,同时也消耗了 q mol
D
不一定平衡
平衡
不一定平衡
平衡
压强
①其他条件一定、总压强一定,且 m+n≠p+q
②其他条件一定、总压强一定,且 m+n=p+q
混合气体的平均相对分子质量
①平均相对分子质量一定,且 m+n≠p+q
②平均相对分子质量一定,且 m+n=p+q 不一定平衡
温度 任何化学反应都伴随着能量变化,当体系温度一定时 平衡
气体的密度 密度一定 不一定平衡
颜色 反应体系内有色物质的颜色稳定不变 平衡
[典例] (2017·全国卷Ⅲ节选)298 K 时,将 20 mL 3x mol·L -1 Na3AsO3、20 mL 3x mol·L
-1 I2 和 20 mL NaOH 溶液混合,发生反应:AsO3-3 (aq)+I2(aq)+2OH-(aq)AsO3-4 (aq)+
2I-(aq)+H2O(l)。溶液中 c(AsO3-4 )与反应时间(t)的关系如图所示。
下列可判断反应达到平衡的是________(填标号)。
a.溶液的 pH 不再变化
b.v(I-)=2v(AsO3-3 )
c.c(AsO3-4 )/c(AsO3-3 )不再变化
d.c(I-)=y mol·L-1
[学审题析题]
①溶液的 pH 不再变化,即 OH-的浓度不再变化,所以平衡体系中各组分的浓度均不
再变化,说明反应达到平衡状态,a 项正确;
②当 v 正(I-)=2v 逆(AsO3-3 )或 v 逆(I-)=2v 正(AsO3-3 )时反应达到平衡状态,由于选项中
的速率未指明是正反应速率还是逆反应速率,不能确定是否达到平衡状态,故 b 项错误;
③反应达到平衡之前,c(AsO3-3 )逐渐减小而 c(AsO3-4 )逐渐增大,故 c(AsO3-4 )/c(AsO3-3 )
逐渐增大,当 c(AsO3-4 )/c(AsO3-3 )不变时反应达到平衡状态,c 项正确;
④根据离子方程式可知反应体系中恒有 c(I-)=2c(AsO3-4 ),观察图像可知反应达到平衡
时 c(AsO3-4 )=y mol·L-1,此时 c(I-)=2y mol·L-1,故 d 项错误。
[答案] ac
[规律方法]
判断化学平衡状态的方法——“正逆相等,变量不变”
[对点训练]
1.可逆反应 N2+3H22NH3 的正、逆反应速率可用各反应物或生成物浓度的变化来
表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v 正(N2)=v 正(H2) B.v 正(N2)=v 逆(NH3)
C.2v 正(H2)=3v 逆(NH3) D.v 正(N2)=3v 逆(H2)
解析:选 C 因化学反应达到平衡时,正逆反应速率相等(同种物质)或正逆反应速率之
比等于系数之比(不同物质)。无论该反应是否达到平衡状态,都有 3v 正(N2)=v 正(H2),A 错
误;反应达到平衡状态时,2v 正(N2)=v 逆(NH3),B 错误;反应达到平衡状态时,v 正(H2)∶v
逆(NH3)=3∶2,C 正确;反应达到平衡状态时,v 正(N2)∶v 逆(H2)=1∶3,D 错误。
2.一定温度下,反应 N2O4(g)2NO2(g)的焓变为 ΔH。现将 1 mol N2O4 充入一恒压
密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
A.①② B.②④
C.③④ D.①④
解析:选 D 因反应容器保持恒压,所以容器体积随反应进行而不断变化,结合 ρ 气=
m/V 可知,气体密度不再变化,说明容器体积不再变化,即气体的物质的量不再变化,反应
达到平衡状态,①符合题意;无论是否平衡,反应的 ΔH 都不变,②不符合题意;反应开始
时,加入 1 mol N2O4,随着反应的进行,N2O4 的浓度逐渐变小,故 v 正(N2O4)逐渐变小,直
至达到平衡,③不符合题意;N2O4 的转化率不再变化,说明 N2O4 的浓度不再变化,反应达
到平衡状态,④符合题意。
3.在一定温度下的恒容容器中,当下列物理量不再发生变化时:①混合气体的压强,
②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合
气体的颜色,⑥各反应物或生成物的浓度之比等于系数之比,⑦某种气体的百分含量。
(1)能说明 2SO2(g)+O2(g)2SO3(g)达到平衡状态的是________。
(2)能说明 I2(g)+H2(g)2HI(g)达到平衡状态的是________。
(3)能说明 2NO2(g)N2O4(g)达到平衡状态的是________。
(4)能说明 C(s)+CO2(g)2CO(g)达到平衡状态的是________。
(5)能说明 A(s)+2B(g)C(g)+D(g)达到平衡状态的是________。
(6)能说明 NH2COONH4(s)2NH3(g)+CO2(g)达到平衡状态的是________。
答案:(1)①③④⑦ (2)⑤⑦ (3)①③④⑤⑦
(4)①②③④⑦ (5)②④⑦ (6)①②③
考点三 化学平衡常数
[思维流程]
化学平衡常数及影响因素
1.概念
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂
之积的比值是一个常数,称为化学平衡常数,用符号 K 表示。
2.表达式
(1)对于反应 mA(g)+nB(g) pC(g)+qD(g)
K=[C]p·[D]q
[A]m·[B]n(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)。
(2)K 值越大,反应物的转化率越大,正反应进行的程度越大。
3.实例
化学方程式 平衡常数 关系式
N2(g)+3H2(g)
2NH3(g)
K1= [NH3]2
[N2][H2]3
1
2N2(g)+3
2H2(g)
NH3(g)
K2= [NH3]
[N2] [H2]
2NH3(g)N2(g)+
3H2(g)
K3=[N2][H2]3
[NH3]2
K2= K1(或 K1
21) K3= 1
K1
4.注意事项
(1)K 只受温度影响,与反应物或生成物的浓度变化无关。
(2)计算化学平衡常数利用的是物质的平衡浓度,而不是任意时刻浓度,也不能用物质
的量。
(3)催化剂能加快化学反应速率,但对化学平衡无影响,也不会改变平衡常数的大小。
(4)化学反应方向改变或系数改变,化学平衡常数均发生改变。
[对点训练]
1.反应 H2(g)+I2(g)2HI(g)的平衡常数为 K1;反应 HI(g)1
2H2(g)+1
2I2(g)的平衡常
数为 K2,则 K1、K2 的关系式为(平衡常数为同温度下的测定值)( )
A.K1=2K2 B.K1=K22
C.K1= 1
K22 D.K1= 1
2K2
解析:选 C 由反应 H 2(g)+I 2(g)2HI(g)的平衡常数 K1,则相同温度下,反应
2HI(g)H2(g)+I 2(g)的平衡常数为 1
K1,故反应 HI(g)1
2H2(g)+1
2I2(g)的平衡常数 K2=
1
K1,故 K1= 1
K22。
2.某温度下 2 L 密闭容器中 3 种气体起始状态和平衡状态时的物质的量(n)如表所示,
下列说法正确的是( )
X Y W
n(起始状态)/mol 2 1 0
n(平衡状态)/mol 1 0.5 1.5
A.该温度下,此反应的平衡常数表达式是 K=[X]2[Y]
[W]3
B.其他条件不变,升高温度,若 W 的体积分数减小,则此反应 ΔH<0
C.其他条件不变,使用催化剂,正、逆反应速率和平衡常数均增大,平衡不移动
D.其他条件不变,当密闭容器中混合气体密度不变时,表明反应已达到平衡
解析:选 B 由表知,X、Y 是反应物,W 是生成物,且 Δn(X)∶Δn(Y)∶Δn(W)=2∶1∶3
,化学方程式为 2X+Y3W,反应的平衡常数表达式是 K= [W]3
[X]2[Y],A 错误;升高温度,
若 W 的体积分数减小,说明平衡向逆反应方向移动,则此反应的 ΔH<0,B 正确;使用催
化剂,平衡常数不变,C 错误;混合气体密度一直不变,不能说明反应已达到平衡,D 错误
。
3.某温度下气体反应达到化学平衡,平衡常数 K=[A][B]2
[E]2[F],恒容时,若温度适当降低
,F 的浓度增加,下列说法正确的是( )
A.增大 c(A)、c(B),K 增大
B.降低温度,正反应速率增大
C.该反应的焓变为负值
D.该反应的化学方程式为 2E(g)+F(g)A(g)+2B(g)
解析:选 D 某温度下气体反应达到化学平衡,平衡常数 K=[A][B]2
[E]2[F],则该反应为 2E(g)
+F(g)A(g)+2B(g),恒容时,若温度适当降低,F 的浓度增加,平衡向逆反应方向移动,
正反应为吸热反应,故 C 错误,D 正确;平衡常数只受温度影响,与浓度无关,温度不变,
平衡常数不变,故 A 错误;降低温度,正、逆反应速率都降低,正反应速率降低更多,平
衡向逆反应方向移动,故 B 错误。
化学平衡常数的两大应用
1.判断化学反应进行的方向
对于可逆反应 aA(g)+bB(g)cC(g)+dD(g),在一定温度下的任意时刻,反应物与生
成物浓度有如下关系:
Q=cc(C)·cd(D)
ca(A)·cb(B),称为浓度商。
QError!
2.判断可逆反应的热效应
[对点训练]
4.利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收 CO,能达到保护环境和能源再利用的目
的,反应方程式为 Cu(NH3)2Ac+CO+NH3[Cu(NH3)3]Ac·CO。已知该反应的化学平衡
常数与温度的关系如表所示:
温度/℃ 15 50 100
化学平衡常数 5×104 2 1.9×10-5
下列说法正确的是( )
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)3]Ac·COCu(NH3)2Ac+CO+NH3 的平衡常数为 2×10-5
C.保持其他条件不变,减小压强,CO 的转化率升高
D.醋酸二氨合铜溶液的浓度大小对 CO 的吸收多少没有影响
解析:选 B 根据提供数据,温度降低,平衡常数增大,说明降低温度,平衡向正反应
方向移动,则正反应为放热反应,A 项错误;[Cu(NH3)3]Ac·COCu(NH3)2Ac+CO+NH3
为 Cu(NH3)2Ac+CO+NH3[Cu(NH3)3]Ac·CO 的逆反应,两反应的平衡常数互为倒数,
则[Cu(NH3)3]Ac·COCu(NH3)2Ac+CO+NH3 的平衡常数 K= 1
5 × 104=2×10-5,B 项正
确;减小压强,平衡逆向移动,CO 的转化率降低,C 项错误;增大醋酸二氨合铜溶液的浓
度,平衡向正反应方向移动,有利于 CO 的吸收,D 项错误。
5.700 ℃时,向容积为 2 L 的密闭容器中充入一定量的 CO(g)和 H 2O(g),发生反应
CO(g)+H2O(g)CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中 t2>t1):
反应时间/min n(CO)/mol n(H2O)/mol
0 1.20 0.60
t1 0.80
t2 0.20
下列说法正确的是( )
A.反应在 0~t1 min 内的平均速率为 v(H2)=0.40
t1 mol·L-1·min-1
B.若 800 ℃时该反应的平衡常数为 0.64,则正反应为吸热反应
C.保持其他条件不变,向平衡体系中再通入 0.20 mol H2O(g)和 0.40 mol H2(g),则 v
正>v 逆
D.保持其他条件不变,起始时向容器中充入 0.60 mol CO(g)和 1.20 mol H2O(g),达到
平衡时 n(CO2)=0.40 mol
解析:选 D 0~t1 min 内,v(H2)=v(CO)=
(1.20-0.80)mol
2 L × t1min =0.20
t1 mol·L-1·min-1,A
项错误;700 ℃,t1 min 时反应已达到平衡状态,此时[CO]=0.80 mol
2 L =0.40 mol·L-1,[H2O]
=0.20 mol
2 L =0.10 mol·L -1,[CO2]=[H2]=0.40 mol
2 L =0.20 mol·L -1,则 K=0.20 × 0.20
0.40 × 0.10=
1>0.64,说明温度升高,平衡常数减小,故正反应为放热反应,B 项错误;保持其他条件不
变,向平衡体系中再通入 0.20 mol H2O(g)和 0.40 mol H2(g),c(H2O)=0.40 mol
2 L =0.20 mol·L
-1,c(H2)=0.80 mol
2 L =0.40 mol·L-1,Qc=0.20 × 0.40
0.40 × 0.20=1=K,平衡不移动,则 v 正=v 逆,
C 项错误;CO(g)与 H2O(g)按物质的量之比为 1∶1 反应,充入 0.60 mol CO(g)和 1.20 mol
H2O(g)与充入 1.20 mol CO(g)和 0.60 mol H2O(g)对平衡状态的影响相同,t1 min 时,n(CO)=
0.80 mol,n(H2O)=0.60 mol-0.40 mol=0.20 mol,t2 min 时,n(H2O)=0.20 mol,说明 t1 min
时反应已经达到平衡状态,根据化学方程式可知,达到平衡时 n(CO2)=0.40 mol,D 项正确
。
6.在一定温度下,1 L 的密闭容器中发生反应:C(s)+H2O(g)CO(g)+H2(g),平衡
时测得 C、H2O、CO、H2 的物质的量都为 0.1 mol。
(1)该反应的平衡常数 K=________。
(2)若升高平衡体系的温度,该反应的平衡常数会增大,则该反应的 ΔH________0(填
“>”或“<”)。
(3)相同条件下,向该密闭容器中充入各物质的起始量如下:①均为 0.2 mol ②C(s)、
H2O 为 0.2 mol,CO、H 2 为 0.1 mol,判断该反应进行的方向:①________________,
②________________。
解析:(1)容积为 1 L,则 H2O、CO、H2 的浓度均为 0.1 mol·L-1,K=[CO][H2]
[H2O] =0.1 × 0.1
0.1
=0.1。(2)升高温度平衡常数增大,说明平衡向右移动,正反应为吸热反应,ΔH>0。(3)①Qc
=0.2 × 0.2
0.2 =0.2>K=0.1,反应向逆反应方向进行;②Qc=0.1 × 0.1
0.2 =0.05 (3)①向逆反应方向 ②向正反应方向
化学平衡常数与转化率的计算
“三段式”法是有效解答化学平衡计算题的“万能钥匙”。解题时,要注意清楚条理
地列出起始量、变化量、平衡量,按题目要求进行计算,同时还要注意单位的统一。
1.明确三个量——起始量、变化量、平衡量
N2 + 3H2催化剂
高温、高压 2NH3
起始量 1 3 0
变化量 a b c
平衡量 1-a 3-b c
(1)反应物的平衡量=起始量-变化量。
(2)生成物的平衡量=起始量+变化量。
(3)各物质变化浓度之比等于它们在化学方程式中系数之比。变化浓度是联系化学方程
式、平衡浓度、起始浓度、转化率、化学反应速率的桥梁。因此,抓变化浓度是解题的关
键。
2.掌握三个百分数
(1)转化率=n(转化)
n(起始)×100%=c(转化)
c(起始)×100%。
(2)生成物的产率:实际产量占理论产量的百分数。一般来说,转化率越高,原料利用
率越高,产率越高。
产率=
产物实际产量
理论产量 ×100%
(3)混合物中某组分的百分含量=
平衡量
平衡总量×100%。
3.谨记答题模板
反应:mA(g)+nB(g)pC(g)+qD(g),令 A、B 起始物质的量(mol)分别为 a、b,达到
平衡后,A 的消耗量为 mx,容器容积为 V L。
mA(g)+nB(g)pC(g)+qD(g)
起始(mol) a b 0 0
变化(mol) mx nx px qx
平衡(mol) a-mx b-nx px qx
对于反应物:n(平)=n(始)-n(变)
对于生成物:n(平)=n(始)+n(变)
则有:(1)平衡常数:K=
[px
V ]p·[qx
V ]q
[a-mx
V ]m·[b-nx
V ]n
。
(2)A 的平衡浓度:c(A)平=a-mx
V mol·L-1。
(3)A 的转化率:α(A)平=mx
a ×100%。
(4)A 的体积分数:φ(A)= a-mx
a+b+(p+q-m-n)x
×100%。
(5)平衡与起始压强之比:p平
p始=a+b+(p+q-m-n)x
a+b 。
(6)混合气体的平均密度:
ρ 混=a·M(A)+b·M(B)
V g·L-1。
(7)平衡时混合气体的平均摩尔质量:
M= a·M(A)+b·M(B)
a+b+(p+q-m-n)x g·mol-1。
[对点训练]
7.在 25 ℃时,密闭容器中 X、Y、Z 三种气体的初始浓度和平衡浓度如下表:
物质 X Y Z
初始浓度/(mol·L-1) 0.1 0.2 0
平衡浓度/(mol·L-1) 0.05 0.05 0.1
下列说法错误的是( )
A.反应达平衡时,X 的转化率为 50%
B.反应可表示为 X+3Y2Z,其平衡常数为 1 600
C.增大压强使平衡向生成 Z 的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
解析:选 C 反应达到平衡时,X 的转化率为(0.1-0.05) mol·L-1/0.1 mol·L-1=50%,
A 正确;根据反应速率之比等于浓度变化量之比等于系数之比可知:Δc(X)∶Δc(Y)∶Δc(Z)=
0.05∶0.15∶0.1 = 1∶3∶2 , 则 反 应 的 方 程 式 为 X + 3Y2Z , K = [Z]2
[X][Y]3=
(0.1)2/0.05×(0.05)3=1 600,B 正确;平衡常数只与温度有关,增大压强平衡向生成 Z 的方
向移动,平衡常数不变,C 错误;平衡常数只受温度的影响,温度改变时,化学平衡常数一
定变化,D 正确。
8 . (2018· 潍 坊 统 考 ) 温 度 为 T0 时 , 在 容 积 固 定 的 密 闭 容 器 中 发 生 反 应 X(g) +
Y(g)Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图 a 所示。其他
条件相同,温度分别为 T1、T2 时发生反应,Z 的浓度随时间变化的关系如图 b 所示。下列
叙述正确的是( )
A.发生反应时,各物质的反应速率大小关系为 v(X)=v(Y)=2v(Z)
B.图 a 中反应达到平衡时,Y 的转化率为 37.5%
C.T0 时,该反应的平衡常数为 33.3
D.该反应正反应的反应热 ΔH<0
解析:选 C 根据题图 a 可知,0~4 min,X、Y 的浓度分别减少 0.25 mol·L -1、0.25
mol·L-1,Z 的浓度增加 0.5 mol·L-1,则反应方程式为 X(g)+Y(g)2Z(g),同一反应中各
物质的反应速率之比等于系数之比,则 v(X)=v(Y)=1
2v(Z),A 项错误;题图 a 中,Y 的起
始浓度为 0.4 mol·L -1 ,平衡浓度为 0.15 mol·L -1 ,则 Y 的转化率为0.4-0.15
0.4 ×100%=
62.5%,B 项错误;达到平衡时[X]=0.05 mol·L-1,[Y]=0.15 mol·L-1,[Z]=0.5 mol·L-1,
则平衡常数 K= [Z]2
[X][Y]= 0.5 × 0.5
0.05 × 0.15≈33.3,C 项正确;根据题图 b 可知,T1 条件下反应先
达到平衡,则 T1>T2,温度升高,c(Z)增大,则平衡向正反应方向移动,故正反应为吸热反
应,ΔH>0,D 项错误。
9.在 1.0 L 密闭容器中放入 0.10 mol A(g),在一定温度进行反应:A(g)B(g)+C(g)
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间(t)/h 0 1 2 4 8 16 20 25 30
总压强(p)/100
kPa
4.91 5.58 6.32 7.31 8.54 9.50 9.52 9.53 9.53
回答下列问题:
(1)欲提高 A 的平衡转化率,应采取的措施为_______________________________。
(2) 由 总 压 强 p 和 起 始 压 强 p0 计 算 反 应 物 A 的 转 化 率 α(A) 的 表 达 式 为
________________________________________________________________________,
平衡时 A 的转化率为________,列式并计算反应的平衡常数 K:_________________。
解析:(1)因正反应为气体物质的量增大的吸热反应,故采取升温、减压均可使反应正
向移动,提高反应物的转化率。
(2)在同体积的容器中,压强之比等于气体的物质的量之比,故 A 的转化率的表达式为
p-p0
p0 ×100%=( p
p0-1)×100%;25 h 时反应已达平衡状态,则将表中数据代入表达式可知
平衡时 A 的转化率 α(A)=(9.53
4.91-1)×100%=94.1%;依据“三段式”列式进行求解:
A(g) B(g) + C(g)
始/(mol·L-1) 0.10 0 0
转/(mol·L-1) 0.094 1 0.094 1 0.094 1
平/(mol·L-1)0.10-0.094 1 0.094 1 0.094 1
K=0.094 12
0.005 9 =1.5。
答案:(1)升高温度、减小压强
(2)( p
p0-1)×100% 94.1%
A(g) B(g) + C(g)
始/(mol·L-1) 0.10 0 0
平/(mol·L-1) 0.10× 0.10× 0.10×
(1-94.1%) 94.1% 94.1%
K=[B][C]
[A] =0.094 12
0.005 9 =1.5
[真题验收]
1.(2016·上海高考)随着科学技术的发展和环保要求的不断提高,CO2 的捕集利用技术
成为研究的重点。
完成下列填空:
(1)目前国际空间站处理 CO2 的一个重要方法是将 CO2 还原,所涉及的反应方程式为
CO2(g)+4H2(g)Ru
CH4(g)+2H2O(g)
已知 H2 的体积分数随温度的升高而增加。
若温度从 300 ℃升至 400 ℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“
增大”“减小”或“不变”)
v 正 v 逆 平衡常数 K 转化率 α
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
c(CO2)/ (mol·L-1)
c(H2)/ (mol·L
-1)
c(CH4)/ (mol·L
-1)
c(H2O)/
(mol·L-1)
平衡Ⅰ a b c d
平衡Ⅱ m n x y
a、b、c、d 与 m、n、x、y 之间的关系式为____________。
解析:(1)H2 的体积分数随温度的升高而增加,这说明升高温度平衡向逆反应方向移动,
即正反应是放热反应。升高温度,正、逆反应速率均增大,平衡向逆反应方向移动,平衡常
数减小,反应物的转化率减小。(2)相同温度时平衡常数不变,则 a、b、c、d 与 m、n、x、
y 之间的关系式为cd2
ab4= xy2
mn4 。
答案:(1)
v 正 v 逆 平衡常数 K 转化率 α
增大 增大 减小 减小
(2)cd2
ab4= xy2
mn4
2.(1)(2017·海南高考)反应 2NaHCO 3(s)===Na2CO3(s)+H 2O(g)+CO 2(g)的 ΔH=+
135.6 kJ·mol-1,该反应的平衡常数表达式 K=____________________。
(2)(2017·全国卷Ⅰ)H2S 与 CO2 在高温下发生反应:
H2S(g)+CO2(g)COS(g)+H2O(g)。在 610 K 时,将 0.10 mol CO2 与 0.40 mol H2S 充
入 2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为 0.02。
H2S 的平衡转化率 α1=__________%,反应平衡常数 K=________。
(3)(2014·全国卷Ⅱ)在 容 积 为 1.00 L 的 容 器 中 , 通 入 一 定 量 的 N 2O4 , 发 生 反 应
N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
①100 ℃时,体系中各物质浓度随时间变化如上图所示。在 0~60 s 时段,反应的平衡
常数 K1 为________。
②100 ℃时达平衡后,改变反应温度为 T,c(N2O4)以 0.002 0 mol·L-1·s-1 的平均速率降
低,经 10 s 又达到平衡。列式计算温度 T 时反应的平衡常数 K2________。
解析:(1)Na2CO3 和 NaHCO3 为固体,根据化学平衡常数的定义 K=[H2O][CO2]。
(2)用三段式法计算:该反应是等气体分子数反应,平衡时 n(H2O)=0.02×0.50 mol=
0.01 mol。
H2S(g)+CO2(g)COS(g)+H2O(g)
起始/mol 0.40 0.10 0 0
转化/mol 0.01 0.01 0.01 0.01
平衡/mol 0.39 0.09 0.01 0.01
α(H2S)=0.01
0.40×100%=2.5%。对于等气体分子数反应,可直接用物质的量替代浓度计
算平衡常数:
K=[COS][H2O]
[H2S][CO2] =0.01 × 0.01
0.39 × 0.09≈2.8×10-3。
(3)①分析题给图像知,二氧化氮的平衡浓度为 0.120 mol·L-1,四氧化二氮的平衡浓度
为 0.040 mol·L-1,K1=[NO2]2
[N2O4]=0.36。②根据题意知,平衡时,c(NO2)=0.120 mol·L-1+0.002
mol·L-1·s-1×10 s×2=0.160 mol·L -1,c(N2O4)=0.040 mol·L-1-0.002 mol·L-1·s-1×10 s
=0.02 mol·L-1,K2=0.1602/0.020≈1.3。
答案:(1)[H2O][CO2] (2)2.5 2.8×10-3
(3)①0.36
②平衡时,[NO2]=0.120 mol·L-1+0.002 mol·L-1·s-1×10 s×2=0.160 mol·L-1
[N2O4]=0.040 mol·L-1-0.002 mol·L-1·s-1×10 s=0.02 mol·L-1
K2=[NO2]2
[N2O4]=0.1602
0.020 ≈1.3
[综合演练提能]
[课堂巩固练]
1.下列说法正确的是( )
A.自发进行的化学反应不一定是放热反应
B.自发过程将导致体系的熵增大
C.ΔH-TΔS<0 的反应,不需要任何条件就可自发进行
D.同一物质的气、液、固三种状态的熵值依次增大
解析:选 A 自发进行的化学反应满足 ΔH-TΔS<0,若 ΔS>0,则当 ΔH>0 时反应可能
自发进行,A 正确;有些自发过程导致体系的熵增大,有些自发过程导致体系的熵减小,B
错误;ΔH-TΔS<0 的反应能自发进行,但有些反应需要点燃或加热等引发反应,如 CO 的
燃烧等,C 错误;熵值大小反映体系的混乱程度,体系的混乱度越高,其熵值越大,则同一
物质的气、液、固三种状态的熵值依次减小,D 错误。
2.可逆反应 N2+3H22NH3,在容积为 10 L 的密闭容器中进行,开始时加入 2 mol N2
和 3 mol H2,达平衡时,NH3 的浓度不可能达到( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.05 mol·L-1 D.0.15 mol·L-1
解析:选 B 2 mol N2 和 3 mol H2 反应,假设反应能够进行到底,则 3 mol H2 完全反应
,生成 2 mol NH3,此时 NH3 的浓度为 0.2 mol·L-1,但由于是可逆反应,不能完全反应,
所以 NH3 的浓度达不到 0.2 mol·L-1。
3.在一定温度下,容器内某一反应中 M、N 的物质的量随反应时间
变化的曲线如图所示,下列表述中正确的是( )
A.反应的化学方程式为 2MN
B.t3 时,正、逆反应速率相等,反应达到化学平衡状态
C.t2 时,正反应速率等于逆反应速率
D.t1 时,M 的物质的量是 N 的物质的量的 2 倍
解析:选 B t2 时,N 减少 4 mol,M 增加 2 mol,因此化学方程式为 2NM,A 错误
;t3 时,反应达到化学平衡状态,B 正确;t2 时,没有达到化学平衡状态,正、逆反应速率
不相等,C 错误;t1 时,N 的物质的量是 M 的物质的量的 2 倍,D 错误。
4 . 一 定 温 度 下 , 在 3 个 体 积 均 为 1.0 L 的 恒 容 密 闭 容 器 中 反 应 2H2(g) +
CO(g)CH3OH(g)分别达到平衡。下列说法正确的是( )
起始浓度/(mol·L-1)
容器 温度/K
H2 CO CH3OH
CH3OH 平衡
浓度(mol·L-
1)
① 400 0.20 0.10 0 0.08
② 400 0.40 0.20 0 x
③ 500 0 0 0.10 0.025
A.该反应的正反应是吸热反应
B.x=0.16
C.平衡时,容器②中 H2 的体积分数比容器①的大
D.400 K 时若再向容器①中充入 0.10 mol H2、0.10 mol CO 和 0.10 mol CH3OH,则平
衡将向正反应方向移动
解析:选 D 对比①、③,若温度相同,0.1 mol·L -1 的 CH3OH 相当于 0.20 mol·L-1
的 H2 和 0.1 mol·L-1 的 CO,为等效平衡,但③的温度较高,平衡时 CH3OH 较低,说明升
高温度平衡逆向移动,正反应为放热反应,故 A 错误;对比①、②,在相同温度下反应,②
中反应物浓度是①中反应物浓度的 2 倍,若平衡不移动时 x=2×0.08 mol·L -1=0.16 mol·L
-1,由方程式 2H2(g)+CO(g)CH3OH(g)可知,增大反应物浓度,平衡正向移动,故容器
②中 CH3OH 的平衡浓度大于 0.08×2 mol·L-1=0.16 mol·L -1,故 B 错误;由 B 项分析可
知,②与①相比,平衡正向移动,H2 的转化率增大,容器②中 H2 的体积分数比容器①中的
小,故 C 错误;由①可知平衡常数 K= 0.08
0.042 × 0.02=2 500,若向容器①中再充入 0.10 mol
H2、0.10 mol CO 和 0.10 mol CH3OH,则 Qc= 0.18
0.142 × 0.12=76.53v 逆
D.恒温恒容下,向容器中再充入少量 G(g),达到新平衡时,G 的体积百分含量将增
大
解析:选 D 由化学方程式可知,该反应为反应后气体分子总数减小的反应,故该反应
为熵减反应,A 项错误;正反应和逆反应的平衡常数互为倒数,故 25 ℃时,反应 G(g)E(s)
+4F(g)的平衡常数是 2×10-5,B 项错误;80 ℃时,Qc= 0.5
0.54=8>2,平衡逆向移动,v 逆>v
正,C 项错误;可逆反应中,加入一种物质,反应向消耗这种物质的方向移动,但加入的物
质不能完全转化,D 项正确。
6.(2017·天津高考)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230
℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4 的沸点为 42.2 ℃,固体杂质不参与
反应。
第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230 ℃制得高纯镍。
下列判断正确的是( )
A.增加 c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在 30 ℃和 50 ℃两者之间选择反应温度,选 50 ℃
C.第二阶段,Ni(CO)4 分解率较低
D.该反应达到平衡时,v 生成[Ni(CO)4]=4v 生成(CO)
解析:选 B 增加 c(CO),平衡正向移动,但平衡常数只与温度有关,温度不变,平衡
常数不变,A 项错误;第一阶段,50 ℃时,反应速率较快且 Ni(CO)4 为气态,能从反应体
系中分离出来,B 项正确;相同温度下,第二阶段与第一阶段的平衡常数互为倒数,则 230
℃时,第二阶段的平衡常数 K′=5×104,反应进行的程度大,故 Ni(CO)4 分解率较高,C
项错误;该反应达到平衡时,4v 生成[Ni(CO)4]=v 生成(CO),D 项错误。
[课下提能练]
对应配套卷 P315
1.(2018·铜陵一中期中)对于化学反应能否自发进行,下列说法中错误的是( )
A.若 ΔH<0、ΔS>0,任何温度下都能自发进行
B.若 ΔH>0、ΔS<0,任何温度下都不能自发进行
C.需要加热才能够进行的过程肯定不是自发过程
D.非自发过程在一定条件下可能变成自发过程
解析:选 C 若 ΔH<0、ΔS>0,则有 ΔH-TΔS<0,故反应在任何温度下都能自发进行,
A 正确;若 ΔH>0、ΔS<0,则有 ΔH-TΔS>0,故反应在任何温度下都不能自发进行,B 正
确;化学反应能否自发进行与是否需要加热无关,有些自发反应需要加热来引发反应,C 错
误;有些非自发反应,改变反应条件可变成自发反应,如 CaCO3 在常温下是非自发反应,
但高温下是自发反应,D 正确。
2.(2018·哈尔滨三中调研)下列说法中不正确的是( )
A.SiO2(s)+2C(s)===Si(s)+2CO(g)只能在高温下自发进行,则该反应的 ΔH>0
B.3C(s)+CaO(s)===CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的 ΔH>0
C.BaSO4(s)+4C(s)===BaS(s)+4CO(g)室温下不能自发进行,说明该反应的 ΔH<0
D.常温下,2NO(g)+O2(g)===2NO2(g)能够自发进行,则该反应的 ΔH<0
解析:选 C 该反应为熵增反应,则有 ΔS>0;该反应只有在高温下自发进行,说明在
低温时 ΔH-TΔS>0,则该反应的 ΔH>0,A 正确。该反应为熵增反应,则有 ΔS>0;该反
应在常温下不能自发进行,说明常温时 ΔH-TΔS>0,即反应的 ΔH>0,B 正确。该反应为
熵增反应,则有 ΔS>0;该反应室温下不能自发进行,说明室温时 ΔH-TΔS>0,即反应的
ΔH>0,C 错误。该反应为熵减反应,则有 ΔS<0;该反应常温下能自发进行,说明常温时
ΔH-TΔS<0,即反应的 ΔH<0,D 正确。
3.炼铁高炉中冶炼铁的反应为 Fe2O3(s)+3CO(g)高温
2Fe(s)+3CO2(g),下列说法正
确的是( )
A.升高温度,反应速率减慢
B.当反应达到化学平衡时,v(正)=v(逆)=0
C.提高炼铁高炉的高度可减少尾气中 CO 的浓度
D.某温度下达到平衡时,CO 的体积分数基本不变
解析:选 D A 项,升高温度,反应速率加快,错误;B 项,化学平衡是动态平衡,v(
正)=v(逆)≠0,错误;C 项,提高炼铁高炉的高度不能减少尾气中 CO 的浓度,错误;D 项
,某温度下达到平衡时,各物质浓度不变,CO 的体积分数基本不变,正确。
4.用 Cl2 生产某些含氯有机物时会生成副产物 HCl,利用下列反应可实现氯的循环利
用:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中
,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A.气体的质量不再改变
B.氯化氢的转化率不再改变
C.断开 4 mol H—Cl 键的同时生成 4 mol H—O 键
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
解析:选 B 反应物和生成物均为气体,气体的总质量始终不变,A 错误;反应正向进
行时,HCl 的转化率升高;反应逆向进行时,HCl 的转化率降低,当 HCl 的转化率不再改
变时,可以说明可逆反应达到平衡状态,B 正确;断开 4 mol H—Cl 键和生成 4 mol H—O
键均表示正反应方向的反应速率,不能据此判断反应是否达到平衡状态,C 错误;达到平衡
状态时,各反应物和生成物的物质的量保持不变,但各物质的物质的量之比不一定等于对应
的系数之比,D 错误。
5.(2018·辽宁六校联考)t ℃时,在容积不变的密闭容器中发生反应 X(g)+3Y(g)2Z(g)
,各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 X Y Z
初始浓度/(mol·L-1) 0.1 0.2 0
2 min 时浓度/(mol·L-1) 0.08 a b
平衡浓度/(mol·L-1) 0.05 0.05 0.1
A.平衡时,X 的转化率为 20%
B.t ℃时,该反应的平衡常数为 40
C.平衡后,增大体系压强,v 正增大,v 逆减小,平衡向正反应方向移动
D.前 2 min 内,用 Y 的变化量表示的平均反应速率 v (Y)=0.03 mol·L-1·min-1
解析:选 D 平衡时,X 的转化率=
(0.1-0.05) mol·L-1
0.1 mol·L-1 ×100%=50%,A 项错误;t ℃
时该反应的平衡常数 K= 0.12
0.05 × 0.053=1 600,B 项错误;该反应是气体分子数减小的反应
,平衡后,增大体系压强,v 正增大,v 逆增大,平衡向正反应方向移动,C 项错误;前 2 min
内,用 Y 的变化量表示的平均反应速率 v(Y)=3v(X)=3×0.02 mol·L-1
2 min =0.03 mol·L-1·min
-1,D 项正确。
6.向密闭容器中充入物质 A 和 B,发生反应:aA(g)+bB(g)cC(g)。
反应过程中,在某一时刻,物质 A 的含量(A%)和物质 C 的含量(C%)随温
度(T)的变化曲线如图所示,下列说法正确的是( )
A.该反应在 T1、T3 温度时达到过化学平衡
B.该反应在 T2 温度时可能达到过化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
解析:选 B T2 之前 A%渐小,C%渐大,而 T2 之后 A%渐大,C%渐小,说明 T2 之
前反应没有达到平衡状态,T2 后温度升高使平衡逆向移动,故 T2 时反应达到平衡状态,故
A 项错误,B 项正确;T2 以后,温度升高,反应物的含量增大,说明平衡逆向移动,故该反
应的正反应为放热反应,逆反应为吸热反应,故 C、D 项错误。
7.N2O5 是一种新型硝化剂,一定温度下发生反应 2N2O5(g)4NO2(g)+O2(g) ΔH>
0,T1 温度下的部分实验数据为
t/s 0 500 1 000 1 500
c(N2O5)/(mol·L-1) 5.00 3.52 2.50 2.50
下列说法不正确的是( )
A.500 s 内,N2O5 的分解速率为 2.96×10-3mol·L-1·s-1
B.T1 温度下的平衡常数为 K1=125,1 000 s 时 N2O5 的转化率为 50%
C.其他条件不变时,T2 温度下反应到 1 000 s 时测得 N2O5(g)浓度为 2.98 mol·L-1,则
有 T1<T2
D.T1 温度下的平衡常数为 K1,T2 温度下的平衡常数为 K2,若 T1>T2,则有 K1>K2
解析:选 C 500 s 内[N 2O5]由 5.00 mol·L -1 降低到 3.52 mol·L -1 ,则有 v(N2O5)=
(5.00-3.52)mol·L-1
500 s =2.96×10-3mol·L-1·s-1,A 正确。1 000 s 时,[N2O5]=2.50 mol·L-1,
则[NO2]=5 mol·L -1,[O2]=1.25 mol·L -1,此时 N2O5 的转化率为
(5.00-2.50)mol·L-1
5.00 mol·L-1 =
50%;化学平衡常数 K1=[NO2]4[O2]
[N2O5]2 =5.004 × 1.25
2.502 =125,B 正确。T2 温度下反应到 1 000 s
时测得 N2O5(g)浓度为 2.98 mol·L -1>2.50 mol·L -1,说明反应正向进行的程度减小,即反
应速率小,故有 T1>T2,C 错误。该反应为吸热反应,升高温度,平衡正向移动,平衡常
数增大,由于 T1>T2,则有 K1>K2,D 正确。
8.(2017· 衡水中学一调) 以二氧化碳和氢气为原料制取乙醇
的 反 应 为 : 2CO2(g) + 6H2(g)CH3CH2OH(g) + 3H2O(g)
ΔH<0。某压强下的密闭容器中,按 CO2 和 H2 的物质的量比为
1∶3 投料,不同温度下平衡体系中各物质的物质的量百分数(y%)
随温度变化如图所示。下列说法正确的是( )
A.a 点的平衡常数小于 b 点
B.b 点,v 正(CO2)=v 逆(H2O)
C.a 点,H2 和 H2O 物质的量相等
D.其他条件恒定,充入更多 H2,v(CO2)不变
解析:选 C 从图像可知,温度越高氢气的含量越高,说明升高温度平衡向逆反应方向
移动,温度升高平衡常数减小,a>b,A 错误;b 点只能说明该温度下,CO2 和 H2O 的浓度
相等,不能说明 v 正(CO2)=v 逆(H2O),B 错误;从图像可知,a 点 H2 和 H2O 的物质的量百
分数相等,故物质的量相等,C 正确;其他条件恒定,充入更多 H2,反应物浓度增大,正
反应速率增大,v(CO2)也增大,D 错误。
9.一定条件下合成乙烯:6H2(g)+2CO2(g)CH2===CH2(g)+4H2O(g),已知温度对
CO2 的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
A.该反应的逆反应为吸热反应
B.平衡常数:KM>KN
C.生成乙烯的速率:v(N)一定大于 v(M)
D.当温度高于 250 ℃,升高温度,催化剂的催化效率降低
解析:选 C 升高温度 CO2 的平衡转化率降低,则升温平衡逆向移动,则逆反应为吸
热反应,故 A 正确;升高温度 CO2 的平衡转化率降低,则升温平衡逆向移动,所以 M 点化
学平衡常数大于 N 点,故 B 正确;化学反应速率随温度的升高而加快,催化剂的催化效率
降低,所以 v(N)有可能小于 v(M),故 C 错误;根据图像,当温度高于 250 ℃,升高温度催
化剂的催化效率降低,故 D 正确。
10.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替
平衡浓度计算,分压=总压×物质的量分数。在恒温恒压条件下,总压不变,用平衡分压
计算平衡常数更方便。下列说法不正确的是( )
A.对于反应 C2H4(g)+H2O(g)C2H5OH(g),在一定条件下达到平衡状态时,体系的
总压强为 p,其中 C2H4(g)、H2O(g)、C2H5OH(g)均为 1 mol,则用分压表示的平衡常数 Kp=
3
p
B.恒温恒压下,在一容积可变的容器中,反应 2A(g)+B(g)2C(g)达到平衡时,A、
B 和 C 的物质的量分别为 4 mol、2 mol 和 4 mol。若此时 A、B 和 C 均增加 1 mol,平衡正
向移动
C.恒温恒压下,在一容积可变的容器中,反应 N2(g)+3H2(g)2NH3(g)达到平衡状
态时,N2、H2、NH3 各 1 mol,若此时再充入 3 mol N2,则平衡正向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的
平衡常数,其数值不同,但意义相同,都只与温度有关
解析:选 C 平衡时 C2H4(g)、H2O(g)、C2H5OH(g)均为 1 mol,则三者的分压均为 1
3p,
故用分压表示的平衡常数 Kp=
1
3p
1
3p × 1
3p
=3
p,A 项正确;如 A、B 和 C 的物质的量按 2∶1∶2
增加时,则平衡不移动,而“均增加 1 mol”时相当于在原来的基础上多加了 B,则平衡正
向移动,B 项正确;N2(g)+3H2(g)2NH3(g)达到平衡状态时,N2、H2、NH3 各 1 mol,三
者的分压均为 1
3p,此时用分压表示的平衡常数 Kp=(1
3p )2÷[(1
3p ) × (1
3p )3]= 9
p2,
若再充入 3 mol N2,此时 N2 的分压为 2
3p,NH 3 和 H2 均为 1
6p,此时用分压表示的 Qp=
(1
6p )2÷[(2
3p ) × (1
6p )3]= 9
p2=Kp,平衡不移动,C 项错误;同一可逆反应,在相
同条件下用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相
同,且都只与温度有关,D 项正确。
11.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体
试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)
。实验测得不同温度下的平衡数据列于下表:
温度/℃ 15.0 20.0 25.0 30.0 35.0
平衡总压强/kPa 5.7 8.3 12.0 17.1 24.0
平衡气体总浓度/
(×10-3mol·L-1)
2.4 3.4 4.8 6.8 9.4
(1)该反应的焓变 ΔH________0,熵变 ΔS________0(填“>”“<”或“=”)。
(2)可以判断该分解反应已经达到化学平衡的是________(填字母)。
A.2v 正(NH3)=v 逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)根据表中数据计算,在 25.0 ℃时,反应 2NH3(g)+CO2(g)NH2COONH4(s)的平衡
常数 K=________。
(4)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25 ℃下达到平衡
状态。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”“减小”或“
不变”)。
解析:(1)分析表中数据可知,温度升高,平衡气体总浓度增大,说明平衡正向移动,
该反应为吸热反应,则有 ΔH>0;该反应是气体体积增大的反应,则有 ΔS>0。
(2)达到平衡时,正、逆反应速率相等,则有 v 正(NH3)=2v 逆(CO2),A 项不符合题意;
因为反应前后气体分子数不相等,未达到平衡前压强一直在变,所以总压强不变时,说明反
应达到平衡,B 项符合题意;反应未达到平衡前,气体质量一直在变,而容器容积不变,
依 ρ=m
V可知,混合气体的密度也在变,所以混合气体的密度不变时,说明反应达到平衡,C
项符合题意;反应产物中 NH3 和 CO2 的物质的量之比始终为 2∶1,密闭容器中氨气的体积
分数始终不变,D 项不符合题意。
(3)由表中数据可知,在 25.0 ℃时,平衡气体的总浓度为 4.8×10-3 mol·L-1,则有[NH3]
= 3.2×10 - 3 mol·L - 1 , [CO2] = 1.6×10 - 3 mol·L - 1 , 反 应 2NH3(g) +
CO2(g)NH2COONH4(s)的平衡常数 K= 1
(3.2 × 10-3)2 × 1.6 × 10-3
≈6.1×107。
(4)在恒温条件下压缩容器体积,平衡逆向移动,氨基甲酸铵固体的质量增大。
答案:(1)> > (2)BC (3)6.1×107 (4)增大
12.科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(
条件及物质未标出)。
(1)已知:CH4、CO、H2 的燃烧热分别为 890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol
-1,则上述流程中第一步反应 2CH4(g)+O2(g)===2CO(g)+4H2(g)的 ΔH=______________。
(2)工业上可用 H2 和 CO2 制备甲醇,其反应方程式为 CO2(g)+3H2(g)CH3OH(g)+
H2O(g),某温度下,将 1 mol CO2 和 3 mol H2 充入体积不变的 2 L 密闭容器中,发生上述
反应,测得不同时刻反应前后的压强关系如下表:
时间/h 1 2 3 4 5 6
p后
p前 0.90 0.85 0.83 0.81 0.80 0.80
①用 H2 表示前 2 h 的平均反应速率 v(H2)=________________________________;
②该温度下,CO2 的平衡转化率为________。
(3)在 300 ℃、8 MPa 下,将 CO2 和 H2 按物质的量之比 1∶3 通入一密闭容器中发生(2)
中反应,达到平衡时,测得 CO2 的平衡转化率为 50%,则该反应条件下的平衡常数为 Kp=
________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2 经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH。在
0.1 MPa 时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态
物质的物质的量(n)关系。
①该反应的 ΔH________0(填“>”或“<”)。
②曲线 c 表示的物质为________。
③ 为 提 高 H2 的 平 衡 转 化 率 , 除 改 变 温 度 外 , 还 可 采 取 的 措 施 是
______________________。
解析:(1)CH4、CO、H2 的燃烧热分别为 890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol
-1,据此写出热化学方程式:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH1=-890.3 kJ·mol-1
②CO(g)+1
2O2(g)===CO2(g)
ΔH2=-283.0 kJ·mol-1
③H2(g)+1
2O2(g)===H2O(l)
ΔH3=-285.8 kJ·mol-1
根据盖斯定律,由①×2-②×2-③×4 可得:2CH4(g)+O2(g)===2CO(g)+4H2(g),则
有 ΔH=2ΔH 1-2ΔH2-4ΔH3=(-890.3 kJ·mol -1)×2-(-283.0 kJ·mol -1)×2-(-285.8
kJ·mol-1)×4=-71.4 kJ·mol-1。
(2)①恒温恒容时,气体的压强之比等于其物质的量之比,2 h 时,p后
p前=0.85,设消耗 CO2
的物质的量为 x mol,
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔV
1 2
x mol 2x mol
则有
(4-2x)mol
4 mol =0.85,解得 x=0.3,故前 2 h 的平均反应速率 v(H2)=0.3 mol × 3
2 L × 2 h =
0.225 mol·L-1·h-1。
②该温度下,反应进行 5 h 时达到平衡状态,此时p后
p前=0.80,设消耗 CO2 的物质的量为
y mol,则有
(4-2y)mol
4 mol =0.80,解得 y=0.4,故 CO2 的平衡转化率为0.4 mol
1 mol ×100%=40%
。
(3)设开始时投入 CO2 和 H2 的物质的量分别为 1 mol、3 mol,CO2 的平衡转化率为 50%,
则有:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量/mol 1 3 0 0
转化量/mol 0.5 1.5 0.5 0.5
平衡量/mol 0.5 1.5 0.5 0.5
则平衡时 p(CO2)=p(CH3OH)=p(H2O)=8 MPa×0.5 mol
3 mol =4
3 MPa,p(H2)=8 MPa×
1.5 mol
3 mol =4 MPa,故该反应条件下的平衡常数为 Kp=
4
3 × 4
3
4
3 × 43
= 1
48。
(4)①由图可知,随着温度的升高,n(H2)逐渐增大,说明平衡逆向移动,则正反应为放
热反应,故有 ΔH<0。②随着温度的升高,n(H2)逐渐增大,由于 H2 是反应物,则另一条逐
渐增大的曲线 a 代表 CO2;C2H4(g)、H2O(g)都是生成物,随着平衡逆向移动,二者的物质
的量逐渐减小,根据系数的关系可知,曲线 b 代表 H2O(g),曲线 c 代表 C2H4(g)。③该反应
的正反应是气体总分子数减少的放热反应,欲提高 H2 的平衡转化率,除改变温度外,还可
以增大压强或不断分离出产物 H2O(g)。
答案:(1)-71.4 kJ·mol-1 (2)①0.225 mol·L-1·h-1
②40% (3) 1
48 (4)①< ②C2H4 ③加压(或不断分离出水蒸气)
13.NH3 作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化
剂研究曾被列入国家 863 计划。催化剂常具有较强的选择性,即专一性。已知:
反应Ⅰ:4NH3(g)+5O2(g)Pt/Ru
高温 4NO(g)+6H2O(g) ΔH1=-905.0 kJ·mol-1
反应Ⅱ:4NH3(g)+3O2(g)Cu/TiO2
高温 2N2(g)+6H2O(g) ΔH2
(1)
化学键 H—O O===O N≡N N—H
键能/(kJ·mol-1) 463 496 942 391
ΔH2=______________。
(2)在恒温恒容装置中充入一定量的 NH3 和 O2,在某催化剂的作用下进行反应Ⅰ,则下
列有关叙述中正确的是________(填字母)。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内 4v 正(NH3)=6v 逆(H2O)时,说明反应已达到平衡
C.当容器内 n(NO)
n(NH3)=1 时,说明反应已达到平衡
(3)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,
在 1 L 密闭容器中充入 1 mol NH3 和 2 mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应________(填“Ⅰ”或“Ⅱ”)。
②520 ℃时,4NH3(g)+5O2(g)4NO(g)+6H2O(g)的平衡常数 K=________(不要求得
出计算结果,只需列出数字计算式)。
③有利于提高 NH3 转化为 N2 的平衡转化率的措施有________(填字母)。
A.使用催化剂 Pt/Ru
B.使用催化剂 Cu/TiO2
C.增大 NH3 和 O2 的初始投料比
D.投料比不变,增大反应物的浓度
E.降低反应温度
解析:(1)4NH3(g)+3O2(g)Cu/TiO2
高温 2N2(g)+6H2O(g)
ΔH2=反应物的键能总和-生成物的键能总和=4×3×391 kJ·mol -1+3×496 kJ·mol-
1-2×942 kJ·mol-1-6×2×463 kJ·mol-1=-1 260 kJ·mol-1。
(2)在恒温恒容装置中充入一定量的 NH3 和 O2,在某催化剂的作用下进行反应Ⅰ,使用
催化剂时,可降低该反应的活化能,加快其反应速率,A 正确;若测得容器内 4v 正(NH3)=
6v 逆(H2O)时,两反应速率之比不等于系数之比,说明反应未达到平衡,B 不正确;当容器
内 n(NO)
n(NH3)=1 时,并不能说明各组分含量保持不变,也不能说明正、逆反应速率相等,所以
不能说明反应已达到平衡,C 不正确。
(3)①根据图像结合 N 元素守恒可知,在高温时氨主要转化为 NO,所以该催化剂在高
温时选择反应Ⅰ。
②520 ℃时,4NH3(g)+5O2(g)4NO(g)+6H2O(g)的平衡常数可根据 A 点数据计算。A
点对应的纵坐标为 0.2,说明 n(N2)=n(NO)=0.2 mol,根据 N 原子守恒得 n(NH3)=1 mol-
0.2 mol-0.2 mol×2=0.4 mol,再根据 H 元素守恒得 n(H2O)=
(1-0.4) × 3
2 mol=0.9 mol,
最后根据 O 原子守恒得 n(O2)=2 mol-0.2 mol×1
2-0.9 mol×1
2=1.45 mol,因为容积为 1 L
,所以 K= 0.24 × 0.96
0.44 × 1.455。
③使用催化剂可以加快化学反应速率,但不能提高反应物的转化率,A 和 B 都不正确;
增大 NH3 和 O2 的初始投料比虽然有利于反应Ⅱ的发生,但会减小氨气的转化率,C 不正确
;正反应是气体分子数增大的反应,投料比不变,增大反应物的浓度相当于采取了加压的措
施,加压对逆反应有利,所以氨的转化率减小,D 不正确;正反应是放热反应,降低反应温
度对正反应有利,所以有利于提高 NH3 转化为 N2 的平衡转化率,E 正确。
答案:(1)-1 260 kJ·mol-1 (2)A
(3)①Ⅰ ② 0.24 × 0.96
0.44 × 1.455 ③E
相关文档
- 2020届高考化学一轮复习化学工艺流2021-07-0236页
- 2019届高考化学一轮复习化学反应与2021-07-0211页
- 2020届高考化学一轮复习化学能与热2021-07-0214页
- 2019届高考化学一轮复习化学反应中2021-07-0213页
- 2020届高考化学一轮复习化学反应速2021-07-0212页
- 2020届高考化学一轮复习化学实验方2021-07-0219页
- 2019届高考化学一轮复习化学与自然2021-07-028页
- 2020届高考化学一轮复习化学反应速2021-07-0235页
- 2020届高考化学一轮复习化学反应速2021-07-0217页
- 2020届高考化学一轮复习化学能与热2021-07-0210页