- 70.22 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一节 化学反应速率
课后篇巩固提升
基础巩固
1.对于反应:CaCO3+2HCl CaCl2+H2O+CO2↑,下列说法正确的是( )
A.用 HCl 和 CaCl2 表示的反应速率数值不同,但所表示的意义相同
B.不能用 CaCO3 的浓度变化来表示反应速率,但可用水来表示
C.用 H2O 和 CO2 表示的化学反应速率相同
D.用 CaCl2 浓度的减小表示其反应速率
解析 固体、纯液体的浓度一般视为常数;反应过程中 CaCl2 的浓度是增大的。
答案 A
2.在 2 L 密闭容器中加入 4 mol A(g)和 6 mol B(g),发生反应:4A(g)+6B(g) 4C(g)+5D(g),若 5 s 后剩
下的 A 是 2.5 mol,则用 B 表示的反应速率是( )
A.0.45 mol·L-1·s-1 B.0.15 mol·L-1·s-1
C.0.225 mol·L-1·s-1 D.0.9 mol·L-1·s-1
解析 5 s 内 A 减少的物质的量为 4 mol-2.5 mol=1.5 mol,故 A 的浓度变化量为=0.75 mol·L -1,所以
v(A)==0.15 mol·L-1·s-1;对于同一反应,用不同物质表示的化学反应速率之比等于化学方程式中对应物
质的化学计量数之比,所以 v(B)=×0.15 mol·L-1·s-1=0.225 mol·L-1·s-1。
答案 C
3.对于反应 3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O,在测量化学反应速率时,以下相关性质不可
以利用的是( )
A.气体的体积和体系的压强
B.溶液颜色的深浅
C.固体物质的体积
D.H+浓度的变化
解析 与化学反应中任何一种化学物质的浓度(或质量)相关的性质在测量反应速率时都可以加以利
用,包括能够直接观察的某些性质(如释放出气体的体积和体系压强),也包括必须依靠科学仪器才能
测量的性质(如颜色的深浅),故 A、B、D 三项可以利用。
答案 C
4.在反应 N2+3H2 2NH3 中,经过一段时间后,NH3 的浓度增加了 0.6 mol·L-1,在此段时间内用 H2 表
示的平均反应速率为 0.45 mol·L-1·s-1,则此段时间是 ( )
A.1 s B.2 s C.44 s D.1.33 s
解析 已知用 H2 表示的平均反应速率为 0.45 mol·L-1·s-1,则用 NH3 表示的平均反应速率为
v(NH3)=v(H2)=×0.45 mol·L-1·s-1=0.3 mol·L-1·s-1,所以 Δt==2 s。
答案 B
5.在 2 L 的密闭容器中,发生反应 3A(g)+B(g) 2C(g),若最初加入的 A 和 B 都是 4 mol,测得 10 s 内
A 的平均速率 v(A)=0.12 mol·L-1·s-1,则反应进行到 10 s 时容器中 B 的物质的量是( )
A.1.6 mol B.2.8 mol C.3.2 mol D.3.6 mol
解析 10 s 内 v(B)=v(A)=0.04 mol·L -1·s-1,故 10 s 内,Δn(B)=10 s×0.04 mol·L-1·s-1×2 L=0.8 mol,因此 10 s
时,容器内 n(B)=4 mol-0.8 mol=3.2 mol。
答案 C
6.把 0.6 mol X 气体和 0.4 mol Y 气体混合于 2 L 容器中,发生反应:3X(g)+Y(g) nZ(g)+2W(g),5 min
末生成 0.2 mol W,若测得以 Z 浓度变化来表示的平均速率为 0.01 mol·L-1·min-1,则上述反应中 Z 气体
的化学计量数 n 的值是( )
A.1 B.2 C.3 D.4
解析 利用条件可求:v(W)==0.02 mol·L -1·min-1,利用反应速率之比等于化学计量数之比的关系可得
n=1。
答案 A
7.将 5.6 g 铁粉投入 100 mL 2 mol·L-1 硫酸中,2 min 后铁恰好完全溶解。下列有关该反应速率的表示
正确的是(忽略溶液体积的变化)( )
A.用铁表示的反应速率为 0.5 mol·L-1·min-1
B.用硫酸表示的反应速率为 0.5 mol·L-1·min-1
C.用硫酸亚铁表示的反应速率为 0.25 mol·L-1·min-1
D.用氢气表示的反应速率为 0.5 mol·L-1·min-1
解析 发生的化学反应为 Fe+H2SO4 FeSO4+H2↑,溶液中浓度发生变化的只有反应物硫酸和生成物
硫酸亚铁。5.6 g Fe 的物质的量为 0.1 mol,故反应消耗 H2SO4 的物质的量=生成 FeSO4 的物质的量
=0.1 mol,v(H2SO4)=v(FeSO4)==0.5 mol·L-1·min-1。
答案 B
8.用纯净的 CaCO3 与 100 mL 稀盐酸反应制取 CO2,实验过程记录如图所示(CO2 的体积已折算为标准
状况下的体积)。下列分析不正确的是( )
A.EF 段表示的平均反应速率最大
B.EF 段,用盐酸表示该反应的平均反应速率为 0.4 mol·L-1·min-1
C.OE、EF、FG 三段中,用 CO2 表示的平均反应速率之比为 2∶6∶7
D.G 点收集到的 CO2 的量最多
解析 曲线斜率越大,平均反应速率越大,A 项正确;B 项中,Δn(CO2)==0.02 mol,Δn(HCl)=0.04
mol,Δc(HCl)=0.4 mol·L-1,v(HCl)=0.4 mol·L-1·min-1,正确;C 项中,平均反应速率之比为 224∶448∶
112=2∶4∶1,错误;D 项中,由图可知,G 点收集到的 CO2 的量最多。
答案 C
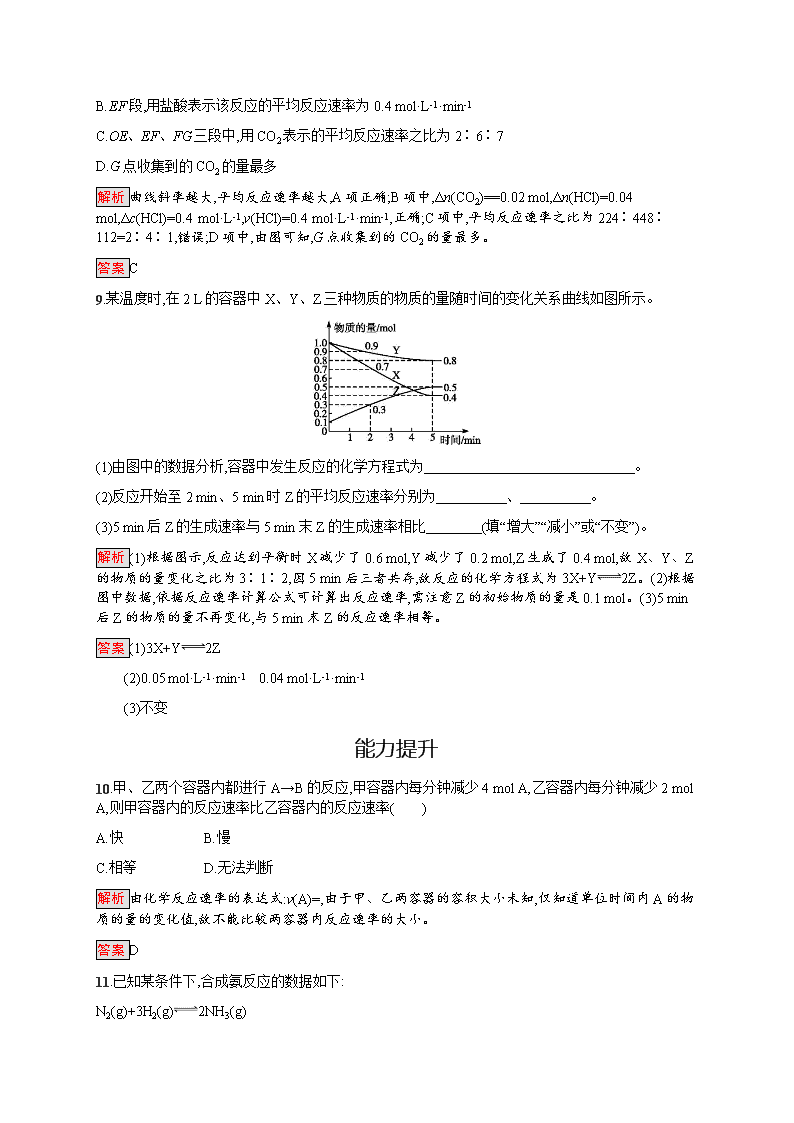
9.某温度时,在 2 L 的容器中 X、Y、Z 三种物质的物质的量随时间的变化关系曲线如图所示。
(1)由图中的数据分析,容器中发生反应的化学方程式为 。
(2)反应开始至 2 min、5 min 时 Z 的平均反应速率分别为 、 。
(3)5 min 后 Z 的生成速率与 5 min 末 Z 的生成速率相比 (填“增大”“减小”或“不变”)。
解析 (1)根据图示,反应达到平衡时 X 减少了 0.6 mol,Y 减少了 0.2 mol,Z 生成了 0.4 mol,故 X、Y、Z
的物质的量变化之比为 3∶1∶2,因 5 min 后三者共存,故反应的化学方程式为 3X+Y 2Z。(2)根据
图中数据,依据反应速率计算公式可计算出反应速率,需注意 Z 的初始物质的量是 0.1 mol。(3)5 min
后 Z 的物质的量不再变化,与 5 min 末 Z 的反应速率相等。
答案 (1)3X+Y 2Z
(2)0.05 mol·L-1·min-1 0.04 mol·L-1·min-1
(3)不变
能力提升
10.甲、乙两个容器内都进行 A→B 的反应,甲容器内每分钟减少 4 mol A,乙容器内每分钟减少 2 mol
A,则甲容器内的反应速率比乙容器内的反应速率( )
A.快 B.慢
C.相等 D.无法判断
解析 由化学反应速率的表达式:v(A)=,由于甲、乙两容器的容积大小未知,仅知道单位时间内 A 的物
质的量的变化值,故不能比较两容器内反应速率的大小。
答案 D
11.已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g) 2NH3(g)
N2 H2 NH3
起始浓度/(mol·L-1) 1.0 3.0 0.2
2 s 末浓度/(mol·L-1) 0.6 1.8 1.0
4 s 末浓度/(mol·L-1) 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
A.2~4 s 内的平均反应速率为 0.2 mol·L-1·s-1
B.前 4 s 内的平均反应速率为 0.3 mol·L-1·s-1
C.前 2 s 内的平均反应速率为 0.4 mol·L-1·s-1
D.2 s 末的反应速率为 0.4 mol·L-1·s-1
解析 化学反应速率是表示一段时间内的平均反应速率而不是某一时刻的瞬时速率,D 项错误。
答案 D
12.为了提高煤的利用率,人们先把煤转化为 CO 和 H2,再将它们转化为甲醇。某实验人员在一定温度
下的密闭容器中,充入一定量的 H2 和 CO,发生反应:
2H2(g)+CO(g) CH3OH(g),测定的部分实验数据如下:
t/s 0 500 1
000
c(H2)/(mol·L-
1) 5.003.522.48
c(CO)/(mol·L-
1) 2.50
(1)在 500 s 内用 H2 表示的化学反应速率是 。
(2)在 1 000 s 内用 CO 表示的化学反应速率是 ,1 000 s 时 CO 的转化率是 。
(3)在 500 s 时生成甲醇的浓度是 。
解析 (1)在 500 s 内,v(H2)==2.96×10-3 mol·L-1·s-1。(2)在 1 000 s 内反应的 H2 的浓度是 Δc(H2)=5.00
mol·L-1-2.48 mol·L-1=2.52 mol·L-1,则反应的 CO 的浓度是 Δc(CO)=Δc(H2)=1.26 mol·L-1,用 CO 表示此
段时间内的平均速率为 v(CO)==1.26×10-3mol·L-1·s-1,CO 的转化率为×100%=50.4%。(3)在 500 s 内反
应的 H2 的浓度为 Δc(H2)=1.48 mol·L-1,则生成的 CH3OH 的浓度为 Δc(CH3OH)=Δc(H2)=0.74 mol·L-1。
答案 (1)2.96×10-3 mol·L-1·s-1
(2)1.26×10-3 mol·L-1·s-1 50.4%
(3)0.74 mol·L-1
相关文档
- 2016-2017学年高二化学人教版选修42021-07-0211页
- 2020学年高二化学人教版选修4练习 2021-07-027页
- 2019-2020学年高二化学人教版选修42021-07-028页
- 2019-2020学年高二化学人教版选修42021-07-026页
- 2020学年高二化学人教版选修4练习 2021-07-025页
- 2020学年高二化学人教版选修4练习 2021-07-027页
- 2019-2020学年高二化学人教版选修42021-07-026页
- 试题君之课时同步君2016-2017学年2021-07-0213页
- 2019-2020学年高二化学人教版选修42021-07-027页