- 429.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
金属的腐蚀与防护
【学习目标】
1、理解金属发生电化学腐蚀的原因,了解电化学腐蚀的类型及差异并能写出电极反应;
2、知道防治金属腐蚀的方法,并能从实验探究中获得体会。
【要点梳理】
要点一、金属的腐蚀
金属腐蚀是指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
1.金属腐蚀的实质。
金属腐蚀的实质都是金属原子失去电子被氧化的过程,用反应方程式表示为:M-ne-=Mn+(M代表金属元素)。
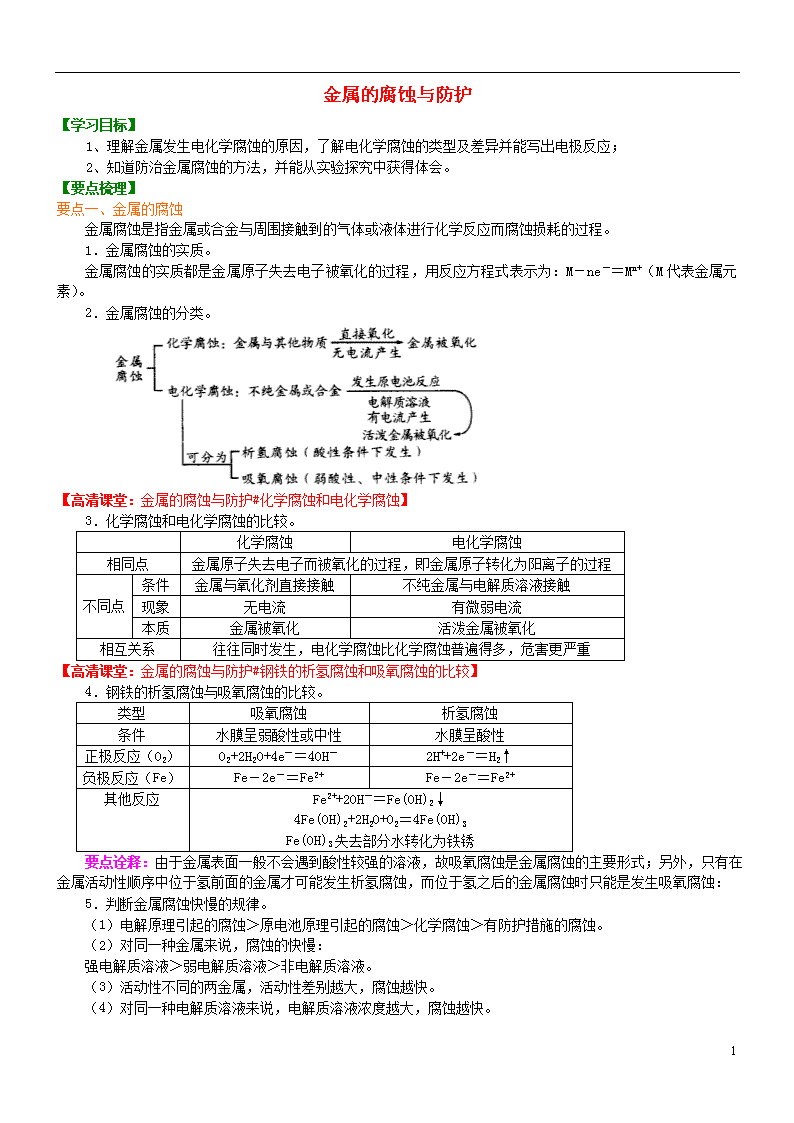
2.金属腐蚀的分类。
【高清课堂:金属的腐蚀与防护#化学腐蚀和电化学腐蚀】
3.化学腐蚀和电化学腐蚀的比较。
化学腐蚀
电化学腐蚀
相同点
金属原子失去电子而被氧化的过程,即金属原子转化为阳离子的过程
不同点
条件
金属与氧化剂直接接触
不纯金属与电解质溶液接触
现象
无电流
有微弱电流
本质
金属被氧化
活泼金属被氧化
相互关系
往往同时发生,电化学腐蚀比化学腐蚀普遍得多,危害更严重
【高清课堂:金属的腐蚀与防护#钢铁的析氢腐蚀和吸氧腐蚀的比较】
4.钢铁的析氢腐蚀与吸氧腐蚀的比较。
类型
吸氧腐蚀
析氢腐蚀
条件
水膜呈弱酸性或中性
水膜呈酸性
正极反应(O2)
O2+2H2O+4e-=4OH-
2H++2e-=H2↑
负极反应(Fe)
Fe-2e-=Fe2+
Fe-2e-=Fe2+
其他反应
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe(OH)3失去部分水转化为铁锈
要点诠释:由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式;另外,只有在金属活动性顺序中位于氢前面的金属才可能发生析氢腐蚀,而位于氢之后的金属腐蚀时只能是发生吸氧腐蚀:
5.判断金属腐蚀快慢的规律。
(1)电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)对同一种金属来说,腐蚀的快慢:
强电解质溶液>弱电解质溶液>非电解质溶液。
(3)活动性不同的两金属,活动性差别越大,腐蚀越快。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
4
要点二、金属的防护
【高清课堂:金属的腐蚀与防护#金属的防护方法】
1.金属防护的思路。
防止金属与化学物质直接接触,防止金属与环境形成原电池。
2.防护方法。
(1)改变金属的内部组成和结构:如不锈钢(钢中加入一定量的镍和铬)。
(2)加保护层:在金属表面镀上一层纯金属(如铁上镀锌、锡、铬等)、喷漆、涂油、生成氧化膜保护(钢铁制品表面生成Fe3O4,在铝制品表面生成Al2O3)。
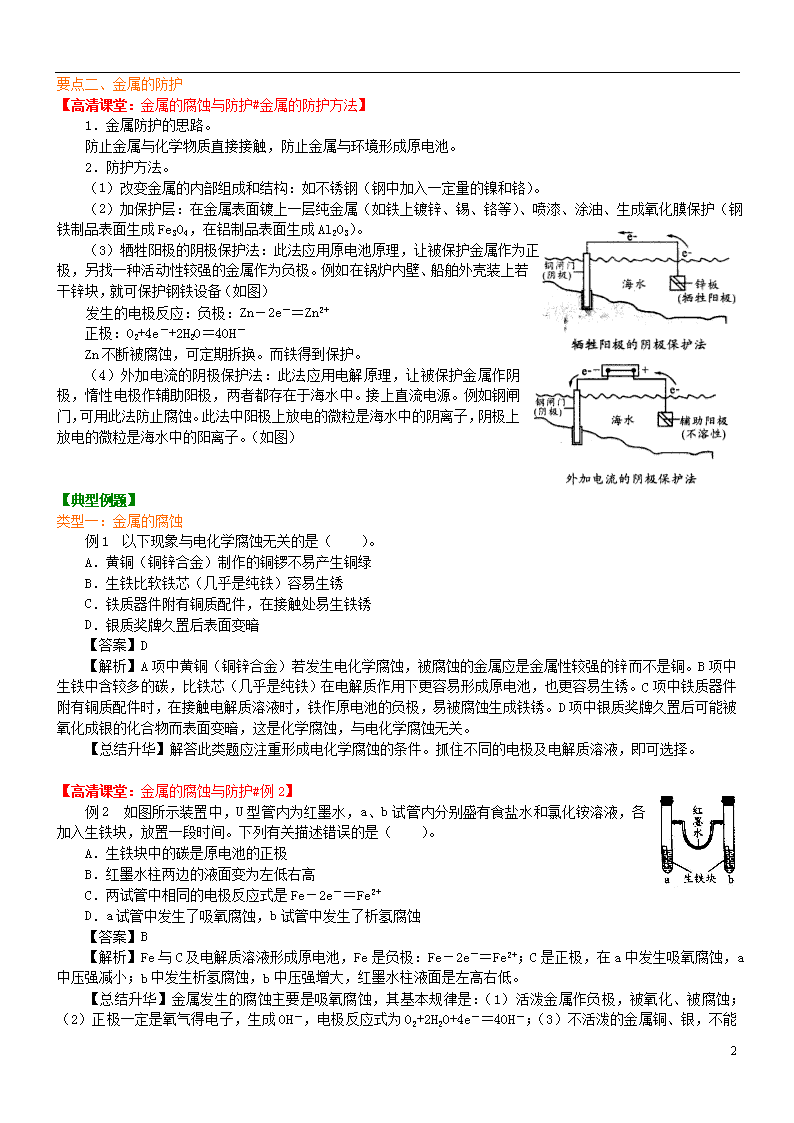
(3)牺牲阳极的阴极保护法:此法应用原电池原理,让被保护金属作为正极,另找一种活动性较强的金属作为负极。例如在锅炉内壁、船舶外壳装上若干锌块,就可保护钢铁设备(如图)
发生的电极反应:负极:Zn-2e-=Zn2+
正极:O2+4e-+2H2O=4OH-
Zn不断被腐蚀,可定期拆换。而铁得到保护。
(4)外加电流的阴极保护法:此法应用电解原理,让被保护金属作阴极,惰性电极作辅助阳极,两者都存在于海水中。接上直流电源。例如钢闸门,可用此法防止腐蚀。此法中阳极上放电的微粒是海水中的阴离子,阴极上放电的微粒是海水中的阳离子。(如图)
【典型例题】
类型一:金属的腐蚀
例1 以下现象与电化学腐蚀无关的是( )。
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
【答案】D
【解析】A项中黄铜(铜锌合金)若发生电化学腐蚀,被腐蚀的金属应是金属性较强的锌而不是铜。B项中生铁中含较多的碳,比铁芯(几乎是纯铁)在电解质作用下更容易形成原电池,也更容易生锈。C项中铁质器件附有铜质配件时,在接触电解质溶液时,铁作原电池的负极,易被腐蚀生成铁锈。D项中银质奖牌久置后可能被氧化成银的化合物而表面变暗,这是化学腐蚀,与电化学腐蚀无关。
【总结升华】解答此类题应注重形成电化学腐蚀的条件。抓住不同的电极及电解质溶液,即可选择。
【高清课堂:金属的腐蚀与防护#例2】
例2 如图所示装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )。
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
【答案】B
【解析】Fe与C及电解质溶液形成原电池,Fe是负极:Fe-2e-=Fe2+;C是正极,在a中发生吸氧腐蚀,a中压强减小;b中发生析氢腐蚀,b中压强增大,红墨水柱液面是左高右低。
【总结升华】金属发生的腐蚀主要是吸氧腐蚀,其基本规律是:(1)活泼金属作负极,被氧化、被腐蚀;(2)正极一定是氧气得电子,生成OH-,电极反应式为O2+2H2O+4e-=4OH-
4
;(3)不活泼的金属铜、银,不能发生析氢腐蚀,但可以发生吸氧腐蚀。
举一反三:
【变式1】用铝制饭盒盛放醋酸,一段时间后,饭盒被腐蚀,该种腐蚀属于________,反应的化学方程式表示为________;若用铝制饭盒盛放食盐(含水),一段时间后,饭盒被腐蚀,这种腐蚀叫________,反应原理是(写电极反应和离子方程式)________。
【答案】化学腐蚀 2A1+6CH3COOH=2Al(CH3COO)3+3H2↑ 电化学腐蚀 负极:4Al-12e-=4Al3+,
正极:6H2O+3O2+12e-=12OH-;Al3++3OH-=Al(OH)3↓
【变式2】家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )。
A.4Fe(OH)2+O2+2H2O=4Fe(OH)3 B.2Fe+O2+2H2O=2Fe(OH)2
C.O2+2H2O+4e-=4OH- D.Fe-3e-=Fe3+
【答案】D
类型二:金属腐蚀快慢的规律
【高清课堂:金属的腐蚀与防护#例1】
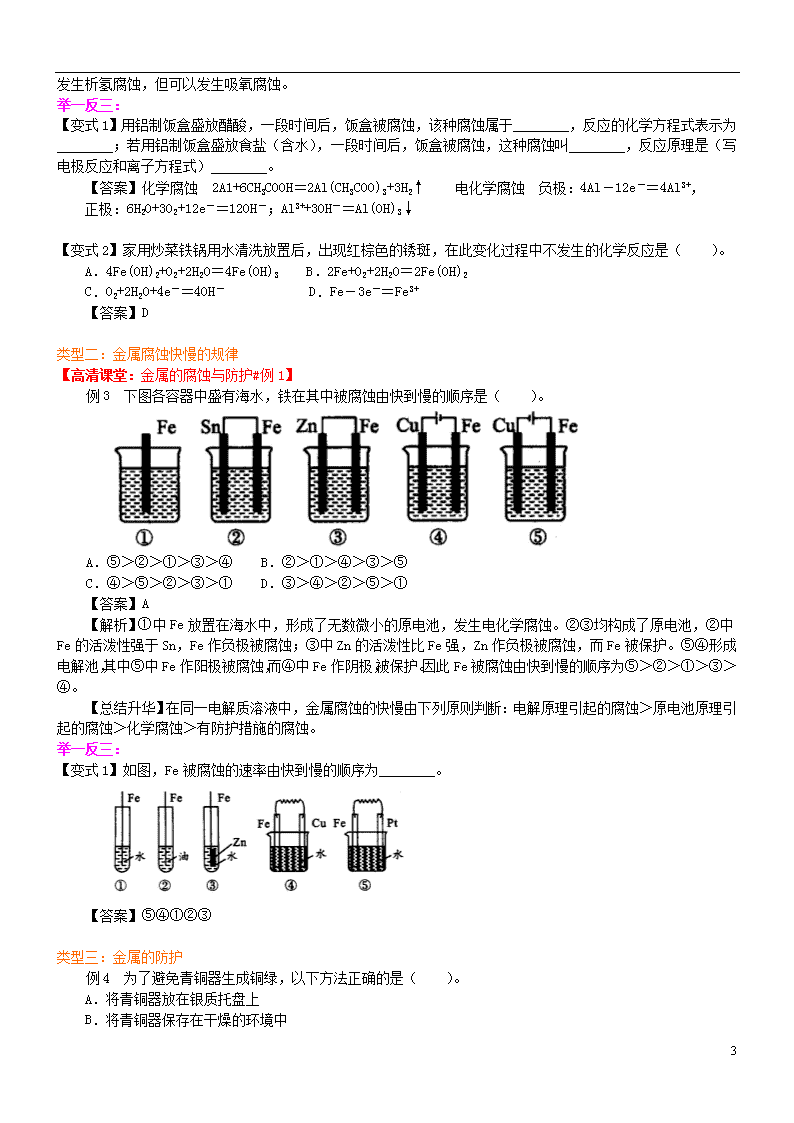
例3 下图各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序是( )。
A.⑤>②>①>③>④ B.②>①>④>③>⑤
C.④>⑤>②>③>① D.③>④>②>⑤>①
【答案】A
【解析】①中Fe放置在海水中,形成了无数微小的原电池,发生电化学腐蚀。②③均构成了原电池,②中Fe的活泼性强于Sn,Fe作负极被腐蚀;③中Zn的活泼性比Fe强,Zn作负极被腐蚀,而Fe被保护。⑤④形成电解池,其中⑤中Fe作阳极被腐蚀,而④中Fe作阴极,被保护。因此Fe被腐蚀由快到慢的顺序为⑤>②>①>③>④。
【总结升华】在同一电解质溶液中,金属腐蚀的快慢由下列原则判断:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
举一反三:
【变式1】如图,Fe被腐蚀的速率由快到慢的顺序为________。
【答案】⑤④①②③
类型三:金属的防护
例4 为了避免青铜器生成铜绿,以下方法正确的是( )。
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
4
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
【答案】B、D
【解析】Cu比Ag活泼,放在银质托盘上更易受腐蚀,A错;将其保存在干燥的环境中避免与空气中的水分等物质接触,可避免腐蚀。B正确,则C错误;覆盖防渗的高分子膜也可以隔绝潮湿空气。D正确。
【总结升华】常见防止金属腐蚀的具体方法:
(1)给金属穿上“防护服”
涂漆——如在钢铁表面涂防锈油漆;
热镀——加热锌或锡等耐腐蚀性能较强的金属,使其均匀覆盖于钢铁表面;
电镀——在钢铁表面形成锌或铬等耐腐蚀性较强的金属镀层:
喷涂有机或无机涂层材料等。
(2)电化学防护法——即牺牲阳极的阴极保护法和外加电流的阴极保护法。
(3)在钢铁中加入一定比例的铬和镍,改变钢铁内部的组成和结构。可极大程度地提高钢铁的抗腐蚀性能,这就是常见的“不锈钢”。
举一反三:
【变式1】下列金属防护的方法不正确的是( )。
A.对健身器材涂油漆以防止生锈
B.对某些工具的“机械转动部位”选用刷油漆的方法来防锈
C.用牺牲锌块的方法来保护船身
D.自行车的钢圈上镀上一层铬防锈
【答案】B
4
相关文档
- 2021版浙江高考选考化学一轮复习教2021-07-0217页
- 2019届高考化学二轮复习电解池 金2021-07-0231页
- 2019届一轮复习人教版电解池、金属2021-07-0235页
- 2020届一轮复习人教通用版第19讲电2021-07-0211页
- 2021届一轮复习浙江专版专题6第三2021-07-027页
- 2021高考化学一轮复习课练20电解池2021-07-0220页
- 全程复习方略浙江专用版高考化学 2021-05-147页
- 高考化学专题五电解池 金属的腐蚀2021-05-1418页
- 高考化学二轮复习 原电池金属的腐2021-05-136页
- 2020版高考化学大一轮复习专题7化2021-05-1320页