- 1.14 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三单元 电解池 金属的腐蚀与防护(加试)
[考试标准]
知识条目
必考要求
加试要求
1.电解池的概念
b
2.电解CuCl2溶液的原理及电极反应式
b
3.电解池的构成条件
b
4.原电池、电解池的判断
c
5.电解池的构造与工作原理
b
6.电解池的电极反应式与电解反应方程式
b
7.金属冶炼、氯碱工业、电镀在生产生活中的应用
b
8.金属腐蚀的危害
a
9.金属发生电化学腐蚀的基本原理
c
10.金属的防护
b
考点一 电解池的工作原理及应用
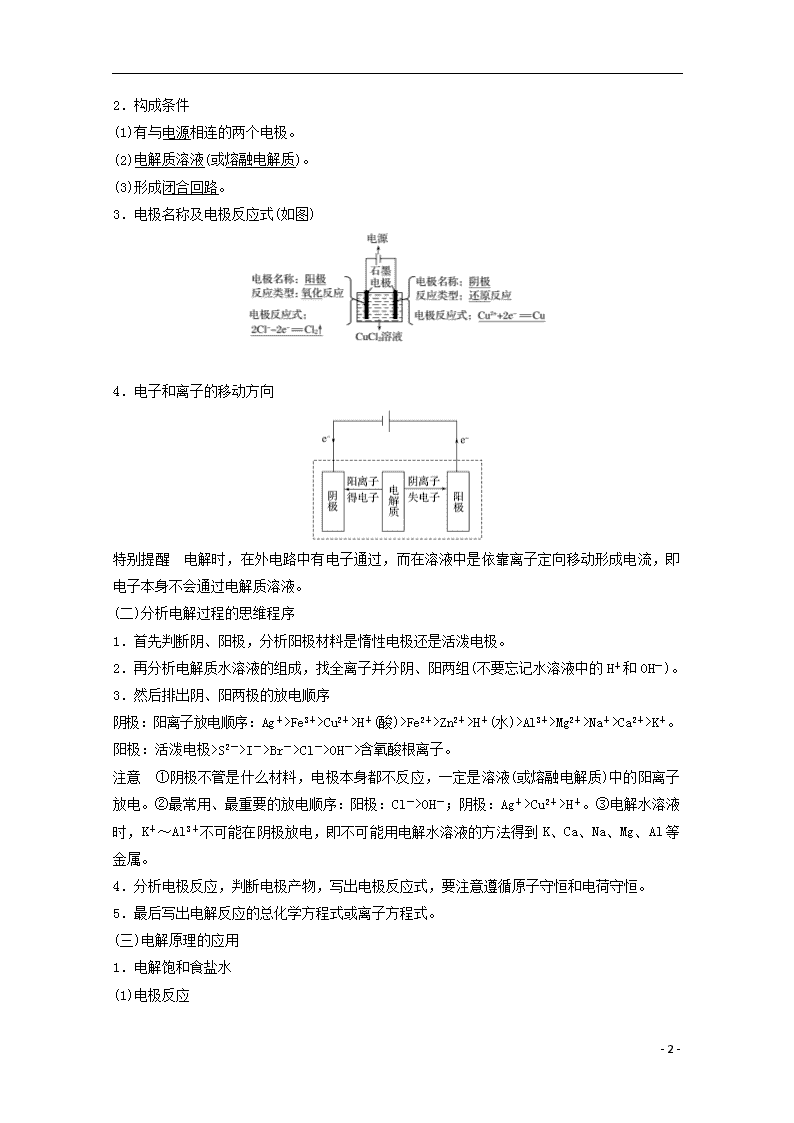
(一)电解池的构成及工作原理
1.概念
把电能转化为化学能的装置。
- 20 -
2.构成条件
(1)有与电源相连的两个电极。
(2)电解质溶液(或熔融电解质)。
(3)形成闭合回路。
3.电极名称及电极反应式(如图)
4.电子和离子的移动方向
特别提醒 电解时,在外电路中有电子通过,而在溶液中是依靠离子定向移动形成电流,即电子本身不会通过电解质溶液。
(二)分析电解过程的思维程序
1.首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
2.再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。
3.然后排出阴、阳两极的放电顺序
阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
注意 ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序:阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
4.分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
5.最后写出电解反应的总化学方程式或离子方程式。
(三)电解原理的应用
1.电解饱和食盐水
(1)电极反应
- 20 -
阳极反应式:2Cl--2e-===Cl2↑(氧化反应)
阴极反应式:2H++2e-===H2↑(还原反应)
(2)总反应方程式
2NaCl+2H2O2NaOH+H2↑+Cl2↑
离子反应方程式:2Cl-+2H2O2OH-+H2↑+Cl2↑
(3)应用
氯碱工业制烧碱、氯气和氢气。
2.电镀
下图为金属表面镀银的工作示意图,据此回答下列问题:
(1)镀件作阴极,镀层金属银作阳极。
(2)电解质溶液是AgNO3溶液等含镀层金属阳离子的盐溶液。
(3)电极反应:
阳极:Ag-e-===Ag+;阴极:Ag++e-===Ag。
(4)特点:阳极溶解,阴极沉积,电镀液的浓度不变。
3.电解精炼铜
(1)电极材料:阳极为粗铜;阴极为纯铜。
(2)电解质溶液:含Cu2+的盐溶液。
(3)电极反应:
阳极:Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+、Cu-2e-===Cu2+;
阴极:Cu2++2e-===Cu。
4.电冶金
利用电解熔融盐的方法来冶炼活泼金属Na、K、Ca、Mg、Al等。
(1)冶炼钠
2NaCl(熔融)2Na+Cl2↑
电极反应:
阳极:2Cl--2e-===Cl2↑;
阴极:2Na++2e-===2Na。
(2)冶炼铝
- 20 -
2Al2O3(熔融)4Al+3O2↑
电极反应:
阳极:6O2--12e-===3O2↑;
阴极:4Al3++12e-===4Al。
1.[2017·浙江11月选考,30(二)]科学家发现,以H2O和N2为原料,熔融NaOH—KOH为电解质,纳米Fe2O3作催化剂,在250 ℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行。
请补充完整。
电极反应式:________________________________________________和2Fe+3H2O+N2===2NH3+Fe2O3。
答案 Fe2O3+6e-+3H2O===2Fe+6OH-
2.[2015·浙江10月选考,30(2)②]单质Mg还可以通过电解熔融MgCl2得到,不能用电解MgCl2溶液的方法制备Mg的理由是_______________________________________________。
答案 电解MgCl2溶液时,阴极上H+比Mg2+容易得电子,电极反应式为2H++2e-===H2↑,所以不能得到Mg单质
备考导向 有关电解的原理及应用在选考中考查的较少,但个别较难,涉及到电极反应、电解方程式的书写及电解原理在冶金工业中的应用等。复习时应根据考试标准既要全面,还要突出重点。
题组一 分类突破电解的规律
1.用分析电解过程的思维程序分析电解下列物质的过程,并总结电解规律(用惰性电极电解)。填写表中空白:
(1)电解水型
电解质(水溶液)
电极方程式
电解物质
总化学方程式
电解质浓度
溶液pH
溶液复原
含氧酸(如H2SO4)
阳极:4OH--4e-===O2↑+2H2O
H2O
2H2OO2↑+2H2↑
增大
减小
加H2O
- 20 -
阴极:4H++4e-===2H2↑
强碱(如NaOH)
增大
加H2O
活泼金属的含氧酸盐(如KNO3、Na2SO4)
不变
加H2O
(2)电解电解质型
电解质(水溶液)
电极方程式
电解物质
总化学方程式
电解质浓度
溶液pH
溶液复原
无氧酸(如HCl),HF除外
阳极:2Cl--2e-===Cl2↑
阴极:2H++2e-===H2↑
酸
2HClH2↑+Cl2↑
减小
增大
通入HCl气体
不活泼金属的无氧酸盐(如CuCl2),氟化物除外
阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
盐
CuCl2Cu+Cl2↑
加CuCl2固体
(3)放H2生碱型
电解质(水溶液)
电极方程式
电解物质
总化学方程式
电解质浓度
溶液pH
溶液复原
活泼金属的无氧酸盐(如NaCl)
阳极:
2Cl--2e-==Cl2↑
阴极:
2H++2e-===H2↑
水和盐
2Cl-+2H2O Cl2↑+H2↑+2OH-
生成新电解质
增大
通入HCl气体
(4)放O2生酸型
电解质(水溶液)
电极方程式
电解物质
总化学方程式
电解质浓度
溶液pH
溶液复原
阳极:4OH--4e-===2H2O+O2↑
水和盐
2Cu2++2H2O2Cu+O
生成新电解质
减小
加CuO或CuCO3
- 20 -
不活泼金属的含氧酸盐(如CuSO4)
阴极:2Cu2++4e-===2Cu
2↑+4H+
复原措施探究
(1)要使电解后的NaCl溶液复原,滴加盐酸可以吗?
提示 不可以,电解NaCl溶液时析出的是等物质的量的Cl2和H2,所以应通入氯化氢气体,加入盐酸会引入水。
(2)要使电解后的CuSO4溶液复原,加入Cu(OH)2固体可以吗?
提示 应具体情况具体分析,若通电一段时间,CuSO4未电解完(即Cu2+未全部放电),使溶液复原应加入CuO,而加入Cu(OH)2会使溶液的浓度减小;若Cu2+全部放电,又继续通电一段时间(此时电解水),要使溶液复原应加入Cu(OH)2或Cu2(OH)2CO3,若只加入CuO,此时浓度偏大。
(3)若用惰性电极电解CuSO4溶液一段时间后,需加入98 g Cu(OH)2固体,才能使电解质溶液复原,则这段时间,整个电路中转移的电子数为多少?
提示 4NA
(4)通过以上分析,电解质溶液复原应遵循什么原则?
提示 电解质溶液的复原应遵循“从溶液中析出什么补什么”的原则,即从溶液中析出哪种元素的原子,则应按比例补入哪些原子。
题组二 电极反应式、电解方程式的书写
2.按要求书写电极反应式和总方程式:
(1)用惰性电极电解AgNO3溶液
阳极反应式__________________________________________________________________;
阴极反应式__________________________________________________________________;
总反应离子方程式____________________________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式___________________________________________________________________;
阴极反应式____________________________________________________________________;
总反应离子方程式_______________________________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式_________________________________________________________________;
阴极反应式___________________________________________________________________;
总反应化学方程式______________________________________________________________。
(4)用铁作电极电解NaOH溶液
阳极反应式____________________________________________________________________;
- 20 -
阴极反应式___________________________________________________________________;
总反应离子方程式______________________________________________________________。
(5)用Al作阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式___________________________________________________________________;
阴极反应式____________________________________________________________________;
总反应化学方程式______________________________________________________________。
(6)用惰性电极电解熔融MgCl2
阳极反应式___________________________________________________________________;
阴极反应式___________________________________________________________________;
总反应离子方程式_____________________________________________________________。
答案 (1)4OH--4e-===O2↑+2H2O(或2H2O-4e-===O2↑+4H+)
4Ag++4e-===4Ag
4Ag++2H2O4Ag+O2↑+4H+
(2)2Cl--2e-===Cl2↑
2H++2e-===H2↑(或2H2O+2e-===H2↑+2OH-)
Mg2++2Cl-+2H2OMg(OH)2↓+Cl2↑+H2↑
(3)Fe-2e-===Fe2+
2H++2e-===H2↑(或2H2O+2e-===H2↑+2OH-)
Fe+2H2OFe(OH)2+H2↑
(4)Fe-2e-+2OH-===Fe(OH)2
2H++2e-===H2↑(或2H2O+2e-===H2↑+2OH-)
Fe+2H2OFe(OH)2+H2↑
(5)2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
2Al+3H2OAl2O3+3H2↑
(6)2Cl--2e-===Cl2↑
Mg2++2e-===Mg
Mg2++2Cl-Mg+Cl2↑
1.做到“三看”,正确书写电极反应式
- 20 -
(1)一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定被电解(注:Fe生成Fe2+)。
(2)二看介质,介质是否参与电极反应。
(3)三看电解质状态,若是熔融状态,就是金属的电冶炼。
2.规避“三个”失分点
(1)书写电解池中电极反应式时,一般以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。
(2)要确保两极电子转移数目相同,且应注明条件“通电”。
(3)电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。
题组三 电解原理的应用
3.利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
答案 D
解析 氯碱工业中阳极是Cl-放电生成Cl2;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,由于粗铜中含有锌、铁、镍等杂质,溶液中Cu2+浓度变小;铁片上镀铜时,阴极应该是铁片,阳极是纯铜。
4.(2016·浙江嘉善一中高三月考)下列实验装置中,按要求设计正确的是( )
答案 B
- 20 -
5.(2017·杭州西湖高级中学高三月考)下列装置可达到铁片上镀锌目的的是( )
答案 C
题组四 原电池、电解池的判断
6.如图所示装置中,装置A中盛放0.1 mol·L-1的H2SO4溶液,装置B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量,且不考虑电极产物在溶液中的溶解)。下列说法中不正确的是( )
A.装置A为原电池,装置B为电解池
B.装置A为电解池,装置B为原电池
C.两烧杯中产生的气体的物质的量相等
D.一段时间后,装置B中溶液的pH升高
答案 B
解析 装置A为原电池,装置B应为电解池,且装置A为装置B提供电能,故A正确,B错误;装置A中碳棒作正极,反应式:2H++2e-===H2↑,铁棒作负极,反应式:Fe-2e-===Fe2+,总反应为Fe+H2SO4===FeSO4+H2↑。装置B中与A装置中铁棒相连的碳棒作阴极:Cu2++2e-===Cu,与A装置中碳棒相连的碳棒作阳极,反应式为2Cl--2e-===Cl2↑,总反应为CuCl2Cu+Cl2↑,由于不考虑Cl2的溶解,由两池中的总反应可推知在相同时间内两烧杯中生成气体的物质的量相同,C正确;B装置在电解过程中CuCl2溶液的浓度变小,溶液的酸性减弱,一段时间后,溶液的pH升高,D正确。
7.(2017·瑞安第一次联考)某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
( )
- 20 -
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
答案 D
解析 若a和b不连接,则不能构成原电池,单质铁直接与Cu2+发生氧化还原反应而置换出铜,反应方程式为Fe+Cu2+===Fe2++Cu,A正确;若a和b用导线连接,则构成原电池,此时铁作负极,铜作正极,电极反应式分别为Fe-2e-===Fe2+、Cu2++2e-===Cu,B正确;由A、B分析可知,C正确;若a和b分别连接直流电源正、负极,则构成电解池,此时铜作阳极失去电子被氧化,铁作阴极,在电解池中阳离子向阴极移动,因此D错误。
8.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池正极反应式是___________________________________________________。
(2)乙装置中阳离子通过X膜向________(填“Fe”或“C”)极移动,石墨(C)极的电极反应式为________________________________________________________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则丙装置中阴极析出铜的质量为________g,硫酸铜溶液的浓度将________(填“增大”“减小”或“不变”)。
答案 (1)O2+4e-+2H2O===4OH-
(2)Fe 2Cl--2e-===Cl2↑
(3)12.8 减小
- 20 -
解析 (1)在碱性介质中,燃料电池的正极是氧气得到电子与水反应生成氢氧根离子。(2)乙图中,铁与甲中的负极相连,为阴极,该极氢离子放电生成氢气,同时溶液中生成氢氧根离子,C电极附近氯离子放电生成氯气,为保持电中性,溶液中的阳离子即钠离子通过X向铁极移动。(3)依据电路中各个电极的转移电子数相等,可求出析出的铜的质量,氧气为0.1 mol,转移电子0.4 mol,所以析出铜0.2 mol,质量为12.8 g;丙中,粗铜中比铜活泼的杂质金属也参与电极反应,所以析出的铜多于溶解的铜,溶液中硫酸铜的浓度会减小。
原电池、电解池、电镀池的比较
原电池
电解池
电镀池
定义
将化学能转化为电能的装置
将电能转化为化学能的装置
应用电解原理在金属表面镀一层其他金属或合金的装置
装置举例
形成条件
①活泼性不同的两电极
②电解质溶液(电极插入其中)
③形成闭合回路
①两电极接直流电源
②两电极插入电解质溶液
③形成闭合回路
①镀层金属接电源正极,待镀金属接电源负极
②电镀液必须含有镀层金属离子
电极名称
负极:较活泼的金属
正极:较不活泼的金属(或能导电的非金属)
阳极:与电源正极相连的电极
阴极:与电源负极相连的电极
阳极:必须是镀层金属
阴极:镀件
电极反应
负极:氧化反应
正极:还原反应
阳极:氧化反应,金属电极失电子或溶液中的阴离子失电子
阴极:还原反应,溶液中的阳离子得电子
阳极:金属电极失电子
阴极:电镀液中的阳离子得电子
微专题11 电解原理广泛应用集训
1.用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图所示。
(1)b电极上的电极反应式为_______________________________________________。
(2)该装置中使用的是________(填“阳”或“阴”)离子交换膜。
- 20 -
答案 (1)2CO2+12e-+12H+===C2H4+4H2O
(2)阳
解析 (1)电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-===C2H4+4H2O。
(2)离子交换膜应只允许氢离子通过,所以是阳离子交换膜。
2.利用固体氧化物电解池通过电解方式分解氮氧化物的过程如图所示,写出电解池中通入NO一端的电极反应式:
________________________________________________________________________。
答案 2NO+4e-===N2+2O2-
解析 电解池的阴极上,NO发生得电子的还原反应生成N2,电极反应式为2NO+4e-===N2+2O2-;阳极上,O2-发生失去电子的氧化反应生成O2,电极反应式为2O2--4e-===O2。
3.H3PO2可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过):
(1)写出阳极反应式______________________________________________________________。
(2)A、B、C分别是________离子交换膜、________离子交换膜、________离子交换膜(填“阴”或“阳”)。
(3)阳极室中溶液pH________(填“变大”“变小”或“不变”)。
答案 (1)2H2O-4e-===O2+4H+ (2)阳 阴 阳
(3)变小
解析 (1)氢氧根离子在阳极放电,有氧气生成,阳极反应式为2H2O-4e-===O2+4H+
- 20 -
。(2)氢氧根离子在阳极放电,有氧气生成,原料室中的次磷酸根离子通过阴离子交换膜进入产品室,阳极室生成的氢离子通过阳离子交换膜进入产品室,二者在产品室结合生成次磷酸( H3PO2),因此B为阴离子交换膜,A为阳离子交换膜,阴极区内氢离子放电,有氢气生成,原料室中的钠离子通过阳离子交换膜进入阴极室,生成氢氧化钠。(3)根据2H2O-4e-===O2+4H+,阳极室中溶液的酸性增强,pH变小。
4.O3可由臭氧发生器(原理如下图所示)电解稀硫酸制得。
(1)图中阴极为______(填“A”或“B”)。
(2)若C处不通入O2,D、E处分别收集到11.2 L和4.48 L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为__________(忽略O3的分解)。
(3)若C处通入O2,则A极的电极反应式为_________________________________________。
答案 (1)A (2)50% (3)O2+4H++4e-===2H2O
解析 (1)由图可知,B极生成O2、O3,B极发生氧化反应,电解池阳极发生氧化反应,A为阴极,电极反应为2H++2e-===H2↑。(2)若C处不通入O2,实质为电解水,D处为氢气,体积为11.2 L,物质的量为0.5 mol,E处为氧气、臭氧,体积共为4.48 L,物质的量为0.2 mol,设臭氧的物质的量为x mol,根据电子转移守恒有0.5×2=x×3×2+(0.2-x)×2×2,解得x=0.1,所以E处收集的气体中O3所占的体积分数为0.1 mol÷0.2 mol×100%=50%。(3)C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-===2H2O。
5.工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:
(1)在阳极区发生的反应包括______________________________________________________
和H ++ HCO===H2O + CO2↑。
(2)简述CO在阴极区再生的原理:______________________________________________
________________________________________________________________________。
答案 (1)4OH--4e-===2H2O+O2↑(或2H2O-4e-===4H++O2↑)
- 20 -
(2)HCO存在电离平衡:HCOH++CO,阴极H+放电,H+浓度减小,平衡右移(或溶液中H+放电,增大了OH-浓度,与HCO反应,从而使CO再生)
解析 (1)与电源正极相连的为电解池的阳极,与电源负极相连的为电解池的阴极,阳极上是氢氧根离子失电子生成氧气,电极反应为4OH--4e-===2H2O+O2↑。
6.电解甲醇水溶液制备氢气最大的优点是需要的电压低,写出阳极电极反应方程式: ________________________________________________________________________。
答案 CH3OH-6e-+H2O===CO2↑+6H+
7.利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图所示。在阴极上产生乙烯的电极反应方程式为____________。
答案 2CO2+12H++12e-===CH2===CH2+4H2O
8.电解CO制备CH4和W,工作原理如下图所示,生成物W是 ,其原理用电解总离子方程式解释是 。
答案 NaHCO3 4CO+3CO +5H2O6HCO+CH4
考点二 金属的腐蚀与防护
1.金属腐蚀的本质
金属原子失去电子变为金属阳离子,金属发生氧化反应。
2.金属腐蚀的类型
(1)化学腐蚀与电化学腐蚀
类型
化学腐蚀
电化学腐蚀
条件
金属跟非金属单质直接接触
不纯金属或合金跟电解质溶液接触
- 20 -
现象
无电流产生
有微弱电流产生
本质
金属被氧化
较活泼金属被氧化
联系
两者往往同时发生,电化学腐蚀更普遍
(2)析氢腐蚀与吸氧腐蚀
以钢铁的腐蚀为例进行分析:
类型
析氢腐蚀
吸氧腐蚀
条件
水膜酸性较强(pH≤4.3)
水膜酸性很弱或呈中性
电极反应
负极
Fe-2e-===Fe2+
正极
2H++2e-===H2↑
O2+2H2O+4e-===4OH-
总反应式
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
联系
吸氧腐蚀更普遍
3.金属的防护
(1)电化学防护
①牺牲阳极的阴极保护法——原电池原理
a.负极:比被保护金属活泼的金属;
b.正极:被保护的金属设备。
②外加电流阴极保护法——电解原理
a.阴极:被保护的金属设备;
b.阳极:惰性金属或石墨。
(2)改变金属的内部结构,如制成合金、不锈钢等。
(3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
题组一 金属腐蚀与快慢判断
1.利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
- 20 -
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
答案 C
解析 根据装置图判断,左边铁丝发生吸氧腐蚀,右边铁丝发生析氢腐蚀,其电极反应为
左边 负极:Fe-2e-===Fe2+
正极:O2+4e-+2H2O===4OH-
右边 负极:Fe-2e-===Fe2+
正极:2H++2e-===H2↑
a、b处的pH均增大,C错误。
2.(2016·浙江江山实验中学高二10月教学质量检测)如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞。几分钟后,打开止水夹,观察到导管中水柱上升。对此过程所做的分析正确的是( )
A.铁粉在电化学腐蚀过程中作正极
B.炭粉被氧化
C.发生了吸氧腐蚀
D.发生了析氢腐蚀
答案 C
3.下图容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>①>③ B.②>①>③>④
C.④>②>③>① D.③>②>④>①
答案 A
- 20 -
解析 根据图知,②、③装置是原电池,在②中,金属铁作负极,③中金属铁作正极被保护,作负极的腐蚀速率快,所以②>③,④装置是电解池,其中金属铁为阳极,加快腐蚀,腐蚀最快,所以腐蚀速率是④>②>①>③。故选A。
题组二 金属腐蚀的实验探究
4.铜是人类最早使用的金属,它与人类生产生活关系密切,请运用所学知识解释下列与铜有关的化学现象。
如上图,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生__________(填“氧化”或“还原”)反应,写出正极的电极反应式_______________________________________。
答案 氧化 O2+4H++4e-===2H2O
解析 在硫酸型酸雨地区,不纯的铜制品发生的是吸氧腐蚀,Cu是负极,发生的是氧化反应,正极的电极反应式为O2+4H++4e-===2H2O。
5.(2017·浙江省名校协作体高二下学期调研)全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。用压强传感器研究生铁发生腐蚀的装置及得到的图像如下:
(1)在该电化学腐蚀中正极电极反应式:____________________________________________。
(2)钢铁表面镀铜可以提高抗腐蚀性能,装置示意如下图所示,则与电源正极相连的金属是________(填元素名称)。
答案 (1)O2+4e-+2H2O===4OH- (2)铜
解析 (1)在该电化学腐蚀中溶液显中性,发生吸氧腐蚀,正极电极反应式为O2+4e-+2H2O===4OH-。
(2)电镀时待镀金属作阴极,镀层金属作阳极,所以与电源正极相连的金属是铜。
课时训练
1.N2O5是一种新型硝化剂。工业上可用N2O4通过电解制备N2O5
- 20 -
,阴、阳极室之间用质子交换膜隔开,两极电解液分别为稀硝酸溶液和溶有N2O4的无水硝酸,用惰性电极电解时,生成N2O5极室的电极反应式为________________________________________________。
答案 N2O4-2e-+2HNO3===2N2O5+2H+
2.某化学小组构想将汽车尾气(NOx)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。写出总化学方程式__________________________________________。
答案 4NOx+(5-2x)O2+2H2O===4HNO3
3.利用电化学原理,用铁钉和氢氧化钾溶液为原料可以获得K2FeO4。在制备过程中铁钉作________极,请写出获得FeO的电极反应式____________________。
答案 阳 Fe-6e-+8OH-===FeO+4H2O
4.连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为_____________________________________,
连二亚硫酸根与HNO2反应的离子方程式:________________________________________。
答案 2HSO+2e-+2H+===S2O+2H2O 3S2O+2HNO2+2H2O===6HSO+N2↑
5.有研究表明,在温度大于70 ℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,写出阴极的电极反应式:_____________________________________________________。
答案 N2+6H2O+6e-===2NH3+6OH-
6.白色不溶于水的CuCl可以由电解法制得,如图所示:
(1)装置中用的交换膜为________(填字母)。
A.阳离子交换膜
B.阴离子交换膜
C.质子交换膜
D.氢氧根离子交换膜
(2)阳极的电极反应式为_______________________________________________。
- 20 -
答案 (1)A (2)Cu+Cl--e-===CuCl
7.科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺——TiO2直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。
写出阴极电极反应式____________________________________________________。
答案 TiO2+4e-===Ti+2O2-
8.用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。下图是电解产生多硫化物的实验装置:
已知阳极的反应为(x+1)S2-===Sx+S2-+2xe-,则阴极的电极反应式为_______________。
当反应转移x mol电子时,产生的气体体积为________(标准状况下)。
答案 2H2O+2e-===2OH-+H2↑ 11.2x L
9.若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图如图所示。电解时阳极的电极反应式为_______________________________________。
答案 HSO+H2O-2e-===SO+3H+
10.多孔Al2O3薄膜可作为催化剂载体、模板合成纳米材料等用途。现以高纯铝片作为阳极,不锈钢作为阴极,一定浓度的磷酸溶液作为电解质进行电解,即可初步制取多孔Al2O3膜。请写出该制取过程的阳极电极反应:
________________________________________________________________________。
答案 2Al+3H2O-6e-===Al2O3+6H+
11.在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内的CO2,同时产生O2和新的能源CO,则阴极的电极反应式为__________________。
- 20 -
答案 H2O+3CO2+2e-===CO+2HCO
12.某电解法制氨的装置如下图所示,电解质只允许质子通过,试写出阴极的电极反应式:________________________________________________________________________。
答案 N2+6H++6e-===2NH3
- 20 -