- 1.78 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三节 晶体结构与性质
本节共设计1个学案
[高考导航]
1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
2.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
3.理解金属键的含义,能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。
4.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
5.能根据晶胞确定晶体的组成并进行相关的计算。
6.了解晶格能的概念及其对离子晶体性质的影响。
1.晶体与非晶体
(1)晶体与非晶体的比较
(2)获得晶体的三条途径
①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
2.晶胞
(1)概念:晶胞是描述晶体结构的基本单元。
(2)晶体中晶胞的排列——无隙并置
①无隙:相邻晶胞之间没有任何间隙。
②并置:所有晶胞平行排列、取向相同。
(3)晶胞中粒子数目的计算——均摊法
晶胞任意位置上的一个原子如果是被n个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是 。
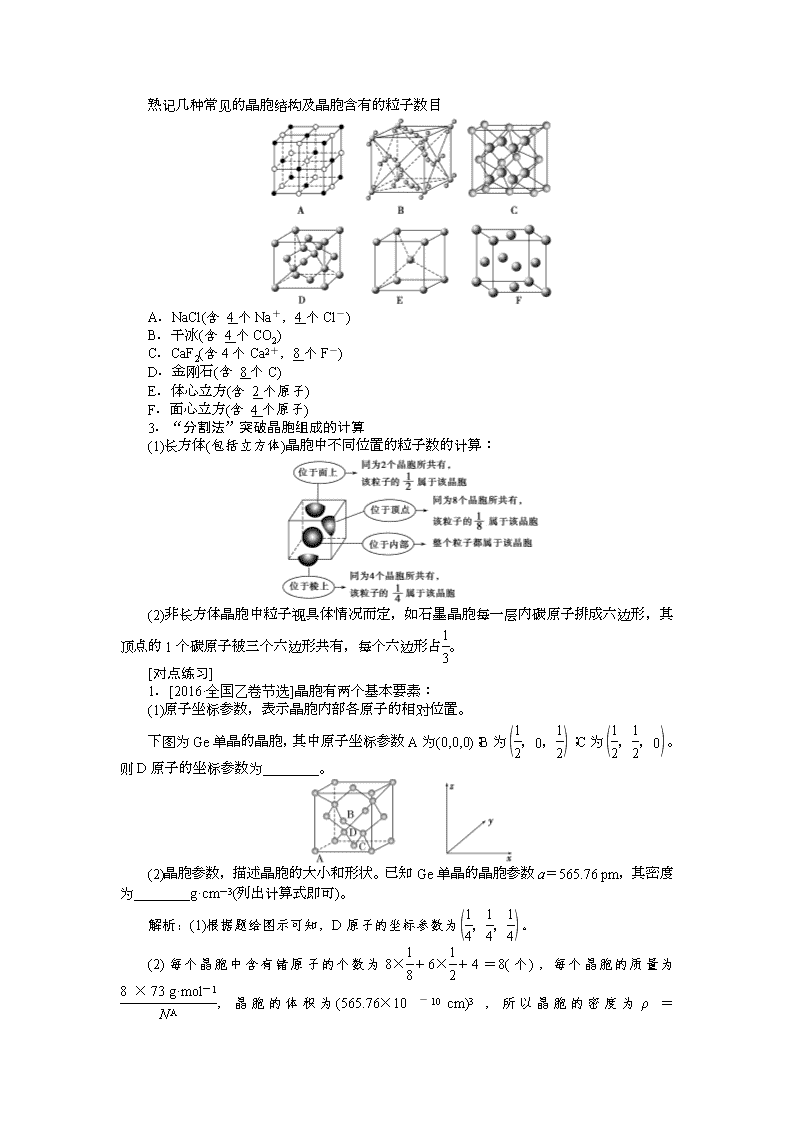
熟记几种常见的晶胞结构及晶胞含有的粒子数目
A.NaCl(含 4个Na+,4个Cl-)
B.干冰(含 4个CO2)
C.CaF2(含4个Ca2+,8个F-)
D.金刚石(含 8个C)
E.体心立方(含 2个原子)
F.面心立方(含 4个原子)
3.“分割法”突破晶胞组成的计算
(1)长方体(包括立方体)晶胞中不同位置的粒子数的计算:
(2)非长方体晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点的1个碳原子被三个六边形共有,每个六边形占。
[对点练习]
1.[2016·全国乙卷节选]晶胞有两个基本要素:
(1)原子坐标参数,表示晶胞内部各原子的相对位置。
下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为;C为。则D原子的坐标参数为________。
(2)晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
解析:(1)根据题给图示可知,D原子的坐标参数为。
(2)每个晶胞中含有锗原子的个数为8×+6×+4=8(个),每个晶胞的质量为,晶胞的体积为(565.76×10-10 cm)3,所以晶胞的密度为ρ=。
答案:(1) (2)×107
2.氧原子和钠原子所形成的一种离子化合物Na2O晶体的晶胞如图所示,则图中黑球代表的离子是________(填离子符号)。
解析:如图所示的Na2O晶胞中,黑球数是8,白球数是8×+6×=4,则黑球代表Na+。
答案:Na+
二、四类晶体比较
1.四类晶体的比较
分子晶体
原子晶体
金属晶体
离子晶体
构成
粒子
分子
原子
金属阳离子、自由电子
阴、阳
离子
粒子间的相互作用力
范德华力
(某些含氢键)
共价键
金属键
离子键
硬度
较小
很大
有的很大,有的很小
较大
熔、
沸点
较低
很高
有的很高,有的很低
较高
溶解性
相似相溶
难溶于任
何溶剂
常见溶剂
难溶
大多易溶于水等极性溶剂
导电性或传热性
一般不导电,
溶于水后有
的导电
一般不具
有导电性
电和热的
良导体
晶体不导电,
水溶液或熔融
状态下导电
物质类
别及
实例
大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外)
部分非金属单质(如金刚石、硅、晶体硼),部分非金属化合物(如SiC、SiO2)
金属单质与
合金(如
Na、Al、Fe、
青铜)
金属氧化物
(如K2O、
Na2O)、强碱
(如KOH、
NaOH)、绝大
多数盐(如
NaCl)
2.判断晶体类型的5种方法
(1)依据构成晶体的粒子和粒子间的作用力判断
①离子晶体的构成粒子是阴、阳离子,粒子间的作用力是离子键。
②原子晶体的构成粒子是原子,粒子间的作用力是共价键。
③分子晶体的构成粒子是分子,粒子间的作用力为分子间作用力(某些含氢键)。
④金属晶体的构成粒子是金属阳离子和自由电子,粒子间的作用力是金属键。
(2)依据物质的分类判断
①金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硅等外)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
③常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有SiC、SiO2等。
④金属单质是金属晶体。
(3)依据晶体的熔点判断
①离子晶体的熔点较高(有的很低)。
②原子晶体熔点很高。
③分子晶体熔点低。
④金属晶体多数熔点高,但也有少数熔点相当低。
(4)依据导电性判断
①离子晶体溶于水及熔融状态时能导电。
②原子晶体一般为非导体。
③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
④金属晶体是电的良导体。
(5)依据硬度和机械性能判断
①离子晶体硬度较大、硬而脆。
②原子晶体硬度大。
③分子晶体硬度小且较脆。
④金属晶体多数硬度大,但也有较低的(如汞),且具有延展性。
3.离子晶体的晶格能
(1)定义
气态离子形成 1_mol离子晶体释放的能量,通常取正值,单位:kJ·mol-1。
(2)影响因素
①离子所带电荷数:离子所带电荷数越多,晶格能越大。
②离子的半径:离子的半径越小,晶格能越大。
(3)与离子晶体性质的关系
晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。
4.晶体熔、沸点高低的比较
(1)不同类型晶体熔、沸点的比较
①不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)同种类型晶体熔、沸点的比较
①原子晶体
→→→
如熔点:金刚石>碳化硅>硅。
②离子晶体
a.一般规律为离子所带的电荷数越多(主要因素)、离子半径越小,熔、沸点就越高,如熔点:Al2O3>MgO>NaCl>CsCl。
b.衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
③分子晶体
a.具有氢键的分子晶体熔、沸点反常的高。如熔、沸点H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如熔、沸点:SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如熔、沸点CO>N2。
d.对于有机物的同分异构体,支链越多,熔、沸点越低。
如熔、沸点:CH3—CH2—CH2—CH2—CH3>
CH3CHCH3CH2CH3>CCH3CH3CH3。CH3
④金属晶体
金属原子半径越小,价电子数越多,其金属键越强,金属熔、沸点越高,如熔、沸点:Na<Mg<Al。
5.熟识五类晶体结构模型
[对点练习]
1.有下列八种晶体:
A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
上述晶体中(答案用字母编号表示):
(1)属于原子晶体的化合物是__________,直接由原子构成的晶体是____________,直接由原子构成的分子晶体是________。
(2)由极性分子构成的晶体是__________,含有共价键的离子晶体是__________,属于分子晶体的单质是________。
(3)在一定条件下能导电而不发生化学变化的是________;受热熔化后化学键不发生变化的是________,需克服共价键的是________。
解析:在题中属于原子晶体的有金刚石和水晶(由硅原子和氧原子构成);属于分子晶体的有冰醋酸、白磷和晶体氩;属于离子晶体的有MgO(由Mg2+和O2-组成)、NH4Cl(由NH和Cl-组成);而Al属于金属晶体,金属的导电是靠自由电子的移动,并不发生化学变化,但金属熔化时金属键就被破坏。分子晶体的熔化只需要克服分子间作用力,而原子晶体、离子晶体熔化时分别需要克服共价键、离子键。
答案:(1)A A、E、H E (2)B F D、E
(3)G B、D、E A、H
2.(2017·大同质检)下列物质的熔、沸点高低顺序正确的是( )
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CF4
C.MgO>H2O>N2>O2
D.金刚石>生铁>钠>纯铁
解析:选B A项,物质全部为原子晶体,判断其熔、沸点高低可比较其原子半径:Si>C>O,故键长关系为Si—Si>Si—C>Si—O>C—C,键长越长,键能越小,故A项中的熔、沸点顺序错误;B项,为同种类型的分子晶体,可比较其相对分子质量大小,相对分子质量越大,熔、沸点越高;C项,N2与O2为同种类型的分子晶体,O2的熔、沸点比N2高;D项,熔、沸点关系为金刚石>纯铁>生铁>钠,合金的熔、沸点比纯金属低。
3. (1)(2016·全国乙卷节选)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________________________________________________。
GeCl4
GeBr4
GeI4
熔点/℃
-49.5
26
146
沸点/℃
83.1
186
约400
(2)(2013·重庆高考节选)BN、MgBr2、SiCl4的熔点由高到低的顺序为_____________________。
(3)(2013·浙江高考节选) NaF的熔点________(填“>”“=”或“<”)BF的熔点,其原因是_______________________________________________________________。
解析:(2)BN为原子晶体,MgBr2为离子晶体,SiCl4 为分子晶体,因而熔点:BN>MgBr2>SiCl4。
答案:(1)GeCl4、GeBr4、GeI4熔沸点依次升高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强 (2)BN>MgBr2>SiCl4 (3)> 两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低
4.(2016·全国甲卷节选)
某镍白铜合金的立方晶胞结构如图所示。
(1)晶胞中铜原子与镍原子的数量比为________。
(2)若合金的密度为d g·cm-3,晶胞参数a=________nm。
解析:(1)由晶胞结构图可知,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,根据均摊法,每个晶胞中含有Cu原子的个数为6×=3,含有Ni原子的个数为8×=1,故晶胞中Cu原子与Ni原子的数量比为3∶1。
(2)根据m=ρV可得, 1 mol晶胞的质量为(64×3+59)g=a3×d g·cm-3×NA,则a= cm=×107 nm。
答案:(1)3∶1 (2)×107
[学案验收·块块过]
1.(2017·宁波模拟)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2NF3+3NH4F。上述化学方程式中的5种物质没有涉及的晶体类型为( )
A.离子晶体 B.分子晶体
C.原子晶体 D.金属晶体
解析:选C 在反应中NH3、F2、NF3的晶体类型为分子晶体,Cu为金属晶体,NH4F为离子晶体。
2.如表给出几种氧化物的熔沸点:
NaCl
MgCl2
CaCl2
SiCl4
熔点(℃)
801
712
782
-68
沸点(℃)
1 465
1 418
1 600
57
对此有下列说法,错误的是( )
A.CaCl2是离子晶体
B.SiCl4是分子晶体
C.KCl的熔沸点比NaCl的高
D.MgCl2水溶液不能导电
解析:选D 从表格中的熔沸点可以看出,前三者为离子晶体,后者为分子晶体,由表格中MgCl2和CaCl2的熔沸点比较可知,下一周期元素的离子键较强,熔沸点高,故C项正确。D项MgCl2水溶液能够导电。
3.下列各组物质中,按熔点由低到高的顺序排列正确的是( )
①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb
④Na、Mg、Al
A.①③ B.①④ C.②③ D.②④
解析:选D ①中Hg在常温下为液态,而I2为固态,故①错误;②中SiO2为原子晶体,其熔点最高,CO是分子晶体,其熔点最低,故②正确;③中Na、K、Rb价电子数相同,其原子半径依次增大,金属键依次减弱,熔点逐渐降低,故③错误;④中Na、Mg、Al价电子数依次增多,原子半径逐渐减小,金属键依次增强,熔点逐渐升高,故④正确。
4.已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法中正确的是( )
A.C3N4是分子晶体
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长长
C.C3N4晶体中每个碳原子连接4个氮原子,而每个氮原子连接3个碳原子
D.C3N4晶体中微粒间通过分子间作用力相结合
解析:选C 根据C3N4的性质可知其为原子晶体,A项错误;C—N键为极性共价键,由于原子半径r(N)水
C.硬度:晶体硅<金刚石
D.碳碳键键长:乙烯>苯
解析:选D 小苏打溶解度小于苏打的溶解度,A正确;溴乙烷的密度大于水的密度,B正确;晶体硅的硬度小于金刚石的硬度,C正确;乙烯的碳碳键长小于苯的碳碳键长,D错误。
4.X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个。下列说法中不正确的是( )
A.X的单质固态时为分子晶体
B.Y的单质为原子晶体
C.X与Y形成的化合物固态时为分子晶体
D.X与碳形成的化合物为分子晶体
解析:选C 由题意可知,X是O,Y是Si。固态O2及O与碳形成的化合物(CO、CO2)均为分子晶体,Si的单质为原子晶体,A、B、D正确;SiO2为原子晶体,C错误。
5.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
解析:选C 本题中属于分子晶体的有SO3、HCl、CO2、SO2、晶体氖、晶体氮、硫黄、碘,属于原子晶体的有SiO2、晶体硼、晶体硅、金刚石,但晶体氖是由稀有气体分子构成的,分子间不存在化学键。
6.
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O
B.晶体中每个K+周围有8个O,每个O周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
解析:选A 由题中的晶胞结构知:有8个K+位于顶点,6个K+位于面心,则晶胞中含有的K+数为8×+6×=4个;有12个O位于棱上,1个O处于中心,则晶胞中含有O数为12×+1=4个,所以超氧化钾的化学式为KO2;每个K+周围有6个O,每个O周围有6个K+,与每个K+距离最近的K+有12个。
7.根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是( )
晶体
NaCl
MgCl2
AlCl3
SiCl4
单质B
熔点/℃
810
710
190
-68
2 300
沸点/℃
1 465
1 418
182.7
57
2 500
(注:AlCl3的熔点在2.02×105 Pa条件下测定。)
A.SiCl4是分子晶体
B.单质B可能是原子晶体
C.AlCl3加热能升华
D.NaCl的键的强度比MgCl2的小
解析:选D 由表中所给熔、沸点数据可知,SiCl4应为分子晶体,A项正确;单质B熔、沸点很高,可能为原子晶体,B项正确;AlCl3的沸点低于熔点,它可升华,C项正确;NaCl的熔、沸点高于MgCl2的,表明Na+与Cl-的键断裂比Mg2+与Cl-的键断裂难,即NaCl的键的强度大于MgCl2的,D项错误。
8.[双选](2014·海南高考节选)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )
A.SiX4难水解
B.SiX4是共价化合物
C.NaX易水解
D.NaX的熔点一般高于SiX4
解析:选BD SiX4的水解比较强烈,如SiCl4+3H2O===H2SiO3↓+4HCl、SiF4+3H2O===H2SiO3↓+4HF,A错误;SiX4全部由非金属元素构成,属于共价化合物,B正确;NaX(除NaF外)属于强酸强碱盐,不发生水解,C错误;NaX属于离子晶体,SiX4属于分子晶体,一般来说,离子晶体的熔点高于分子晶体,D正确。
9.高考组合题
(1)M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。回答下列问题:单质M的晶体类型为____________,晶体中原子间通过________作用形成面心立方密堆积,其中M原子的配位数为________。
(2)(2015·新课标全国卷Ⅰ节选)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于________晶体。
(3)①Cu和O形成的一种离子化合物的晶体结构如图1,则Cu离子的电荷为________。
②H、N、O、S、Cu 5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。
图1 图2
该化合物中,阴离子为________,阳离子中存在的化学键类型有____________;该化合物加热时首先失去的组分是________,判断理由是____________________________________。
(4)(2014·新课标全国卷Ⅰ节选)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度________ g·cm-3(不必计算出结果)。
(5)(2014·山东高考节选)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为__________。
(6)(2014·四川高考节选)Mg与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是________。
(7)(2014·江苏高考节选)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
解析:(1)根据题给信息推断M为铜元素。单质铜的晶体类型为金属晶体,晶体中微粒间通过金属键作用形成面心立方密堆积,铜原子的配位数为12。
(2)该化合物熔点为253 K,沸点为376 K,说明熔沸点较低,所以为分子晶体。(3)①Cu与O能形成两种化合物,根据均摊法可由原子数之比确定化合物的化学式为Cu2O,含Cu+。②5种元素形成的1∶1型离子化合物中,阴离子呈四面体结构的为SO,由图2中的阳离子结构可知含有Cu2+、4个NH3、2个H2O,阳离子符号为[Cu(NH3)4(H2O)2]2+,含有共价键和配位键;加热化合物时根据配位键强弱确定首先失去的成分为H2O。(4)面心立方堆积晶体中,原子的配位数为12;该晶胞中含有Al原子数目为×8+×6=4,根据(0.405×10-7)3×ρ=27×,
解得ρ=。
(5)利用“均摊法”可知该晶胞棱上12个M完全属于该晶胞的M为12×=3,位于晶胞内的9个M完全属于该晶胞,故该晶胞中M原子的个数为12;该晶胞中含有C60的个数为8×+6×=4,因此该晶胞的化学式为M3C60。(6)该晶胞中阳离子的个数为1+8×=2,阴离子的个数为4×+2=4,则阴离子与阳离子的个数比为2∶1。(7)铜晶胞为面心立方晶胞,故每个铜原子周围距离最近的铜原子为4×3=12。
答案:(1)金属晶体 金属键 12
(2)分子 (3)①+1 ②SO42- 共价键和配位键 H2O H2O与Cu2+的配位键比NH3与Cu2+的弱
(4)12
(5)12 M3C60 (6)2∶1 (7)12
10.(2015·新课标全国卷Ⅱ节选)(1)单质O有两种同素异形体,其中沸点高的是________(填分子式),原因是______________________________________________;O和Na的氢化物所属的晶体类型分别为________和________。
(2)O原子和Na原子能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566 nm, F的化学式为________:晶胞中O原子的配位数为______________;列式计算晶体F的密度(g·cm-3)________________________________________________________________________。
解析:(1)O元素形成O2和O3两种同素异形体,固态时均为分子晶体,而分子晶体中,相对分子质量越大,分子间作用力越大,物质的沸点越高,故O3的沸点高于O2。O的氢化物有H2O和H2O2,二者均能形成分子晶体。Na的氢化物为NaH,属于离子晶体。(2)O2-半径大于Na+半径,由F的晶胞结构可知,大球代表O2-,小球代表Na+,每个晶胞中含有O2-个数为8×+6×=4,含有Na+个数为8,故O2-、Na+离子个数之比为4∶8=1∶2,从而推知F的化学式为Na2O。由晶胞结构可知,每个O原子周围有8个Na原子,故O原子的配位数为8。晶胞参数a=0.566 nm=0.566×10-7 cm,则晶胞的体积为(0.566×10-7cm)3,从而可知晶体F的密度为≈2.27 g·cm-3。
答案:(1)O3 O3相对分子质量较大,范德华力大 分子晶体 离子晶体 (2)Na2O 8
≈2.27 g·cm-3
11.
(2013·新课标全国卷Ⅱ节选)前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
(1)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为________________;D的配位数为________;
②列式计算该晶体的密度____________________________________________g·cm-3。
(2)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有________________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是________。
解析:前四周期价电子层中有4个未成对电子的一定是过渡金属元素,前四周期元素中只有3d64s2符合,因而C为Fe元素,顺推出D为Ni元素,B为K元素,A为F元素。
(1)①A(F)原子数=×16+×4+2=8,B(K)原子数=×8+2=4,D(Ni)原子数=×8+1=2,即该化合物的化学式为K2NiF4。D(Ni)的配位体是距其最近的原子A(F),分别在它的前面、后面、左边、右边、上边、下边,共6个A(F)原子。
(2)在K3FeF6中含有K+与[FeF6]3-之间的离子键和[FeF6]3-中Fe3+与F-之间的配位键,在配离子[FeF6]3-中F-是配位体。
答案:(1)①K2NiF4 6
②≈3.38
(2)离子键、配位键 [FeF6]3- F-
12.已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图1所示:
(1)Cu元素基态原子的外围电子排布式为__________________________________。
(2)元素C、N、O的第一电离能由大到小排列顺序为__________________。
(3)配合物A中碳原子的轨道杂化类型为_____________________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:________________________________________________________________________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_______________________________________________________________。
解析:(1)Cu是29号元素,其原子核外有29个电子,根据构造原理知其3d能级上有10个电子、4s能级上有1个电子,基态原子的外围电子排布式为3d104s1。(2)同周期从左向右,元素的第一电离能呈增大趋势,但N元素原子的2p能级处于半满的稳定状态,能量较低,第一电离能高于同周期相邻的元素,所以C、N、O三种元素的第一电离能由大到小的排列顺序是N>O>C。(3)配合物A分子中含有C===O的碳原子的杂化方式为sp2杂化,全部都是单键的碳的杂化方式为sp3杂化。(4)共价单键为σ键,共价双键中一个是σ键一个是π键,所以1 mol氨基乙酸钠中含有σ键的数目为8 mol。(5)一个CO2分子中原子个数为3,价电子数为16,原子个数相等、价电子数相等的微粒为等电子体,则CO2的等电子体为N2O(或SCN-、N等)。(6)利用均摊法知,1个晶胞中O原子个数=1+8×=2,Cu原子个数=4,铜原子和氧原子个数之比=4∶2=2∶1,所以其化学式为Cu2O。
答案:(1)3d104s1 (2)N>O>C (3)sp2杂化、 sp3杂化
(4)8 (5)N2O(或SCN-、N等) (6)Cu2O
相关文档
- 2021届高考化学一轮复习化学实验仪2021-07-0230页
- 2019届高考化学一轮复习化学反应与2021-07-0212页
- 2020版高考一轮复习化学通用版学案2021-07-029页
- 2020届高考化学一轮复习化学平衡的2021-07-0223页
- 2020届高考化学一轮复习化学平衡常2021-07-029页
- 2020届高考化学一轮复习化学反应与2021-07-0223页
- 2020届高考化学一轮复习化学工艺流2021-07-0236页
- 2019届高考化学一轮复习化学反应与2021-07-0211页
- 2020届高考化学一轮复习化学能与热2021-07-0214页
- 2019届高考化学一轮复习化学反应中2021-07-0213页