- 115.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
小专题突破3 “铁三角”综合实验探究
——科学探究与创新意识
[专题精讲]
铁元素有多种价态,化合物种类较多,特别是Fe2+、Fe3+的性质多样,是设置综合实验题恰当的载体。考查内容可涉及物质性质的探究、物质的制备、成分测定、离子检验等,通过上述问题设计,同时可考查仪器的使用、条件的控制、物质的分离提纯、实验安全等化学实验基础知识。
[专题精练]
1.查阅文献可知,难溶于水的FeS2可在Fe2(SO4)3溶液中“溶解”,“溶解”后硫元素都以SO的形式存在。
(1)要判断上述“溶解”过程中发生了哪些化学变化,下列实验及现象可作为判断证据的是__________。
A.观察到溶液的黄色变淡,最后变成淡绿色
B.在Fe2(SO4)3溶液中滴加KSCN溶液显稳定的红色,加入FeS2固体“溶解”后,红色明显变浅
C.取FeS2“溶解”后所得的部分溶液于试管中,再滴加数滴0.5 mol·L-1 BaCl2溶液,有白色浑浊现象产生
(2)写出“溶解”时的离子方程式:_________________________________________。
(3)若要检验“溶解”后溶液中Fe2(SO4)3是否有剩余,简要写出相关的实验操作:________________________________________________________________________。
解析:(1)难溶于水的FeS2可在Fe2(SO4)3溶液中“溶解”,“溶解”后硫元素都以SO的形式存在,说明铁离子把-1价硫元素氧化为+6价,铁离子被还原为亚铁离子,注意原溶液中含有SO。
答案:(1)AB
(2)FeS2+14Fe3++8H2O===15Fe2++2SO+16H+
(3)取少量溶液于试管中,滴加KSCN溶液,若溶液变红,则Fe2(SO4)3有剩余,若不变红,则Fe2(SO4)3没有剩余
2.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________________________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴 KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_____________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
_____________________________________。
(4)丙组同学取10 mL 0.1 mol/L KI溶液,加入6 mL 0.1 mol/L FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为____________________。
解析:(1)Fe2+具有还原性,FeCl2溶液易被氧化而变质,配制FeCl2溶液时加入少量铁屑,目的是防止Fe2+被氧化。(2)溶液变红,说明有Fe3+生成,则FeCl2溶液与氯水反应生成FeCl3,离子方程式为2Fe2++Cl2===2Fe3++2Cl-。(3)甲组实验中,FeCl2易被空气中的O2氧化生成FeCl3,因此实验不够严谨。加入煤油,煤油的密度比水小,可以起到隔绝空气的作用,从而排除氧气对实验的影响。(4)实验②中K3[Fe(CN)6]溶液的作用是检验Fe2+。根据实验①,CCl4层显紫色,说明有I2生成,根据实验②,生成蓝色沉淀,说明有Fe2+生成,根据实验③,溶液变红,说明有Fe3+剩余,在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该反应为可逆反应。
答案:(1)防止Fe2+被氧化
(2)2Fe2++Cl2===2Fe3++2Cl-
(3)隔绝空气(排除氧气对实验的影响)
(4)Fe2+ Fe3+ 可逆反应
3.(2020·石家庄一模)草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
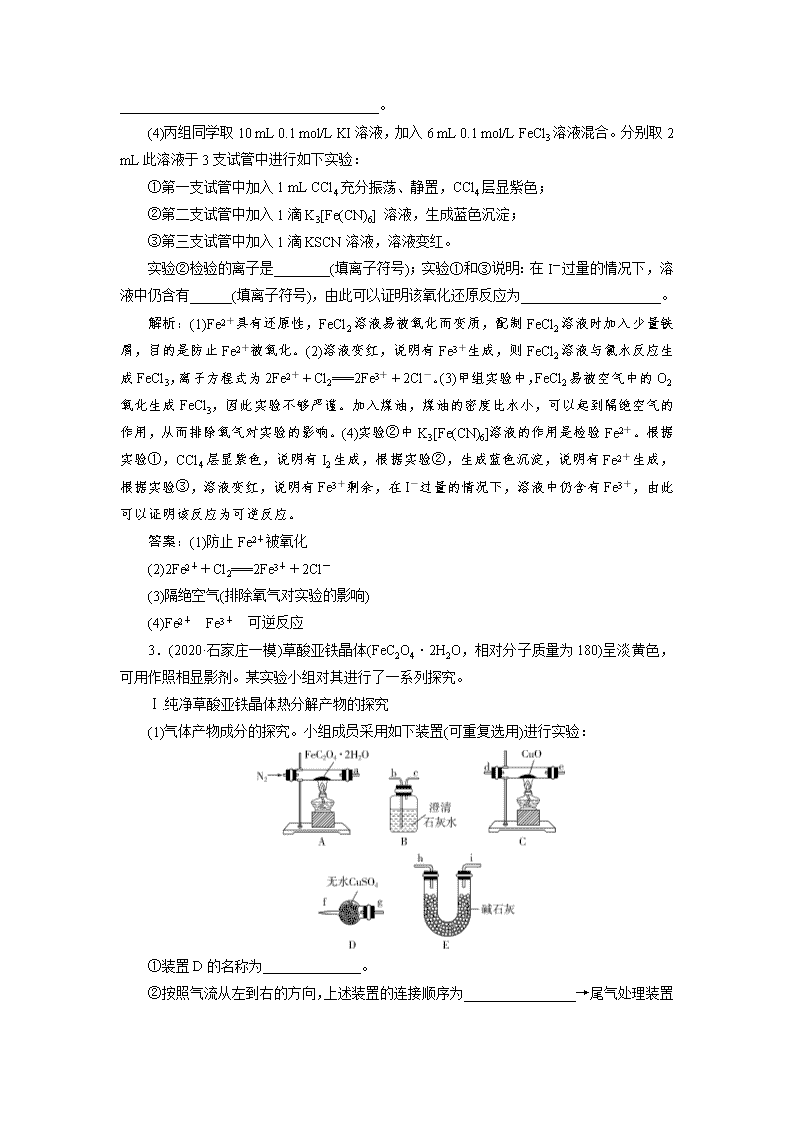
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
①装置D的名称为______________。
②按照气流从左到右的方向,上述装置的连接顺序为________________→
尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为___________________________________。
④实验证明气体产物中含有CO,依据的实验现象为________________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为________________________________________________________________________。
(3)依据(1)和(2)中结论,可知A处反应管中发生反应的化学方程式为_____________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250 mL溶液;
步骤2:取上述溶液25.00 mL,用c mol·L-1 KMnO4标准液滴定至终点,消耗标准液V1 mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用c mol·L-1 KMnO4标准溶液滴定至终点,消耗标准液V2 mL。
(4)步骤3中加入锌粉的目的为_________________________________________。
(5)草酸亚铁晶体样品的纯度为_________________________________(列出计算式即可,不必化简);
若步骤1配制溶液时部分Fe2+被氧化,则测定结果将________(填“偏高”“偏低”或“不变”)。
解析:(1)②草酸亚铁晶体在装置A中受热分解,通过装置D检验水蒸气的存在,通过装置B检验二氧化碳的存在,通过装置E除去二氧化碳并干燥气体,通过装置C检验一氧化碳,再通过装置B检验生成的二氧化碳气体,最后进行尾气处理;③实验前先通入一段时间N2,把装置内空气赶尽,防止加热时发生爆炸。(3)依据(1)和(2)中结论,可知A处反应管中发生的反应是草酸亚铁晶体分解生成氧化亚铁、一氧化碳、二氧化碳和水。(4)向反应后溶液中加入适量锌粉是为了将Fe3+还原为Fe2+。(5)草酸亚铁溶液中滴入高锰酸钾溶液发生氧化还原反应,亚铁离子和草酸根离子都被氧化;向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用c mol·L-1 KMnO4标准液滴定至终点,消耗标准液V2 mL,此时滴定的是亚铁离子,则C2O消耗KMnO4的物质的量为 c(V1-V2)×10-3 mol,利用化学反应定量关系计算即可。若步骤1配制溶液时部分Fe2+被氧化,导致V1偏小,测定结果偏低。
答案:(1)①(球形)干燥管 ②agfbchi(或ih)de(或ed)bc
③排尽装置中的空气,防止加热时发生爆炸 ④C处反应管中固体由黑变红,其后装置中澄清石灰水变浑浊
(2)取固体少许溶于稀硫酸,无气体生成
(3)FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O
(4)将Fe3+还原为Fe2+
(5)×100% 偏低
相关文档
- 2021届高考化学一轮复习化学实验仪2021-07-0230页
- 2019届高考化学一轮复习化学反应与2021-07-0212页
- 2020版高考一轮复习化学通用版学案2021-07-029页
- 2020届高考化学一轮复习化学平衡的2021-07-0223页
- 2020届高考化学一轮复习化学平衡常2021-07-029页
- 2020届高考化学一轮复习化学反应与2021-07-0223页
- 2020届高考化学一轮复习化学工艺流2021-07-0236页
- 2019届高考化学一轮复习化学反应与2021-07-0211页
- 2020届高考化学一轮复习化学能与热2021-07-0214页
- 2019届高考化学一轮复习化学反应中2021-07-0213页