- 714.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012届高考化学二轮专题复习:实验专题训练(一)
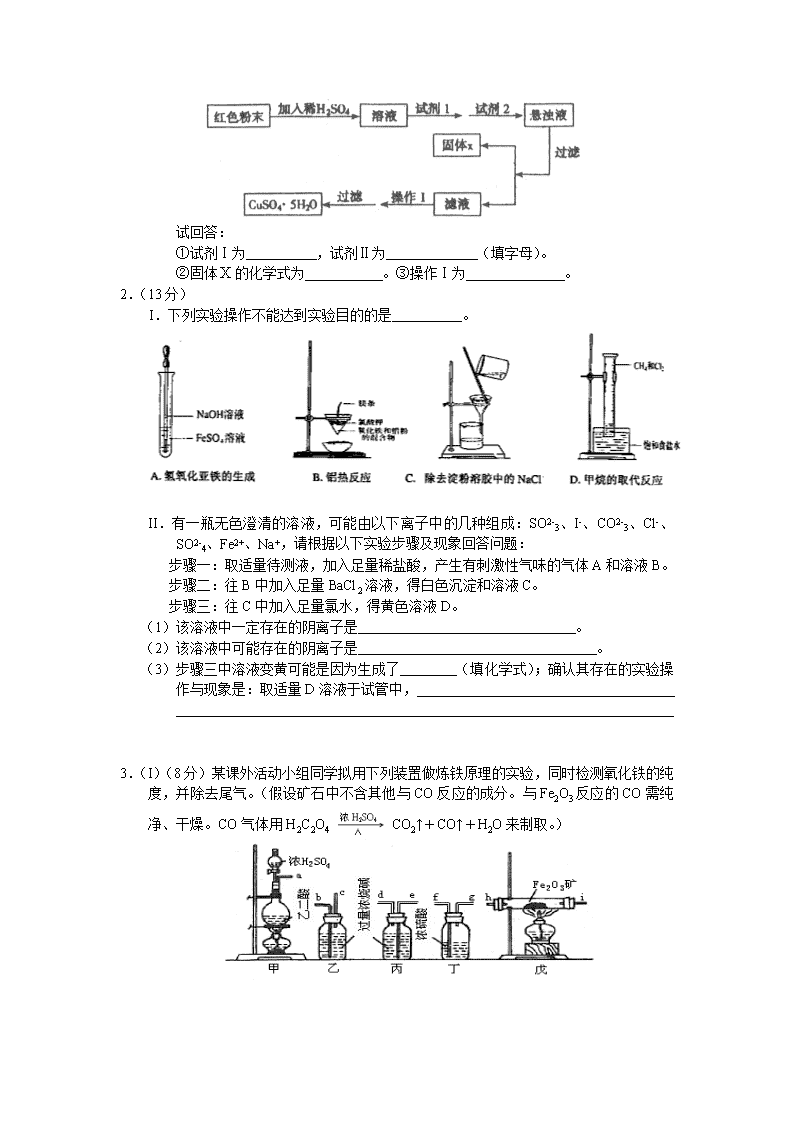
1.(16分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是、或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是 假设2:红色粉末是
假设3:红色粉末是和的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加试剂。
(1)若假设1成立, 则实验现象是 。
(2)若滴加试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?请回答问题并简述你的理由(不需写出反应的方程式)
(3)若固体粉末完全溶解无固体存在,滴加试剂时溶液不变红色,则证明原固体粉末是 ,写出发生反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为和的混合物。
(4)实验小组欲用加热法测定的质量分数。取固体粉末在空气中充分加热,待质量不再变化时,称其质量为(),则混合物中的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾()。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使、、分别生成沉淀的如下:
物质
开始沉淀pH
6.0
7.5
1.4
沉淀完全pH
13
14
3.7
实验室有下列试剂可供选择:
A.氯水 B.H2O2 C. D.
实验小组设计如下实验方案:
试回答:
①试剂Ⅰ为 ,试剂Ⅱ为 (填字母)。
②固体的化学式为 。③操作Ⅰ为 。
2.(13分)
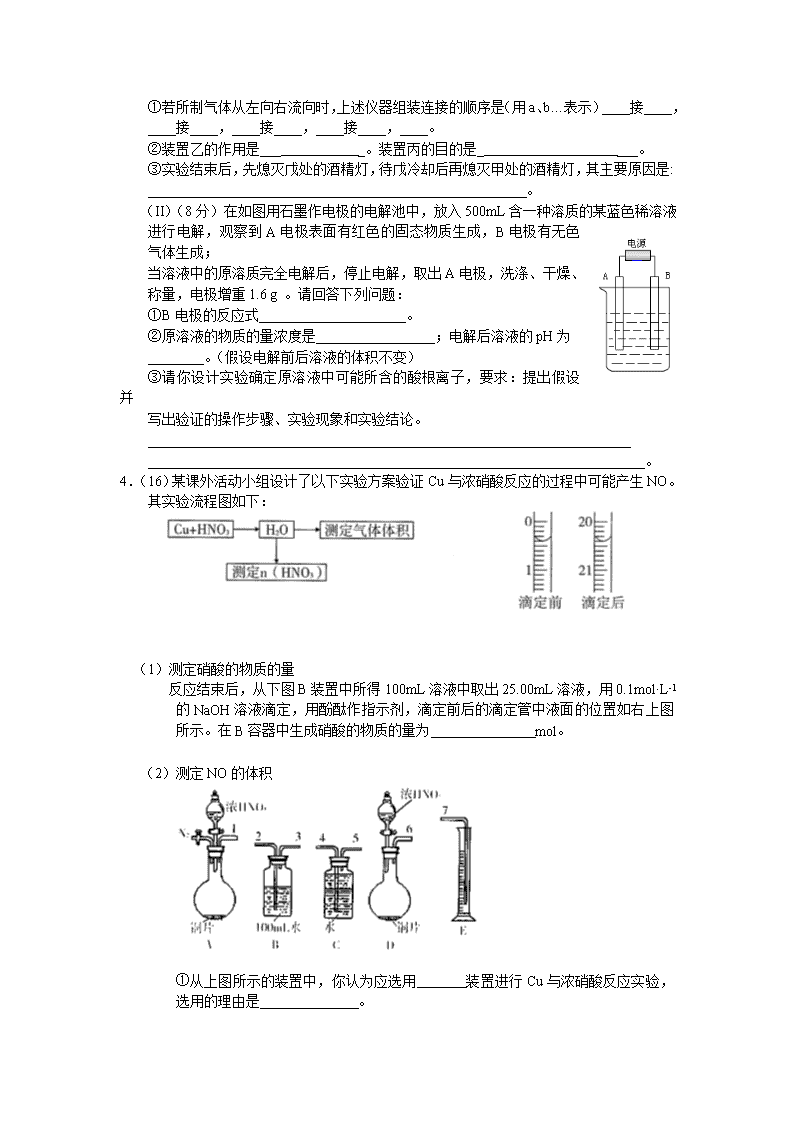
I.下列实验操作不能达到实验目的的是 。
II.有一瓶无色澄清的溶液,可能由以下离子中的几种组成:SO2-3、I-、CO2-3、Cl-、SO2-4、Fe2+、Na+,请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B。
步骤二:往B中加入足量BaCl2溶液,得白色沉淀和溶液C。
步骤三:往C中加入足量氯水,得黄色溶液D。
(1)该溶液中一定存在的阴离子是 。
(2)该溶液中可能存在的阴离子是 。
(3)步骤三中溶液变黄可能是因为生成了 (填化学式);确认其存在的实验操作与现象是:取适量D溶液于试管中,
3.(I)(8分)某课外活动小组同学拟用下列装置做炼铁原理的实验,同时检测氧化铁的纯度,并除去尾气。(假设矿石中不含其他与CO反应的成分。与Fe2O3反应的CO需纯净、干燥。CO气体用H2C2O4 CO2↑+CO↑+H2O来制取。)
①若所制气体从左向右流向时,上述仪器组装连接的顺序是(用a、b…表示)____接____,____接____,____接____,____接____,____。
②装置乙的作用是___ _。装置丙的目的是_ ___。
③实验结束后,先熄灭戊处的酒精灯,待戊冷却后再熄灭甲处的酒精灯,其主要原因是:
_ 。
(II)(8分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;
当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、
称量,电极增重1.6 g 。请回答下列问题:
①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为
________。(假设电解前后溶液的体积不变)
③请你设计实验确定原溶液中可能所含的酸根离子,要求:提出假设并
写出验证的操作步骤、实验现象和实验结论。
_____________________________________________________________________
_______________________________________________________________________。
4.(16)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定硝酸的物质的量
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为 mol。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Cu与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来完成实验并测定生成NO体积的装置,其合理的连接顺序是(填各导管口编号) 。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析:若实验测得NO的体积为112.0mL(已折算到标准状况),则Cu与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
(4)实验前,用托盘天平称取的铜片至少应为 g。
5.(16分)有一固体样品,其中只含有和.为了测定样品中的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中的质量分数。
请填写下列各空:
(1)应选用的装置是(只写装置的代号,装置不重复)_________________,所选用装置的连接顺序是(填接口的字母):_______接_______,_______接_______,_______接_______ 。
(2)装置⑥中应盛放的试剂是__________________,其作用是_____________________。
(3)选用的装置连接好后,最后一个装置的作用是_______________________________。
(4)写出吸收CO2的离子方程式____________________________________。
(5)停止加热时,正确的操作是____________________________________。
(6)取m g固体样品实验,经测定m g固体样品在加热时,完全分解,可得,则m g样品中所含。的质量分数为________________________________。(用含m、a的代数式表示)
参考答案
1.(16分)(1)溶液变为血红色(1分)
(2)不合理,生成的能将还原为(2分)
(3)和的混合物(1分)
(各2分,共6分)
(4)(2分)
(5)① B D( 2分) ②(1分) ③加热蒸发(1分)
2.(13分)
I.C(2分)
II.(1)SO2-3、SO2-4、I-(写对1个2分,写对2个3分,全对4分,答案数多于3个零分)
(2)CO2-3、Cl-(写对1个2分,全对3分,答案数多于2个零分)
(3)I2(2分);加入淀粉溶液,溶液变蓝。(2分)(其他合理答案同等给分)
3.(每空2分)(I)(本小题8分)①a e d f g h i b c
②吸收CO2,点燃CO除去尾气;除去混在CO中的CO2 ③防止生成的Fe又被氧化
(II)(本小题8分) ①4OH――4e-=2H2O+O2↑ ②0.05mol/L 1
③①假设原溶液中的酸根离子是硫酸根离子。取电解后的溶液,向其中加入BaCl2溶液,若有白色沉淀生成,则原溶液中所含的阴离子是SO42-;;②假设原溶液中的酸根离子是硝酸根离子。取电解后的溶液,向其中加入铜,微热,若铜溶解,并有无色气体生成,且在空气中变为红棕色,则原溶液中所含的阴离子是NO3-。
4.(每空2分,共16分)
(1)0.008(2分
(2)A(2分,因为A装置可以通N2装装置中的空气排尽,防止反应生成的NO被装置内空气中O2氧化(2分) ②123457(2分,若只填出“1547”给1分)
③升高(2分
(3)有(2分)
因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6mL<112.0mL)(2分)
(4)0.5(2分)
5.(16分)
(1)②⑥⑦⑧
B G,F I,H J
(2)浓 吸收反应生成的水
(3)防止溶液吸收空气中的,造成实验误差
(4)
(5)先将连接② ⑥装置的橡皮管卸下后,再撤去酒精灯
(6)
或