- 909.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1节 原子结构与性质
[考试说明] 1.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。2.了解电离能的含义,并能用以说明元素的某些性质。3.了解电子在原子轨道之间的跃迁及其简单应用。4.了解电负性的概念,并能用以说明元素的某些性质。
[命题规律] 本节是高考的必考点,高考中对本节知识点的考查为:对原子结构的考查,常常指定原子或离子,然后写出其基态电子排布式或电子排布图或价层电子排布式;对元素性质的考查,通常是比较元素第一电离能的大小,并从原子结构角度解释原因。
考点1 原子结构
知识梳理
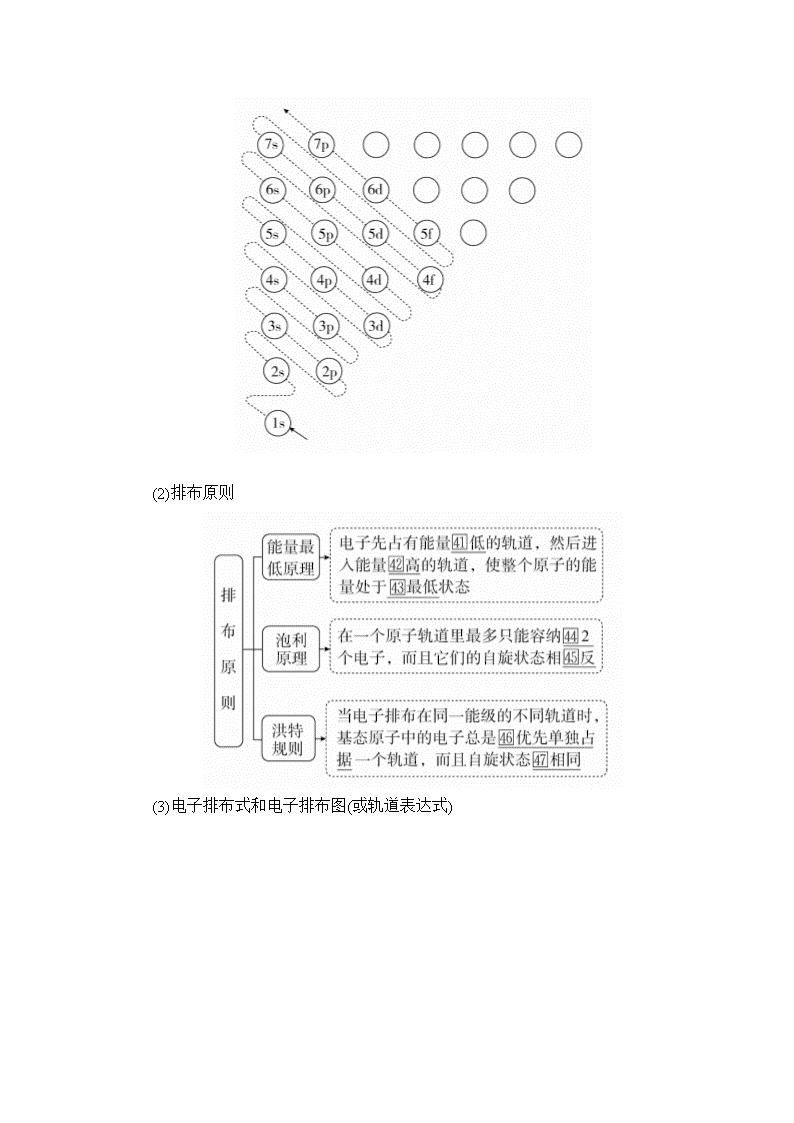
1.能层、能级与原子轨道
(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N、O、P、Q……表示相应的第一、二、三、四、五、六、七……能层,能量依次升高。
(2)能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即:E(s)Al,P>S。
b.同族元素:从上至下第一电离能逐渐减小。
c.同种原子:随着电子的逐个失去,阳离子所带的正电荷数越来越多,再失去电子需克服的电性引力越来越大,消耗的能量越来越大,逐级电离能越来越大(即I1②>①
B.原子半径:③>②>①
C.电负性:③>②>①
D.第一电离能:③>②>①
答案 D
解析 根据核外电子排布式可知①是S,②是P,③是F。F无正价,A错误;同周期主族元素自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径:②>①>③,B错误;同周期自左向右元素的电负性逐渐增大,同主族自上而下元素的电负性逐渐减小,则电负性:③>①>②,C错误;同周期主族元素自左向右第一电离能呈增大趋势,但P的3p轨道电子处于半充满状态,稳定性强,第一电离能大于S,同主族从上到下第一电离能逐渐减小,则第一电离能:③>②>①,D正确。
3.已知元素X、Y同周期,且电负性X>Y,下列说法错误的是( )
A.X的原子序数一定大于Y
B.第一电离能Y一定小于X
C.X和Y在形成化合物时,X显负价、Y显正价
D.气态氢化物的稳定性:HmX大于HnY
答案 B
解析 由电负性大小可知X在Y的右边,A、C、D均正确;如果Y、X分别是ⅤA、ⅥA族,因为第ⅤA族最外层p能级半充满,所以Y的第一电离能大于X,B错误。
4.碲化锌(ZnTe)具有宽禁带的特性,常用于制作半导体材料,在太阳能电池、太赫兹器件、波导以及绿光光电二极管等方面具有良好应用前景。
(1)碲(Te)元素在周期表中的位置:____________;核外未成对电子数有________个。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量,第一电离能Zn________Ga(填“>”“<”或“=”)。
(3)基态锌原子的核外电子排布式为[Ar]________。
答案 (1)第五周期第ⅥA族 2
(2)> (3)3d104s2
解析 (1)碲的核电荷数为52,与氧元素同主族,位于周期表中第五周期第ⅥA族;碲的基态原子电子排布式为[Kr]4d105s25p4,则根据泡利不相容原理及洪特规则可知,其核外5p轨道上有2个未成对电子。
(2)(3)Zn的核外电子排布式为[Ar]3d104s2,Ga的核外电子排布式为[Ar]3d104s24p1,Zn的4p轨道为全空结构,相对稳定,其第一电离能大于Ga。
高考真题实战
1.(2018·高考题组)(1)(全国卷Ⅰ)①下列Li原子电子排布图表示的状态中,能量最低和最高的分别是________、________(填标号)。
②Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是
_________________________________________________________________。
(2)(全国卷Ⅲ)①Zn原子核外电子排布式为____________________。
②黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是_____________________。
(3)(全国卷Ⅲ)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
答案 (1)①D C ②Li+核电荷数较大
(2)①[Ar]3d104s2或1s22s22p63s23p63d104s2
②大于 Zn核外电子排布为全满稳定结构,较难失电子
(3) 哑铃(纺锤)
解析 (1)①根据核外电子排布规律可知Li的基态核外电子排布式为1s22s1,则D中能量最低;C中有2个电子处于2p能级上,能量最高。
②由于锂的核电荷数较大,原子核对最外层电子的吸引力较大,因此Li+的半径小于H-。
(2)①Zn是第30号元素,所以核外电子排布式为[Ar]3d104s2或1s22s22p63s23p63d104s2。
②Zn的第一电离能大于Cu的第一电离能,原因是Zn的核外电子排布已经达到了每个能级都是全满的稳定结构,所以失电子比较困难。
(3)基态Fe原子的核外电子排布式为
1s22s22p63s23p63d64s2,则其价层电子的电子排布图(轨道表达式)为
;基态S原子的核外电子排布式为1s22s22p63s23p4,则电子占据的最高能级是3p,其电子云轮廓图为哑铃(纺锤)形。
2.(2017·高考题组)(1)(全国卷Ⅰ)①元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为________nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8
E.766.5
②基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________________。
(2)(全国卷Ⅱ)①氮原子价层电子的轨道表达式(电子排布图)为________________________。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______________________;氮元素的E1呈现异常的原因是______________________________。
(3)(全国卷Ⅲ)Co基态原子核外电子排布式为____________。元素Mn与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(4)(江苏高考)①Fe3+基态核外电子排布式为____________。
②C、H、O三种元素的电负性由小到大的顺序为____________。
答案 (1)①A ②N 球形
(2)① ②
同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子
(3)[Ar]3d74s2 O Mn
(4)①[Ar]3d5或1s22s22p63s23p63d5 ②HINi的原因是____________________________。
(3)(全国卷Ⅲ)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“大于”或“小于”)
(4)(四川高考)
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。则R基态原子的电子排布式是________,X和Y中电负性较大的是________(填元素符号)。
答案 (1)①3d104s24p2 2 ②O>Ge>Zn
(2)1s22s22p63s23p63d84s2或[Ar]3d84s2 2
铜失去的是全充满的3d10电子,镍失去的是4s1电子
(3)大于 小于 (4)1s22s22p63s1或[Ne]3s1 Cl
解析 (1)①在元素周期表中,锗位于硅正下方,锗的原子序数为14+18=32,基态原子的核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,未成对电子数为2。②锌、锗位于同周期,同一周期从左至右元素的电负性逐渐增大(稀有气体元素除外),而氧位于元素周期表右上角,电负性仅次于氟,由此得出氧、锗、锌的电负性依次减小。
(2)Ni元素原子核外有28个电子,电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。3d能级上有2个未成对电子。Cu、Ni失去一个电子后电子排布式分别为[Ar]3d10、[Ar]3d84s1,铜的3d轨道全充满,达到稳定状态,所以Cu的第二电离能相对较大。
(3)同周期主族元素从左到右,原子半径逐渐减小,第一电离能呈增大趋势。
(4)由M基态原子L层中p轨道电子数是s轨道电子数的2倍,可知M为O元素;R是同周期元素中最活泼的短周期金属元素,且原子序数大于O元素,故R为Na元素;X和M形成的一种化合物是引起酸雨的主要大气污染物,故X为S元素,Y为Cl元素;Z的基态原子4s和3d轨道半充满,故其电子排布式为1s22s22p63s23p63d54s1,故Z为Cr元素。R为Na元素,其基态原子的电子排布式为1s22s22p63s1;电负性较大的是Cl元素。
相关文档
- 2021届高考化学一轮复习化学实验仪2021-07-0230页
- 2019届高考化学一轮复习化学反应与2021-07-0212页
- 2020版高考一轮复习化学通用版学案2021-07-029页
- 2020届高考化学一轮复习化学平衡的2021-07-0223页
- 2020届高考化学一轮复习化学平衡常2021-07-029页
- 2020届高考化学一轮复习化学反应与2021-07-0223页
- 2020届高考化学一轮复习化学工艺流2021-07-0236页
- 2019届高考化学一轮复习化学反应与2021-07-0211页
- 2020届高考化学一轮复习化学能与热2021-07-0214页
- 2019届高考化学一轮复习化学反应中2021-07-0213页