- 755.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1课时 认识同周期元素性质的递变规律
核心素养发展重点
学业要求
结合实验事实认识元素性质呈周期性变化的规律。
1.以第3周期元素为例,掌握同周期元素性质的递变规律。
2.能运用原子结构理论初步解释同周期元素性质的递变规律。
学生自主学习
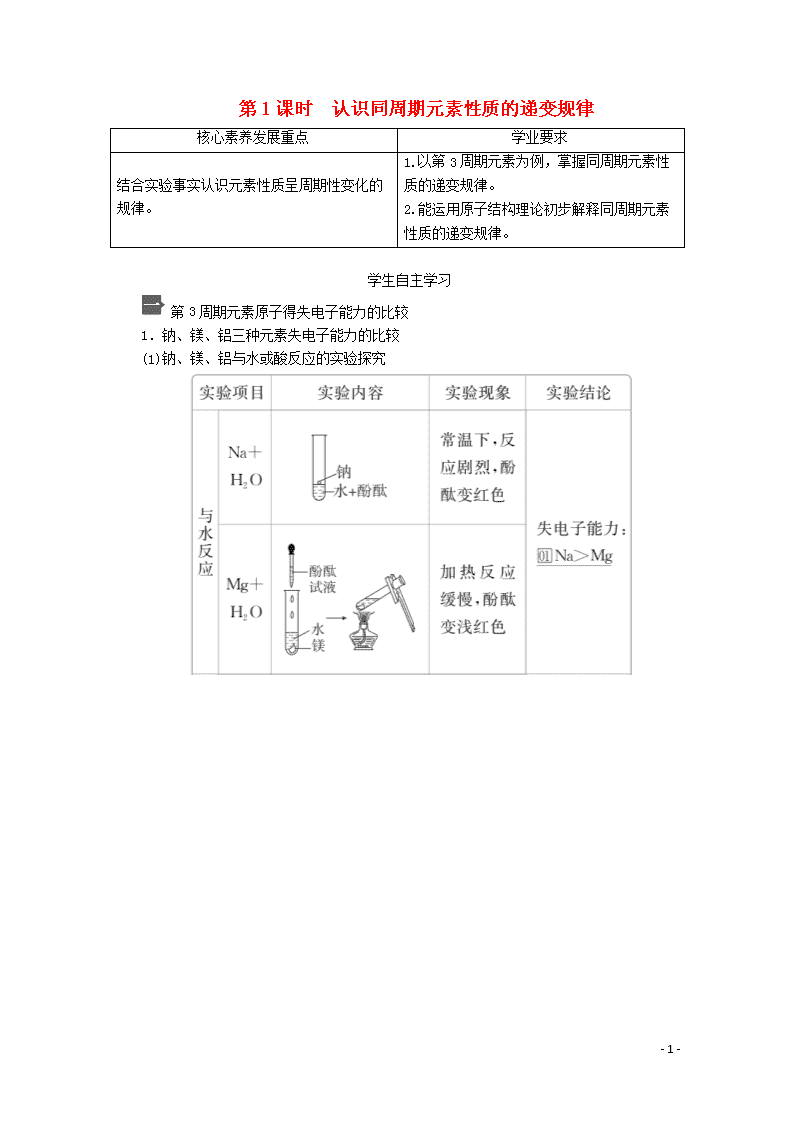
第3周期元素原子得失电子能力的比较
1.钠、镁、铝三种元素失电子能力的比较
(1)钠、镁、铝与水或酸反应的实验探究
- 9 -
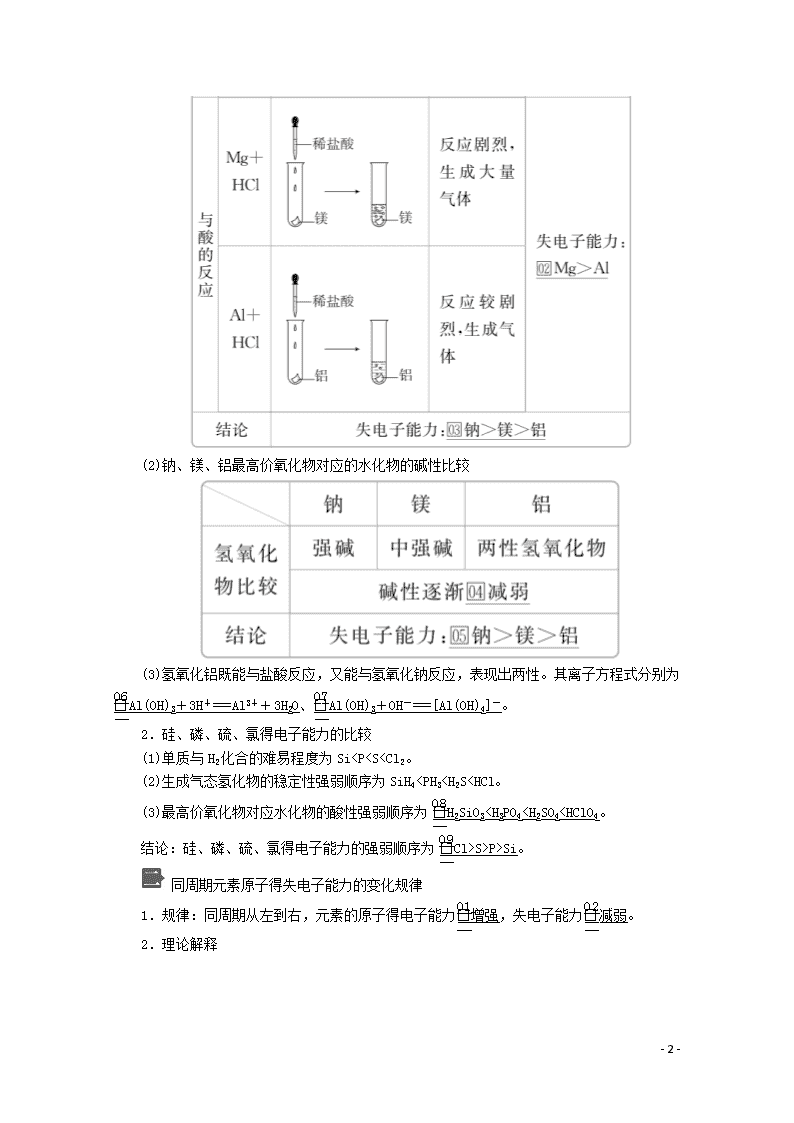
(2)钠、镁、铝最高价氧化物对应的水化物的碱性比较
(3)氢氧化铝既能与盐酸反应,又能与氢氧化钠反应,表现出两性。其离子方程式分别为Al(OH)3+3H+===Al3++3H2O、Al(OH)3+OH-===[Al(OH)4]-。
2.硅、磷、硫、氯得电子能力的比较
(1)单质与H2化合的难易程度为SiS>P>Si。
同周期元素原子得失电子能力的变化规律
1.规律:同周期从左到右,元素的原子得电子能力增强,失电子能力减弱。
2.理论解释
- 9 -
课堂互动探究
一、元素原子失电子能力的判断
1.元素原子得(失)电子数目越多,得(失)电子能力越强吗?
提示:元素原子得失电子能力只与得失电子的难易程度有关,而与得失电子的数目无关。
2.同周期元素性质的递变与元素原子的核外电子排布是否有关?
提示:同周期元素性质的递变与元素原子的核外电子排布有关系,因为同周期从左到右元素的原子半径逐渐减小,原子核对核外电子的吸引力逐渐增强,导致得电子能力逐渐增强,失电子能力逐渐减弱。
1.同周期元素原子失电子能力的递变规律
同周期各元素原子的核外电子层数相同,从左到右,核电荷数依次增多,原子半径逐渐减小(稀有气体元素除外),原子核对核外电子的吸引力逐渐增强,原子失电子能力逐渐减弱,金属性逐渐减弱。
2.同周期元素从左到右性质的递变规律
根据第3周期元素性质的递变规律可总结出同周期元素性质的递变规律如下表:
项目
同周期元素(稀有气体元素除外,从左到右)
核电荷数
依次增多
最外层电子数
由1递增至7(第1周期除外)
主要化合价
一般情况下,最高化合价由+1递增到+7(O、F除外),最低化合价由-4递增到-1
原子半径
逐渐减小
元素原子得失电子能力
失电子能力逐渐减弱
金属性与非金属性
金属性逐渐减弱
知识拓展
元素原子失去电子能力的判断依据
- 9 -
(1)金属活动性顺序表中越靠前,金属原子失电子能力越强。
(2)同一周期的金属元素,从左往右,原子失电子能力依次减弱。
(3)金属与水或酸置换出氢时,置换反应越容易发生,金属原子失电子能力越强。
(4)金属与盐溶液反应,较活泼金属(失电子能力强)置换出较不活泼的金属。
(5)最高价氧化物对应的水化物碱性越强,失电子能力越强。
1.下列比较金属性相对强弱的方法或依据正确的是( )
A.根据金属失电子的多少来确定,失电子较多的金属性较强
B.用Na来置换MgCl2溶液中的Mg,来验证Na的金属性强于Mg
C.根据Mg不与NaOH溶液反应而Al能与NaOH溶液反应,说明金属性:Al>Mg
D.根据碱性:NaOH>Mg(OH)2>Al(OH)3,可说明钠、镁、铝金属性依次减弱
答案 D
解析 A项应该根据金属失电子的难易来决定,易失电子的金属性较强,不正确;B项中钠首先要跟MgCl2溶液中的水反应,不能置换出Mg,不正确;C项判断依据错误;D正确。
2.有三种金属元素A、B、C,在相同条件下,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强;A可以从C的盐溶液中置换出C。则这三种元素的金属性由强到弱的顺序正确的是( )
A.A>B>C B.B>A>C
C.B>C>A D.C>B>A
答案 B
解析 根据元素金属性强弱的比较方法及题意可知,由于B的最高价氧化物的水化物碱性比A的强,所以元素B的金属性比A的强;由于A可以从C的盐溶液中置换出C,所以A的金属性比C的强,故选B。
规律方法
比较元素的金属性强弱,可根据金属与水、酸反应的剧烈程度以及最高价氧化物对应水化物的碱性强弱等多个角度判断,注意把握比较的角度,结合常见物质的性质解答。
二、元素原子得电子能力强弱的判断
1.非金属元素单质与H2反应的条件越难,生成相应的氢化物越稳定?
提示:不对。非金属元素单质与H2反应的条件越易,生成相应的氢化物才越稳定。
2.由H2SO4的酸性大于HClO的酸性,可推断S的非金属性大于Cl的非金属性?
提示:不对。因为HClO不是Cl元素最高价氧化物对应的水化物,无法判断两者的非金属性强弱。
1.同周期元素原子得电子能力的递变规律
- 9 -
在同一周期中,各元素原子的核外电子层数相同,但从左至右核电荷数依次增大,原子半径逐渐减小(稀有气体元素除外),原子核对外层电子的吸引力逐渐增大,原子得电子能力逐渐增强,非金属性逐渐增强。
2.探究硅、磷、硫、氯元素原子得电子能力强弱
知识拓展
一、元素原子得到电子能力的判断依据
(1)同周期的非金属元素,从左到右得电子能力依次增强(不包括稀有气体)。
(2)非金属元素最高价氧化物对应水化物的酸性越强,得电子能力越强。
(3)非金属元素的单质与氢气化合越容易,得电子能力越强;生成的气态氢化物越稳定,得电子能力越强。
(4)不同的非金属单质M和N在溶液中发生置换反应,若M能置换出N,则得电子能力M>N。
二、铝及其重要化合物
(一)铝
1.存在:铝在地壳中的含量仅次于氧和硅,居第三位。
2.物理性质:银白色固体,质软,密度小,导电性仅次于金、银和铜。
3.化学性质
(1)与酸反应:2Al+6HCl===2AlCl3+3H2↑。
- 9 -
(2)与碱溶液反应:2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑。
(3)与非金属反应:4Al+3O22Al2O3。
(4)铝热反应:2Al+Fe2O32Fe+Al2O3。
4.合金及其制品
(1)形成:铝中加入其他元素(如铜、镁、硅、锌、锂等)熔合而形成铝合金。
(2)性能:密度小、强度高、塑性好、易于成型、制造工艺简单、成本低廉等。
(二)铝的重要化合物
1.氧化铝(Al2O3)——两性氧化物
(1)物理性质
氧化铝是难溶于水的白色固体。
(2)化学性质
Al2O3属于两性氧化物,既能与强酸反应,又能与强碱反应,离子方程式分别为:Al2O3+6H+===2Al3++3H2O,Al2O3+2OH-+3H2O===2[Al(OH)4]-。
2.氢氧化铝[Al(OH)3]——两性氢氧化物
(1)物理性质:氢氧化铝是难溶于水的白色胶状固体。
(2)化学性质
Al(OH)3属于两性氢氧化物,既能与强酸反应,又能与强碱反应,反应的离子方程式分别为:
Al(OH)3+3H+===Al3++3H2O,
Al(OH)3+OH-===[Al(OH)4]-。
(3)制备
可以通过可溶性铝盐与碱反应制得,如AlCl3溶液与氨水反应的离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH。
(三)铝及其化合物间的转化关系
(四)有关铝及其化合物图像问题的判断及计算
- 9 -
3.下列关于元素性质的有关叙述中不正确的是( )
A.S、Cl的原子半径依次减小
B.Na、Mg的失电子能力依次增强
C.O、F的简单氢化物的稳定性依次增强
D.Si、P的最高价含氧酸的酸性依次增强
答案 B
解析
- 9 -
同周期从左向右原子半径减小,则S、Cl的原子半径依次减小,故A正确;同周期从左向右金属性减弱,则Na、Mg的失电子能力依次减弱,故B错误;非金属性越强,对应氢化物越稳定,则O、F的简单氢化物的稳定性依次增强,故C正确;非金属性越强,对应最高价含氧酸的酸性越强,则Si、P的最高价含氧酸的酸性依次增强,故D正确。
4.向一定量的下列物质中逐滴加入氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解。这种物质是( )
A.MgSO4 B.Na[Al(OH)4]
C.AlCl3 D.FeCl3
答案 C
解析 AlCl3与NaOH反应先生成Al(OH)3沉淀,继续加入NaOH,Al(OH)3溶解生成Na[Al(OH)4]。
规律方法
(1)非最高价氧化物对应水化物的酸性强弱无法比较元素非金属性的强弱。如不能用酸性HClOCl。
(3)无氧酸的酸性强弱与元素非金属性强弱无必然联系。如不能用酸性HCl>H2S说明非金属性Cl>S。
本课小结
1.同周期主族元素(稀有气体元素除外)原子结构与性质的递变规律
- 9 -
2.
- 9 -