- 597.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
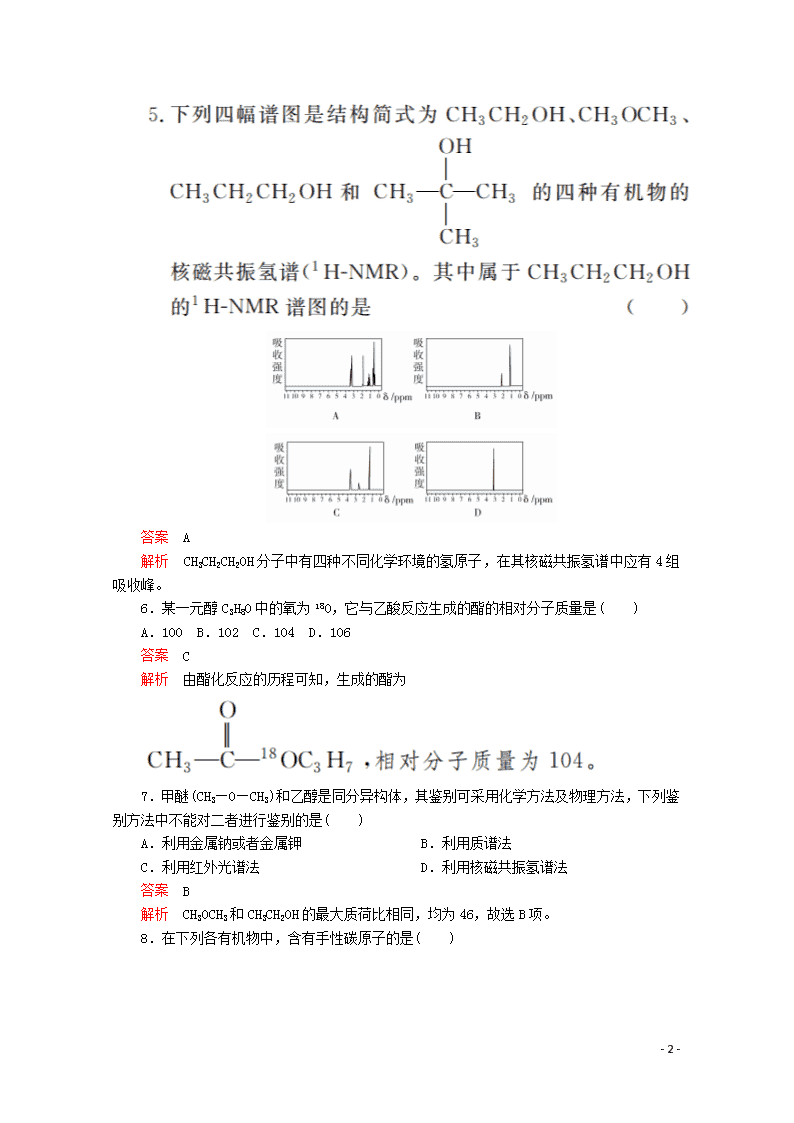
- 网站客服QQ:403074932
专题1 专题过关检测
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
第Ⅰ卷(选择题,共48分)
一、选择题(共16个小题,每小题3分,共48分)
1.下列说法中正确的是( )
A.有机物都是从有机体中分离出来的物质
B.有机物都是共价化合物
C.有机物不一定都不溶于水
D.有机物不具备无机物的性质
答案 C
解析 A.有机物开始是从有机体中分离出来的,后来进行了人工合成。B.有机化合物大部分是共价化合物,但有些是离子化合物,如醋酸铵等。C.部分有机物溶于水,而且有些能与水互溶,如乙醇、乙酸等。D.有机物与无机物在性质上没有严格的界线,如乙酸与硝酸在溶解性、挥发性、酸性等方面均相似。
2.能够快速、微量、精确的测定相对分子质量的物理方法是( )
A.质谱法 B.红外光谱法
C.紫外光谱法 D.1H核磁共振谱法
答案 A
解析 用于测定有机物相对分子质量的物理方法为质谱法,其余三项均不符合。
3.下列各组物质,都不属于天然有机物的是( )
A.淀粉、蛋白质 B.石油、油脂
C.棉花、水泥 D.酚醛树脂、塑料
答案 D
解析 淀粉、蛋白质、油脂、棉花属于天然有机物,而酚醛树脂、塑料属于合成有机高分子化合物。
4.下列说法正确的是( )
A.19世纪初,化学家维勒提出了有机化学的概念
B.红外光谱图的研究可以确定有机物的相对分子质量
C.测定有机化合物中碳、氢元素质量分数的方法最早是由李比希提出的
D.铜丝燃烧法可定性确定有机物中是否含有硫、氮、氯、溴等元素
答案 C
解析 A项,19世纪初瑞典化学家贝采利乌斯提出有机化学的概念,错误;B项,红外光谱图的研究有助于确定有机物分子中的化学键和官能团,不是确定有机物的相对分子质量,错误;C项,利用燃烧的方法测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出的,正确;D项,钠融法确定有机物中是否含有氮、氯、溴、硫等元素,错误。
- 11 -
答案 A
解析 CH3CH2CH2OH分子中有四种不同化学环境的氢原子,在其核磁共振氢谱中应有4组吸收峰。
6.某一元醇C3H8O中的氧为18O,它与乙酸反应生成的酯的相对分子质量是( )
A.100 B.102 C.104 D.106
答案 C
解析 由酯化反应的历程可知,生成的酯为
7.甲醚(CH3—O—CH3)和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用金属钠或者金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核磁共振氢谱法
答案 B
解析 CH3OCH3和CH3CH2OH的最大质荷比相同,均为46,故选B项。
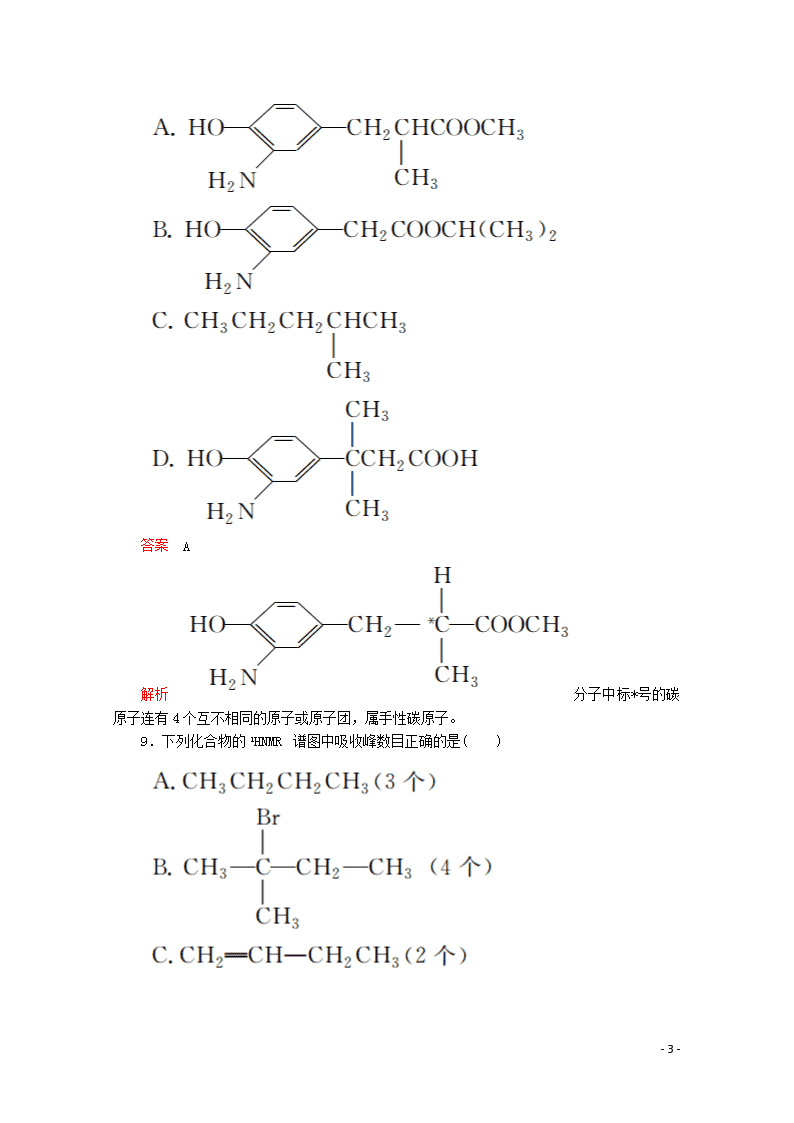
8.在下列各有机物中,含有手性碳原子的是( )
- 11 -
答案 A
解析 分子中标*号的碳原子连有4个互不相同的原子或原子团,属手性碳原子。
9.下列化合物的1HNMR谱图中吸收峰数目正确的是( )
- 11 -
答案 D
解析
10.某有机物完全燃烧生成CO2和H2O。将12.4 g该有机物的完全燃烧产物通过浓硫酸,浓硫酸增重10.8 g,再通过碱石灰,碱石灰增重了17.6 g。下列说法不正确的是( )
A.该有机物的最简式为CH3O
B.该有机物的分子式可能为CH3O
C.该有机物的分子式一定为C2H6O2
D.该有机物可能属于醇类
答案 B
解析 n(H2O)==0.6 mol,n(H)=0.6 mol×2=1.2 mol,m(H)=1 g·mol-1×1.2 mol=1.2 g;n(CO2)==0.4 mol,m(C)=12 g·mol-1×0.4 mol=4.8 g;含有氧元素的物质的量为=0.4 mol;该有机物分子中C、H、O原子个数之比为0.4 mol∶1.2 mol∶0.4 mol=1∶3∶1,其最简式为CH3O。该有机物分子中只含有C、H、O三种元素,H原子数只能为偶数,其分子式不可能为CH3O;设该有机物分子式为(CH3O)n,当n=2时,得到的分子式C2H6O2中H原子已经达到饱和,所以该有机物分子式为C2H6O2
- 11 -
;该有机物分子中的氧原子有可能形成羟基,形成醇类。
11.某气态化合物X含C、H、O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量。欲确定化合物X的分子式,所需的最少条件是( )
A.①②④ B.②③④ C.①③⑤ D.①②
答案 A
解析 要确定化合物的分子式,可求出化合物X的实验式和相对分子质量,据①②可求出C、H、O的原子个数比,即X的最简式,再据④可求出X的相对分子质量。
12.0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。0.1 mol该有机物恰好与4.6 g金属钠完全反应。下列关于该有机物的说法不正确的是( )
A.该化合物的相对分子质量是62
B.该化合物的分子式为C2H6O2
C.1 mol该化合物能与2 mol O2发生催化氧化反应
D.1 mol该有机物最多能与2 mol Na反应
答案 C
解析 有机物燃烧生成水10.8 g,物质的量为
=0.6 mol,CO与CuO反应,经差量计算,得CO的质量为5.6 g,即物质的量为0.2 mol,反应后转化为0.2 mol CO2,与燃烧生成的CO2,都被碱石灰吸收。有机物含有碳原子物质的量为=0.4 mol,有机物燃烧产物中的CO2的物质的量为0.4 mol-0.2 mol=0.2 mol,根据碳元素守恒可知,1 mol有机物含有碳原子物质的量为2 mol,含有氢原子物质的量为6 mol。含有氧原子物质的量为=2 mol,所以有机物的分子式为C2H6O2,0.1 mol该有机物恰好与4.6 g金属钠完全反应,4.6 g Na的物质的量==0.2 mol,有机物与Na按物质的量之比1∶2反应,有机物分子中含有2个—OH,该有机物的结构简式为HOCH2CH2OH,结合有机物的结构和性质分析答案即可。
13.120 ℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7 g,再通过碱石灰,碱石灰增重4.4 g,对该有机物进行核磁共振分析,谱图如图所示:
则该有机物可能是( )
- 11 -
A.CH3CH3 B.CH3CH2COOH
C.CH3CH2OH D.CH3CH(OH)CH3
答案 C
解析 该有机物中C、H的物质的量分别是:n(C)==0.1 mol,n(H)=×2=0.3 mol,故该有机物中C、H原子个数比为1∶3,可将B、D选项排除,而由核磁共振谱分析可知该有机物中应有三种不同化学环境的H原子,所以只能是CH3CH2OH。
14.某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中氧原子的个数可以是( )
A.1到4 B.2或3 C.只有4 D.1或4
答案 D
解析 相对分子质量小于150,氧的质量分数为50%,则分子中氧原子数目小于≈4.7,由于氧的质量分数为50%,有机化合物中碳、氢原子的质量之和等于氧原子的质量,设分子中含有x个C,y个H,若氧原子有1个,则12x+y=16,当y=4时,x=1;若氧原子有2个,则12x+y=32,没有相应的物质;若氧原子有3个,则12x+y=48,没有相应的物质;若氧原子有4个,则有12x+y=64,当y=4时,x=5;所以分子中氧原子的个数可以是1或4,D正确。
15.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。A的核磁共振氢谱有4组峰且面积之比为1∶2∶2∶3,A分子中只含1个苯环且苯环上只有1个取代基,其红外光谱与核磁共振氢谱如图。关于A的下列说法中正确的是( )
A.A分子属于酯类化合物,在一定条件下不能发生水解反应
B.A在一定条件下可与4 mol H2发生加成反应
C.与A属于同类化合物的同分异构体只有2种
D.符合题中A分子结构特征的有机物只有1种
答案 D
解析 有机物A的分子式为C8H8O2
- 11 -
,不饱和度为5,A分子中只含1个苯环且苯环上只有1个取代基,A的核磁共振氢谱有4组峰且面积之比为1∶2∶2∶3,说明A中含有4种氢原子且其原子个数之比为1∶2∶2∶3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为。含有酯基,可发生水解反应,A错误;A分子中只有苯环能与H2加成,则A在一定条件下可与3 mol H2发生加成反应,B错误;属于同类化合物,应含有酯基、苯环,若为羧酸与醇形成的酯有甲酸苯甲酯,若为羧酸与酚形成的酯,可以是乙酸与苯酚形成的酯,也可以是甲酸与甲基苯酚形成的酯,甲基有邻、间、对3种位置,故共有5种同分异构体,C错误;符合题中结构特征的有机物A的结构简式为,只有一种,D正确。
16.(双选)某化合物的结构(键线式)及球棍模型如下:
该有机分子的核磁共振氢谱图如下(单位是ppm):
下列关于该有机物的叙述不正确的是( )
A.该有机物不同化学环境的氢原子有8种
B.该有机物与氢氧化钠的醇溶液共热时可以发生消去反应
C.键线式中的Et代表的基团为—CH2CH3
D.1 mol该有机物最多可以与2 mol NaOH反应
答案 BD
解析 该有机物结构不对称,核磁共振氢谱图中有8组峰,说明该有机物含有8种不同化学环境的H原子,A正确;分子中含有羟基,但发生消去反应的条件是浓硫酸、加热,B错误;由结构及球棍模型可知,Et代表—CH2CH3,C正确;该分子中含有1个酯基,1 mol该有机物最多可以与1 mol NaOH反应,D错误。
第Ⅱ卷(非选择题,共52分)
二、非选择题(共3个题,共52分)
17.(17分)有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是________。
- 11 -
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是 1∶1∶1∶3,则C的结构简式是__________________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
答案 (1)90 C3H6O3 (2)羧基
解析 (1)有机物质谱图中,最右边的质荷比表示有机物的相对分子质量,因此该有机物的相对分子质量为90。浓H2SO4吸水,所以生成的水是5.4 g,即0.3 mol;碱石灰吸收CO2,则CO2是13.2 g,即0.3 mol。所以9.0 g C中氧原子的物质的量是
=0.3 mol,所以此有机物的实验式为CH2O,又因其相对分子质量为90,所以C的分子式为C3H6O3。
(2)C能与NaHCO3溶液发生反应,则C中含有羧基。
(3)根据氢原子的种类及个数之比可知,C的结构简式为
(4)C中含有1个羟基和1个羧基,所以0.1 mol C与Na反应能生成0.1 mol H2,标准状况下的体积是2.24 L。
18.(17分)确定某液态有机物甲的结构简式的过程如下:
(1)测定甲的实验式:含C、H、O三种元素的有机物甲,经燃烧分析实验测得其所含碳元素的质量分数是64.86%,氢元素的质量分数是13.51%,则其实验式是____________。
(2)确定甲的分子式:下图为有机物甲的质谱图,则其相对分子质量为________,分子式为________。
- 11 -
(3)确定甲的官能团:将小颗粒钠投入甲中,有气泡产生,则甲中存在的官能团的名称是________;甲可能的结构有________种。
(4)确定甲的结构简式:经测定有机物甲的核磁共振氢谱如图所示,则甲的结构简式为__________。
答案 (1)C4H10O (2)74 C4H10O (3)羟基 4 (4)C(CH3)3OH
解析 (1)根据题意可知,有机物甲中各元素的原子个数比N(C)∶N(H)∶N(O)=∶∶=4∶10∶1,故该有机物的实验式为C4H10O。
(2)假设甲的分子式为(C4H10O)m,由质谱图知其相对分子质量为74,则74m=74,即m=1,故其分子式为C4H10O。
(3)由A的分子式为C4H10O可知甲为饱和有机物,推测甲可能是醇或醚,钠与甲反应有气泡生成,说明甲是醇,含有的官能团是羟基;甲的结构为C4H9—OH,故甲属于醇的可能结构有4种。
(4)分析甲的核磁共振氢谱图可知甲有两种不同类型的H原子,故甲的结构简式为C(CH3)3OH。
19.(18分)两种有机物A和B可以互溶,有关性质如下:
(1)若要除去A和B的混合物中少量的B,采用________(填序号)方法即可得到A。
a.重结晶 b.蒸馏
- 11 -
c.萃取 d.加水充分振荡,分液
(2)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的最简式为________,若要确定其分子式,是否需要其他条件________(填“是”或“否”)。已知有机物A的核磁共振氢谱、质谱如图所示,则A的结构简式为________。
(3)若质谱图显示B的相对分子质量为74,红外光谱如图所示,则B的结构简式为______________,其官能团的名称为________。
(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增加19.8 g和35.2 g。计算混合物中A和B的物质的量之比为________。
答案 (1)b (2)C2H6O 否 CH3CH2OH
(3)CH3CH2OCH2CH3 醚键 (4)2∶1
解析 (1)由表格数据可知,A易溶于水,B不溶于水,但A、B互溶,二者沸点差异较大,故除去A和B混合物中的少量B可采用的方法是蒸馏,故b符合题意。
(2)由题意可知,n(H2O)==0.3 mol,n(CO2)==0.2 mol,n(O2)=
=0.3 mol,则有机物中含有氧原子的物质的量是0.3 mol+0.4 mol-0.6 mol=0.1 mol,n(C)∶n(H)∶n(O)=0.2 mol∶0.6 mol∶0.1
- 11 -
mol=2∶6∶1,所以该物质的最简式为C2H6O;由于分子中碳已经达到饱和,所以若要确定其分子式,不需要其他条件,即最简式就是分子式。分子式为C2H6O,核磁共振氢谱表明其分子中有三种不同化学环境的氢原子,则A的结构简式为CH3CH2OH。
(3)B的相对分子质量为74,根据红外光谱图,B中存在对称的甲基、亚甲基和醚键,根据对称性,B的结构简式为CH3CH2OCH2CH3。
(4)A和B的分子式分别为C2H6O、C4H10O,设C2H6O、C4H10O的物质的量分别是x mol、y mol,则
C2H6O+3O22CO2 + 3H2O
x 2x 3x
C4H10O+6O24CO2 + 5H2O
y 4y 5y
3x mol+5y mol=,2x mol+4y mol=,解得x=0.2,y=0.1,即A和B的物质的量之比为2∶1。
- 11 -
相关文档
- 2019届一轮复习人教版认识有机化合2021-07-0241页
- 2020高中化学第三章重要的有机化合2021-07-025页
- 2021新高考化学鲁科版一轮复习突破2021-07-027页
- 2021届高考化学一轮复习认识有机化2021-07-0210页
- 高中化学选修五(人教版 练习):第一章 2021-07-024页
- 2020届一轮复习苏教版第31讲认识有2021-07-0226页
- 2020高中化学第一章认识有机化合物2021-07-027页
- 2020届高考化学一轮复习认识有机化2021-07-027页
- 2020届一轮复习人教通用版第32讲认2021-07-028页
- 2020高中化学第一章认识有机化合物2021-07-026页