- 459.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1节 原子结构模型
[课标要求]
1.了解原子核外电子的运动状态。
2.知道原子核外电子在一定条件下会发生跃迁,了解其简单应用。
1.能级符号及所含轨道数:s、1,p、3,d、5,f、7。
2.每个电子层所含能级类型:K:s;L:s、p;M:s、p、d;N:s、p、d、f。
3.s轨道呈球形,p轨道呈“∞”形。
4.原子轨道能量高低关系:
同电子层不同能级:nf>nd>np>ns;
不同电子层同能级:ns>(n-1)s>(n-2)s>(n-3)s;
同电子层同能级:npx=npy=npz。
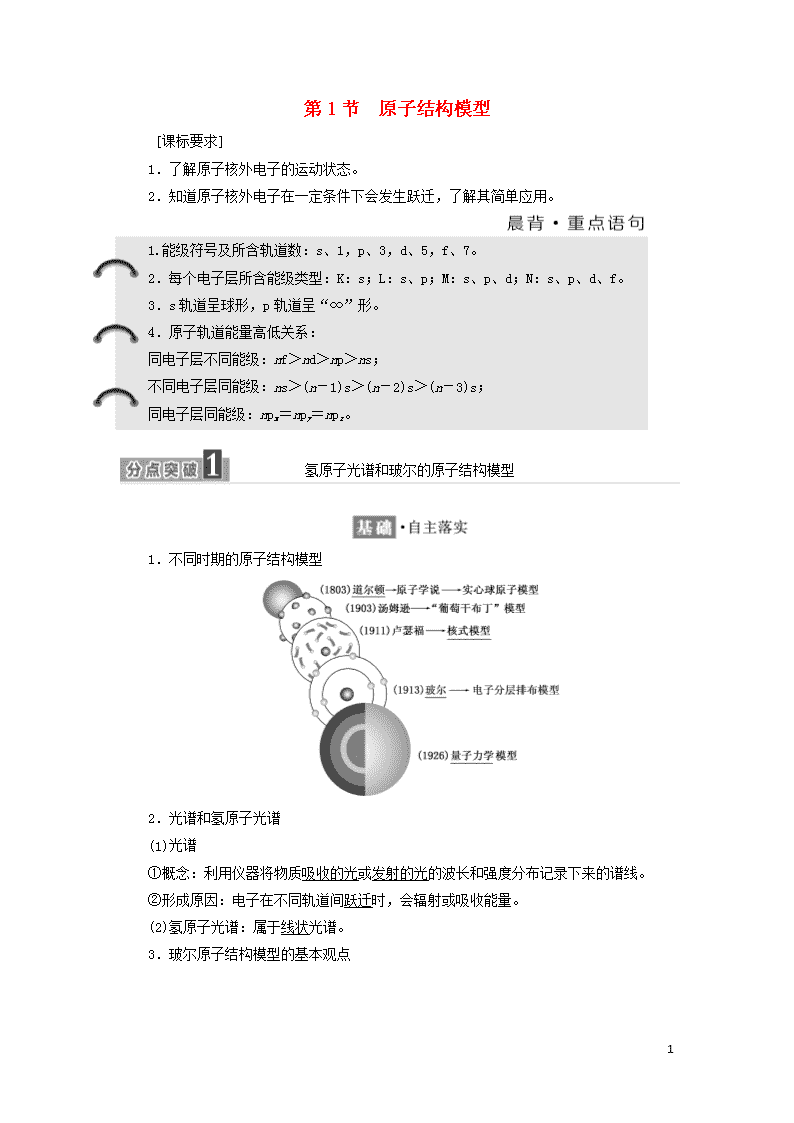
1.不同时期的原子结构模型
2.光谱和氢原子光谱
(1)光谱
①概念:利用仪器将物质吸收的光或发射的光的波长和强度分布记录下来的谱线。
②形成原因:电子在不同轨道间跃迁时,会辐射或吸收能量。
(2)氢原子光谱:属于线状光谱。
3.玻尔原子结构模型的基本观点
10
运动轨迹
原子中的电子在具有确定半径的圆周轨道上绕原子核运动,并且不辐射能量
能量分布
在不同轨道上运动的电子具有不同的能量,而且能量是量子化的。轨道能量依n(电子层数)值(1,2,3,…)的增大而升高
电子跃迁
对氢原子而言,电子处于n=1的轨道时能量最低,称为基态;能量高于基态的状态称为激发态。电子在能量不同的轨道之间跃迁时,辐射或吸收的能量以光的形式表现出来并被记录下来,就形成了光谱
[特别提醒]
(1)基态原子激发态原子。
(2)基态原子和激发态原子的相互转化时吸收或释放能量,形成光谱。
(3)焰色反应产生的原因是原子中的电子在能量不同轨道上跃迁。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)门捷列夫提出原子学说,并发现元素周期律。( )
(2)氢原子外围只有一个电子,故氢原子光谱只有一条谱线。( )
(3)氢原子光谱属于线状光谱。( )
(4)基态氢原子转变成激发态氢原子时释放能量。( )
(5)焰色反应与电子跃迁有关,属于化学变化。( )
答案:(1)× (2)× (3)√ (4)× (5)×
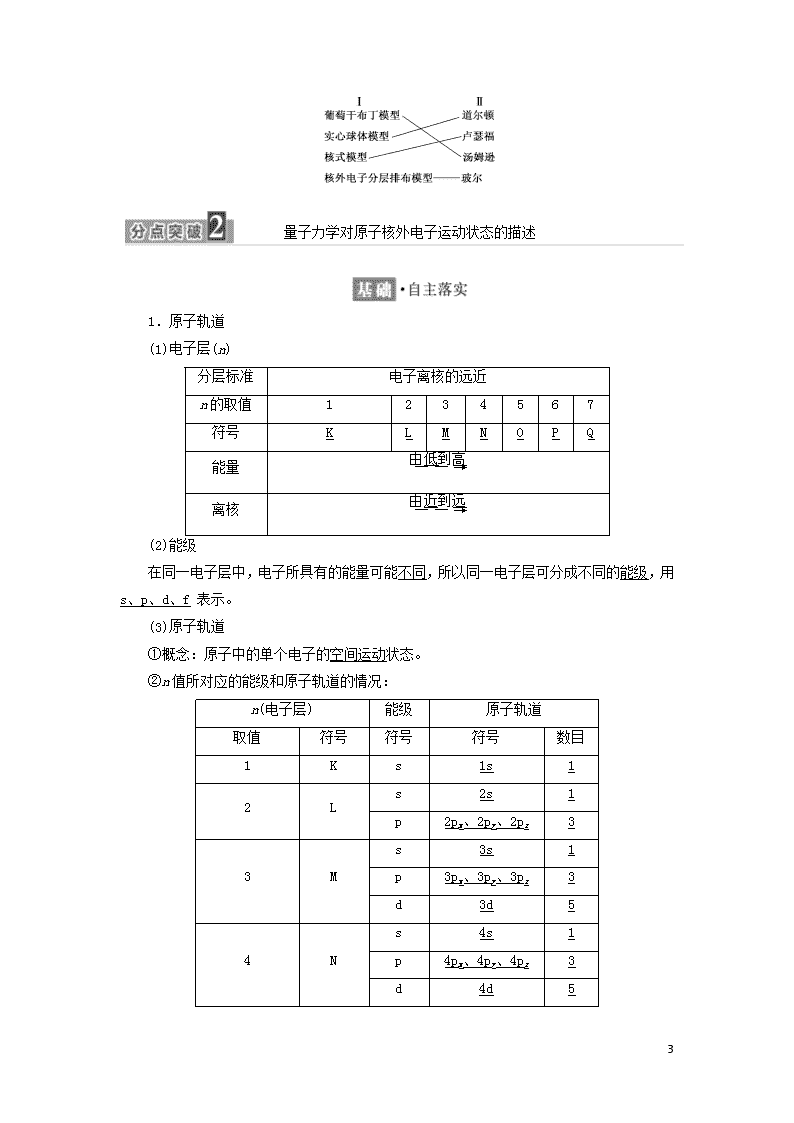
2.原子结构模型的建立经历了若干个阶段,下列是这几个阶段中的主要成果和代表人物,请用线连接起来。
Ⅰ Ⅱ
葡萄干布丁模型 道尔顿
实心球体模型 卢瑟福
核式模型 汤姆逊
核外电子分层排布模型 玻尔
解析:原子结构模型在不同时期的主要成果和代表人物分别是:1803年英国化学家道尔顿创立的原子学说→1903年汤姆逊提出葡萄干布丁模型→1911年卢瑟福提出核式模型→1913年玻尔建立核外电子分层排布模型→20世纪20年代产生了量子力学模型。
答案:
10
1.原子轨道
(1)电子层(n)
分层标准
电子离核的远近
n的取值
1
2
3
4
5
6
7
符号
K
L
M
N
O
P
Q
能量
离核
(2)能级
在同一电子层中,电子所具有的能量可能不同,所以同一电子层可分成不同的能级,用 s、p、d、f 表示。
(3)原子轨道
①概念:原子中的单个电子的空间运动状态。
②n值所对应的能级和原子轨道的情况:
n(电子层)
能级
原子轨道
取值
符号
符号
符号
数目
1
K
s
1s
1
2
L
s
2s
1
p
2px、2py、2pz
3
3
M
s
3s
1
p
3px、3py、3pz
3
d
3d
5
4
N
s
4s
1
p
4px、4py、4pz
3
d
4d
5
10
f
4f
7
(4)自旋运动状态
处于同一原子轨道上的电子自旋运动状态只有两种,分别用符号“↑”和“↓”表示。
2.原子轨道的图形描述和电子云
(1)原子轨道的图形描述
①对象:原子中单个电子的空间运动状态即原子轨道。
②方法:用直角坐标系标注。
③意义:表示原子轨道的空间分布。
④形状:s轨道呈球形;p轨道在空间的分布特点是分别相对于x、y、z轴对称,呈哑铃形(∞)。
(2)电子云
①概念:描述电子在空间单位体积内出现概率大小的图形。
②含义:用单位体积内小黑点的疏密程度表示电子在原子核外出现概率的大小。
1.量子力学从哪些方面描述原子核外电子的运动状态?
提示:从电子层、能级、原子轨道、自旋运动状态、电子云五方面。
2.电子层数与该电子层中的能级数、原子轨道数有什么关系?能级与原子轨道数之间又有什么关系?
提示:第n电子层中的能级数为n,原子轨道数为n2;s能级有1个原子轨道,p能级有3个原子轨道,d能级有5个原子轨道,f能级有7个原子轨道。
3.决定电子能量高低的因素是什么?
提示:电子的运动区域离原子核越远能量越高;原子轨道所处的电子层及能级决定电子的能量高低。
1.电子层数(n)、能级数、原子轨道数、容纳电子数的关系:
n取值
1
2
3
4
n
能级数
1
2
3
4
n
原子轨道数
1
4
9
16
n2
最多容纳电子数
2
8
18
32
2n2
2.不同原子轨道能量高低的关系
10
不同电子层不同能级ns<(n-2)f<(n-1)a<np
3.s轨道为球形,p轨道为“∞”字形,并不是说s能级电子绕核做圆周运动,p能级电子绕核做“∞”形运动。
4.电子云图中的一个小黑点,不代表一个电子。
5.离核越近,电子在单位体积内出现的概率越大。
1.下列能级中轨道数为3的是( )
A.s能级 B.p能级
C.d能级 D.f能级
解析:选B s能级中轨道数为1,p能级中轨道数为3,d能级中轨道数为5,f能级中轨道数为7。
2.3px所代表的含义是( )
A.px轨道上有3个电子
B.第三电子层px轨道有3个伸展方向
C.px电子云有3个伸展方向
D.第三电子层沿x轴方向伸展的p轨道
解析:选D 3px中,3表示第三电子层,px表示沿x轴方向伸展的p轨道。
3.写出下列各电子层上的原子轨道数目。
K:_________,L:_________,M:_________,N:_________。
答案:1 4 9 16
[三级训练·节节过关]
1.下列说法中正确的是( )
A.电子云通常是用小黑点来表示电子的多少
B.处于最低能量的原子叫基态原子
C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D.电子仅在激发态跃迁到基态时才会产生原子光谱
解析:选B A项,电子云通常用小黑点的疏密来表示单位体积内电子出现概率的大小;C项,电子离核由近到远,能量由低到高;D项,电子在基态跃迁到激发态时也会产生原子光谱。
2.以下能级符号不正确的是( )
A.3s B.3p
C.3d D.3f
10
解析:选D 电子层序数与所含能级数目相同,第3电子层包含3s、3p、3d三种能级。
3.下列能级中,轨道数为5的是( )
A.s能级 B.p能级
C.d能级 D.f能级
解析:选C s、p、d、f能级所含的轨道数依次为1、3、5、7。
4.人们把电子云轮廓图称为原子轨道,下列有关说法错误的是( )
A.s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更扩散
B.p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直,能量相同
C.p电子能量一定高于s电子能量
D.处于同一原子轨道电子,自旋状态有两种
解析:选C 同一电子层上p电子能量高于s电子能量,不同电子层上p电子能量不一定高于s电子能量,如3s>2p。
5.填空。
(1)用符号填写电子层所含能级种类:
K层:__________;L层:__________;M层:__________;N层:__________。
(2)用数字填写能级所含原子轨道数目:
s:____;p:____;d:____;f:____。
(3)比较下列原子轨道的能量高低(填“<”“=”或“>”)。
①4s____3s____2s____1s;
②3px____3py____3pz;
③4f____4d____4p____4s;
④1s____2p____3d____4f。
答案:(1)1s 2s、2p 3s、3p、3d 4s、4p、4d、4f
(2)1 3 5 7
(3)> > > = = > > > < < <
1.关于原子结构模型的演变过程,正确的是( )
A.汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
B.汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型
C.道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型
D.道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
解析:选D 模型建立先后顺序为:道尔顿原子模型(1803年)→
10
汤姆逊原子模型(1903年)→卢瑟福原子模型(1911年)→玻尔原子模型(1913年)→量子力学模型(20世纪20年代中期)。
2.成功解释氢原子光谱为线状光谱的原子结构模型的是( )
A.卢瑟福原子结构模型
B.玻尔原子结构模型
C.量子力学模型
D.汤姆逊原子结构模型
解析:选B 玻尔原子结构模型最早成功解释了氢原子光谱为线状光谱;汤姆逊原子结构模型只解释了原子中存在电子的问题(是在发现电子的基础上提出来的),其原子结构模型为“葡萄干布丁”模型;卢瑟福原子结构模型是根据α粒子散射实验提出来的,解决了原子核的问题(带正电的部分集中在一个核上);量子力学模型是在量子力学理论的基础上提出来的,是一个统计的结果。
3.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
解析:选A 霓虹灯发红光是因为电子吸收能量后跃迁到能量较高的轨道,能量较高轨道上的电子会跃迁回能量较低的轨道而以光的形式释放能量。
4.电子层数n=3时,电子的空间运动状态(即原子轨道)有( )
A.4种 B.7种
C.8种 D.9种
解析:选D 电子层数n=3的原子轨道有3s(1个原子轨道),3p(3种伸展方向,即3个原子轨道),3d(5种伸展方向,即5个原子轨道)共9(即n2)个原子轨道。
5.以下能级符号正确的是( )
①6s ②2d ③3f ④7p
A.①② B.②③
C.③④ D.①④
解析:选D 能级数与电子层数n相同,当n=2时,只有2s、2p能级,不能出现d能级,而在n=3时也不会出现3f能级。
6.下列电子层中,包含有f能级的是( )
A.K电子层 B.L电子层
C.M电子层 D.N电子层
解析:选D K层包含s能级,L层包含s、p能级,M层包含s、p、d能级,N层包含s、p、d、f能级。
10
7.下列各组多电子原子的原子轨道能量高低比较中,错误的是( )
①2s<2p ②3px<3py ③3s<3d ④4s>4p
A.①② B.②③
C.①③ D.②④
解析:选D 同一电子层上原子轨道的能量高低为ns<np<nd,①、③正确,④错误,同一能级上各原子轨道的能量相同,3px=3py,②错误。
8.关于氢原子电子云图的说法正确的是( )
A.黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会小
C.电子云图是对电子运动无规律的描述
D.电子云图描述了电子运动的客观规律
解析:选D 电子云图中的黑点不代表电子,只是利用其密度的大小来代表电子在此区域出现机会的大小。电子运动的客观规律用图形表现就是电子云图。
9.写出下列各能级上的原子轨道数目
1s:________,4d:________,5f:________,6p:________。
答案:1 5 7 3
10.以下各能级是否存在?如果存在,各包含多少个原子轨道?
(1)2s (2)2d (3)3p (4)5d
解析:由电子层序数、能级数和原子轨道数之间的关系可知,存在着2s能级,且只有1个原子轨道;不存在2d能级,电子层数为2时只有2s、2p两个能级;存在3p能级,且含有3个原子轨道,分别为3px、3py、3pz;存在5d能级,其含有5个原子轨道。
答案:(1)2s存在,原子轨道数为1;
(2)2d不存在;
(3)3p存在,原子轨道数为3;
(4)5d存在,原子轨道数为5。
1.下列电子层中,原子轨道的数目为4的是( )
A.K层 B.L层
C.M层 D.N层
解析:选B s、p、d、f能级包含原子轨道数目依次为1、3、5、7;原子轨道数目为4,则该层包含s、p能级,故为L层。也可由原子轨道数n2=4,得n=2,即为L层。
2.N电子层含有的轨道类型数是( )
A.3 B.4
C.5 D.6
10
解析:选B N电子层为第4层,轨道类型数即能级类型数,电子层数=所含能级数,故N电子层含4种类型能级,分别为4s、4p、4d、4f,则轨道类型数为4。
3.下列说法中正确的是( )
A.1s、2px、2py、2pz轨道都具有球对称性
B.因为p轨道是“8”字形的,所以p电子也是“8”字形
C.氢原子中只有一个电子,故氢原子只有一个轨道
D.原子轨道与电子云都是用来形象描述电子运动状态的
解析:选D s轨道是球形对称的;p轨道呈哑铃形,px、py、pz分别相对于x、y、z轴对称;氢原子中只有一个电子,填充在1s轨道上,但也存在其他空轨道,使电子跃迁,产生光谱。
4.下列关于电子云示意图的叙述正确的是( )
A.电子云表示电子的运动轨迹
B.黑点的多少表示电子个数的多少
C.处于1s轨道上的电子在空间出现的概率分布呈球形对称,而且电子在原子核附近出现的概率小,离核越远电子出现的概率越大
D.处在2pz轨道的电子主要在xy平面的上、下方出现
解析:选D 电子云示意图是用小黑点的疏密来表示电子在原子核外出现的概率的大小,A、B错误;1s轨道的电子云呈球形对称,在原子核附近小黑点密集,电子出现的概率大,离核越远电子出现的概率越小,C错误;处在2pz轨道上的电子在空间出现的概率分布相对于z轴对称,电子主要在xy平面的上、下方出现,D正确。
5.下列说法正确的是( )
A.同一个电子层中s能级的能量总是大于p能级的能量
B.2s原子轨道半径比1s原子轨道半径大,说明2s的电子云中的电子比1s的多
C.第2电子层上的电子,不论在哪一个原子轨道上,其能量都相等
D.N电子层的原子轨道类型数和原子轨道数分别为4和16
解析:选D 同一电子层中,s能级的能量小于p能级的能量,A不正确;2s原子轨道半径比1s原子轨道半径大,说明2s电子在离核更远的区域出现的概率比1s电子的大,B不正确;当电子在同一电子层的不同能级上时,其能量不相同,因此C不正确;对于N电子层,n=4,其轨道类型数为4,轨道数为n2=42=16。
6.下列说法中正确的是( )
A.一般而言,n越大,电子离核平均距离越远,能量越低
B.一般n越大,电子层中的能级数越多
C.对于确定的n值,其原子轨道数为2n2个
D.自旋状态随原子轨道的具体情况而确定
10
解析:选B 随n值增大,电子离核越来越远,但电子能量越来越高,A项错误;电子层数越大,其能级数越多,如n=1,K层只有s能级,n=2,L层有s、p能级,n=3,M层有s、p、d三个能级,B项正确;一个电子层(电子层序数为n)上的原子轨道数为n2,电子有两种自旋状态(向上或向下),该电子层容纳的最多电子数为2n2,C项错误;自旋状态与原子轨道无关,D项错误。
7.下列关于电子层与能级的说法中正确的是( )
A.原子核外电子的每个电子层最多可容纳的电子数为n2
B.任一电子层的能级总是从s能级开始,而且能级数等于该电子层序数
C.同是s能级,在不同的电子层中所能容纳的最多电子数是不相同的
D.能级能量4s>4d
解析:选B A项,每一电子层最多可容纳的电子数为2n2;C项,只要是s能级,不论哪一电子层,所容纳的电子数都为2;D项,能级能量4d>4s。
8.若以E表示某能级的能量,下列能量大小顺序中正确的是( )
A.E(3p)>E(2p)>E(1p) B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(4d) D.E(5s)>E(4s)>E(5f)
解析:选A B项,应为E(3d)>E(3p)>E(3s);C项,应为E(4f)>E(4d)>E(4s);D项,应为E(5f)>E(5s)>E(4s)。
9.K层有________个能级,用符号表示为________,L层有____________个能级,用符号分别表示为____________。M层有____________个能级,用符号分别表示为____________。由此可推知n电子层最多可能有________个能级,能量最低的两个能级其符号分别表示为________,它们的原子轨道电子云形状分别为________、________。
解析:此题对电子层和能级的关系作了总结,有助于理解和掌握以下几个基本内容:①第n个电子层有n个能级;②核外电子的能量取决于该电子所处的电子层和能级;③s能级和p能级电子云的形状。
答案:1 1s 2 2s、2p 3 3s、3p、3d n ns、np 球形 哑铃形
10.比较下列多电子原子原子轨道的能量高低(填“<”“>”或“=”)。
(1)2s______3s;(2)2s______3d;
(3)2px______2py;(4)4f______6f。
解析:相同电子层上不同原子轨道能量的高低:ns<np<nd<nf;形状相同的原子轨道能量的高低:1s<2s<3s<4s…,同一能级上的原子轨道具有相同的能量:npx=npy=npz等。
答案:(1)< (2)< (3)= (4)<
10
相关文档
- 2019高中化学 第四章 非金属及其化2021-07-025页
- 高中化学第四章电化学基础2化学电2021-07-023页
- 2020高中化学第五章进入合成有机高2021-07-0213页
- 2019-2020学年高中化学同步学典7第2021-07-028页
- 高中化学必修1第1章第2节第2课时练2021-07-028页
- 高中化学人教版必修2(练习)3_3_2 乙2021-07-0215页
- 2020年高中化学 第03章 专题3水的2021-07-028页
- 高中化学《化学反应原理》4_3电解2021-07-023页
- 人教版高中化学选修五 2_1脂肪烃第2021-07-0220页
- 2018-2019学年吉林省长春市九台区2021-07-0212页