- 247.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
温馨提示:
此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。关闭Word文档返回原板块。
题组训练过关
浓硫酸的性质
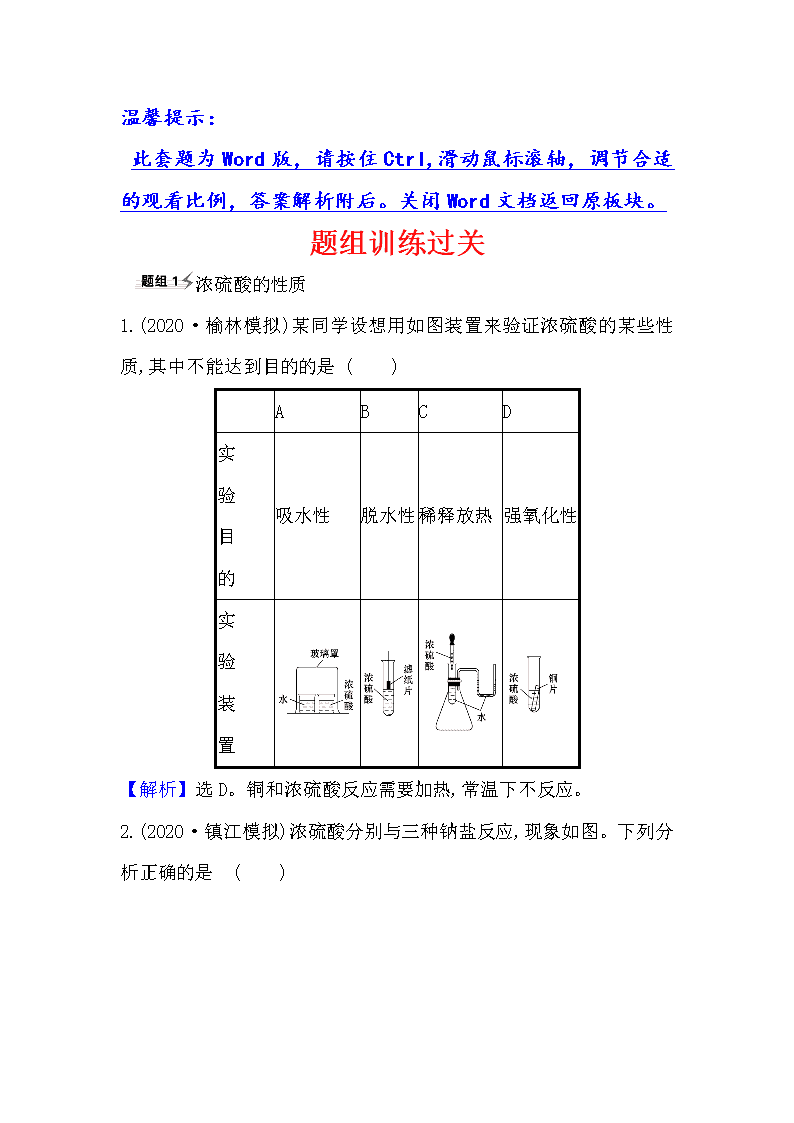
1.(2020·榆林模拟)某同学设想用如图装置来验证浓硫酸的某些性质,其中不能达到目的的是 ( )
A
B
C
D
实
验
目
的
吸水性
脱水性
稀释放热
强氧化性
实
验
装
置
【解析】选D。铜和浓硫酸反应需要加热,常温下不反应。
2.(2020·镇江模拟)浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是 ( )
A.对比①和②可以说明还原性:Br->Cl-
B.①和③相比可说明氧化性:Br2>SO2
C.②中试管口白雾是HCl遇水蒸气所致,说明酸性:H2SO4>HCl
D.③中浓硫酸被还原成SO2
【解析】选A。A项,反应①生成的红棕色气体是溴蒸气,反应②白雾是氯化氢,说明浓硫酸能将溴离子氧化成溴单质,而不能将氯离子氧化成氯气;B项,反应③生成的是二氧化硫气体,非氧化还原反应,而且亚硫酸钠与溴化钠不是同一类型;C项,白雾说明氯化氢易挥发;D项,反应③生成的是二氧化硫气体,非氧化还原反应。
(1)浓硫酸吸水性、脱水性的区别
(2)浓硫酸的强氧化性反应规律
①Fe、Al的钝化。常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
②常温下与活泼金属反应(铁、铝除外)表现强氧化性和酸性,生成硫酸盐和SO2,硫酸浓度变小后,生成的气体为H2。
③与不活泼金属和非金属反应的规律。
a.反应需要加热,否则不反应。
b.还原产物一般是SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸。
c.浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。
d.随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应即停止。
④与具有还原性的化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
浓硫酸性质的应用
3.(1)用过量的锌与浓硫酸反应,某同学认为除了生SO2外,还有H2产生,理由是________________________________________。
(2)用过量铜片与含0.2 mol H2SO4的浓硫酸共热足够长时间(只考虑铜与浓H2SO4反应,忽略其他副反应),甲认为产生的SO2少于0.1 mol,理由是________________________________;而乙同学认为产生的SO2为0.1 mol,理由是________________________________。
(3)实验证明在低温下铜不能与O2反应,也不能与稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为________________________。利用铜制备CuSO4的另一种方法为________________________________(用化学方程式表示)。以上两种方法________(填“前”或“后”)者较好,原因是________________________________________。
【解析】浓硫酸与金属反应时,随着反应的进行,硫酸的量不断减少,硫酸由浓变稀,稀硫酸可与锌反应产生氢气,但稀硫酸不与铜反应。在稀硫酸存在的条件下,Cu与O2在加热条件下反应生成碱性氧化物CuO,并迅速溶解在热的稀硫酸中生成CuSO4。
答案:(1)Zn过量,随着反应的进行,浓硫酸变稀,稀硫酸可与Zn反应产生H2 (2)由反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O可知,若0.2 mol H2SO4全部反应可生成0.1 mol SO2,但随着反应的进行,浓硫酸变稀,而稀硫酸与铜不反应 加热时间足够长,水比硫酸易挥发,硫酸始终保持较高浓度,直至与铜完全反应
(3)2Cu+2H2SO4(稀)+O22CuSO4+2H2O Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 前 若制得1 mol CuSO4,第一种方法只需1 mol H2SO4,而第二种方法则要用2 mol H2SO4,而且生成的SO2会造成大气污染
由“量变”引起的“质变”的物质大比拼
(1)浓硫酸:金属(如Cu、Zn等)与浓H2SO4反应时,要注意H2SO4浓度对反应产物的影响。开始阶段产生SO2气体,随着反应的进行,H2SO4的浓度变小,最后变为稀硫酸,Cu与稀硫酸不反应,Zn与稀硫酸反应生成H2而不是SO2。
(2)浓硝酸:金属(如Cu、Zn等)与浓硝酸反应时,要注意硝酸浓度对反应产物的影响。开始阶段产生NO2气体,随着反应的进行,硝酸的浓度变小,最后变为稀硝酸,反应均生成NO。
(3)浓盐酸:二氧化锰与浓盐酸在加热条件下反应生成氯气,
随着反应的进行,盐酸变稀,反应停止。
关闭Word文档返回原板块
相关文档
- 2021版化学名师讲练大一轮复习鲁科2021-07-021页
- 2021版化学名师讲练大一轮复习鲁科2021-07-025页
- 2021版化学名师讲练大一轮复习鲁科2021-07-024页
- 2021版化学名师讲练大一轮复习鲁科2021-07-023页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0210页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0211页
- 2021版化学名师讲练大一轮复习鲁科2021-07-022页
- 化学名师讲练大一轮复习方略人教通2021-07-025页
- 2021版化学名师讲练大一轮复习鲁科2021-07-026页
- 化学名师讲练大一轮复习方略人教通2021-07-024页