- 698.00 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
物质的检验与鉴别
1.(2015·浙江10月选考真题)实验室有两瓶失去标签的溶液,其中一瓶是稀H2SO4,另一瓶是蔗糖溶液。鉴别时,下列选用的试纸或试剂不正确的是 ( )
A.pH试纸 B.KCl溶液
C.BaCl2溶液 D.Na2CO3溶液
【解析】选B。本题考查物质的鉴别、电解质电离、H2SO4的性质等知识。硫酸属于电解质,在水溶液中电离出氢离子和硫酸根离子:H2SO42H++S,蔗糖属于非电解质,因此可以用pH试纸、氯化钡溶液(S+Ba2+BaSO4↓)、Na2CO3溶液(2H++ CCO2↑+H2O)来鉴别,KCl与硫酸不反应,不能鉴别硫酸和蔗糖溶液。
2.(2017·浙江11月学考真题)下列方法(必要时可加热)不合理的是 ( )
A.用澄清石灰水鉴别CO和CO2
B.用水鉴别苯和四氯化碳
C.用Ba(OH)2溶液鉴别NH4Cl、(NH4)2SO4和K2SO4
D.用淀粉碘化钾试纸鉴别碘水和溴水
【解析】选D。CO2能使澄清石灰水变浑浊,CO不能使澄清石灰水变浑浊,A合理;苯的密度比水小在上层,四氯化碳的密度比水大在下层,B合理;Ba(OH)2与NH4Cl反应产生有刺激性气味的气体,Ba(OH)2与(NH4)2SO4反应既有有刺激性气味的气体产生又有沉淀产生,Ba(OH)2与K2SO4只有沉淀产生,C合理;碘水中有碘单质,溴水可以氧化碘离子为碘单质,都可以使淀粉碘化钾试纸变蓝,故选D。
3.下列关于物质的检验方法正确的是 ( )
A.用硫酸铜溶液鉴别氢氧化钠和碳酸钠溶液
B.用紫色石蕊试液测定雨水的酸碱度
C.往固体中加入稀盐酸,出现气泡说明该固体一定是碳酸盐
D.只用石蕊试液就能将氯化钠溶液、氢氧化钠溶液、盐酸区别开来
【解析】选D。A、硫酸铜和氢氧化钠反应生成蓝色的氢氧化铜沉淀,和碳酸钠反应也生成蓝色氢氧化铜沉淀和碳酸氢钠,现象相同,不能鉴别,错误;B、紫色石蕊试液只能测定溶液的酸碱性,不能测定酸碱度,应使用pH试纸,错误;C、固体加入盐酸有气体生成,固体可能是碳酸盐或碳酸氢盐或亚硫酸盐等,错误;D、氯化钠中加入石蕊试液仍为紫色,
8
氢氧化钠溶液中加入石蕊试液变蓝,盐酸中加入石蕊变红,现象不同,能检验,正确,选D。
4.不能用来鉴别Na2CO3和NaHCO3 两种白色固体的实验操作是 ( )
A.分别在这两种物质的溶液中,加入少量澄清石灰水
B.分别加热这两种固体,将生成的气体通入澄清石灰水中
C.分别在这两种物质的溶液中,加入少量氯化钙溶液
D.分别在这两种物质的等浓度的溶液中,加入少量的稀盐酸
【解析】选A。A、Na2CO3和NaHCO3均可与澄清石灰水反应产生沉淀,现象相同,无法鉴别,故A错误;B、Na2CO3受热不分解,而NaHCO3受热分解,可以鉴别,故B正确;C、Na2CO3与CaCl2溶液作用产生CaCO3沉淀,而NaHCO3则不与CaCl2溶液反应,无沉淀产生,也可以鉴别,故C正确;D、向Na2CO3中逐滴加入盐酸时,先无气体产生,当盐酸加入较多时,可产生气体,而向同浓度NaHCO3中加入盐酸,则迅速产生气体,可以通过产生气体的快慢加以鉴别,故D正确。
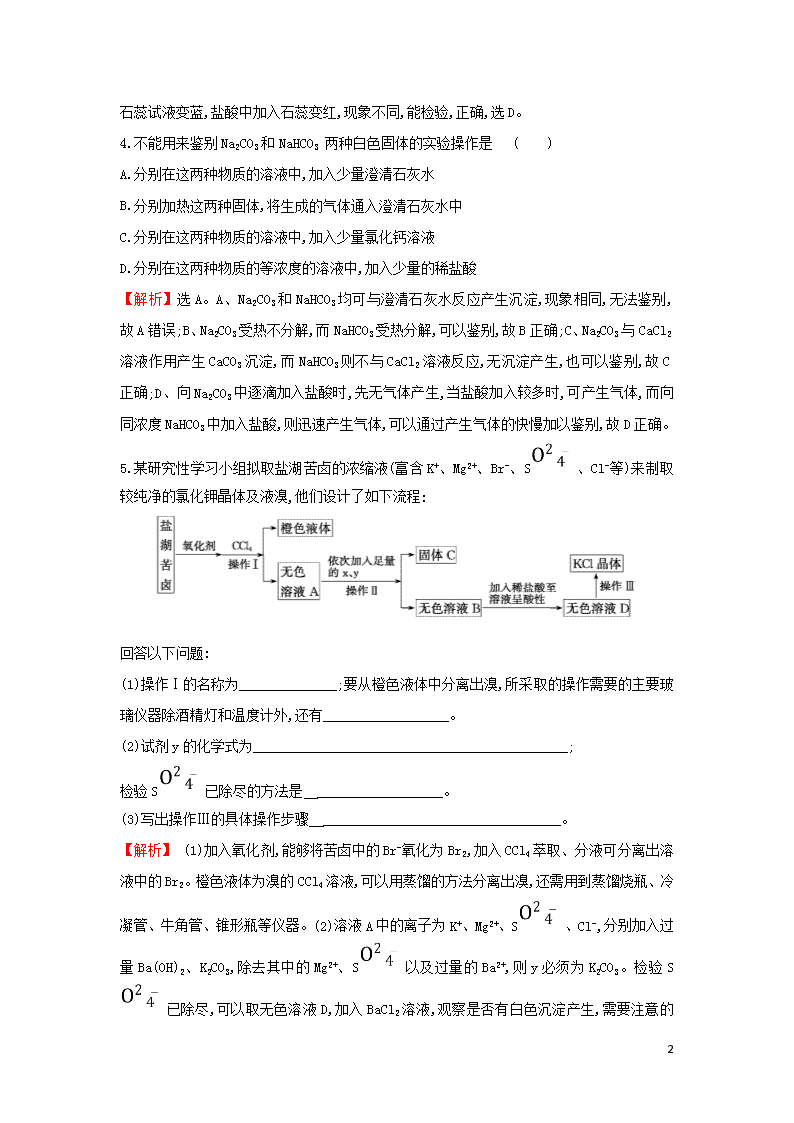
5.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、S、Cl-等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
回答以下问题:
(1)操作Ⅰ的名称为______________;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还有__________________。
(2)试剂y的化学式为_____________________________________________;
检验S已除尽的方法是 __________________。
(3)写出操作Ⅲ的具体操作步骤 __________________________________。
【解析】 (1)加入氧化剂,能够将苦卤中的Br-氧化为Br2,加入CCl4萃取、分液可分离出溶液中的Br2。橙色液体为溴的CCl4溶液,可以用蒸馏的方法分离出溴,还需用到蒸馏烧瓶、冷凝管、牛角管、锥形瓶等仪器。(2)溶液A中的离子为K+、Mg2+、S、Cl-,分别加入过量Ba(OH)2、K2CO3,除去其中的Mg2+、S以及过量的Ba2+,则y必须为K2CO3。检验S已除尽,可以取无色溶液D,加入BaCl2溶液,观察是否有白色沉淀产生,
8
需要注意的是,不能取无色溶液B,因为B中含有C,会对S的检验产生干扰。(3)操作Ⅲ是由KCl溶液得到KCl晶体,实验操作为蒸发结晶。
答案:(1)萃取、分液 蒸馏烧瓶、冷凝管、牛角管、锥形瓶
(2)K2CO3 取少量无色溶液D,加入BaCl2溶液,若没有白色沉淀生成,则S已除尽(其他合理答案也可)
(3)将溶液倒入蒸发皿中并置于三脚架上,加热并用玻璃棒不断搅拌蒸发皿中的液体,直到溶液表面出现晶膜时,停止加热
6.(2015·全国卷Ⅱ节选)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可以得到多种化工原料。有关数据如表所示:
溶解度/(g/100 g水)
温度/℃
化合物
0
20
40
60
80
100
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
回答下列问题:
(1)该电池的正极反应式为_________________, 电池反应的离子方程式为__________________________________。
(2)维持电流强度为0.5 A,电池工作5分钟,理论上消耗锌________g。(已知F=96 500 C·mol-1)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过______分离回收;滤渣的主要成分是MnO2、______和__________________,
欲从中得到较纯的MnO2,最简便的方法是_____________________________,
其原理是 __________________________________。
【解析】(1)酸性锌锰干电池外壳为金属锌,锌是负极,电极反应式为Zn-2e-Zn2+。中间是碳棒,碳棒是正极,二氧化锰得到电子,则正极电极反应式为MnO2+e-+H+MnOOH,总反应式为Zn+2MnO2+2H+Zn2++2MnOOH。
(2)维持电流强度为0.5 A,电池工作5分钟,则通过的电量是150 C,
8
因此通过电子的物质的量是≈1.554×10-3 mol,锌在反应中失去2个电子,则理论消耗Zn的质量是×65 g·mol-1≈0.05 g。
(3)废电池糊状填充物加水处理后过滤,滤液中主要有氯化铵和氯化锌,根据溶解度表可知氯化锌的溶解度受温度影响变化较大,所以二者可以通过结晶分离获得,即通过蒸发浓缩、冷却结晶实现分离。滤渣的主要成分是二氧化锰、碳粉、MnOOH,在空气中加热,碳燃烧生成二氧化碳,MnOOH被氧化为二氧化锰。所以欲从中得到较纯的二氧化锰,最简便的方法是在空气中加热。
答案:(1)MnO2+e-+H+MnOOH
Zn+2MnO2+2H+Zn2++2MnOOH
[注:式中Zn2+可写为Zn(NH3,Zn(NH3)2Cl2等,H+可写为N]
(2)0.05
(3)蒸发浓缩、冷却结晶 碳粉 MnOOH 在空气中加热 碳粉转变为CO2,MnOOH被氧化为MnO2
1.下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是 ( )
A.Na2O2、Al2(SO4)3、MgCl2、K2CO3
B.BaCl2、Na2SO4、(NH4)2SO4、KOH
C.AgNO3、NaCl、KCl、CuCl2
D.Fe2(SO4)3、K2CO3、KHSO4、NH4Cl
【解析】选C。A选项可按下列顺序区别:Na2O2(淡黄色)→生成白色沉淀且不溶解的为MgCl2,生成白色沉淀又溶解的为Al2(SO4)3,最后剩余K2CO3;B选项可用两两相混的方法来区别;D选项的检出顺序为Fe2(SO4)3→K2CO3→KHSO4→NH4Cl;C选项不能区别,故正确答案为C项。
2.某同学进行了如图所示的实验,由实验现象得到的结论中正确的是 ( )
8
A.原溶液中一定只含有S
B.原溶液中一定含有S和Cl-
C.原溶液中一定只含有Cl-
D.原溶液中可能含有S,也可能含有Cl-
【解析】选D。能够与氯化钡反应生成不溶于稀盐酸的沉淀的离子有S或Ag+,由于步骤①中加入氯化钡溶液,引进了Cl-,步骤③也无法确定是否存在氯离子,所以无法确定原溶液中一定存在的离子,故选D。
3.某溶液A可能含有Na+、Fe3+、Ba2+、N、Cl-、S、HC、HS中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验(假设气体全部逸出,忽略H2O2分解)
下列说法不正确的是 ( )
A.溶液A中一定不存在Fe3+、S
B.溶液A中肯定存在HC、HS、Ba2+、N
C.溶液A中一定存在Cl-,且n(Cl-)=0.01 mol
D.溶液A中可能存在Na+,为了确定是否存在,可取溶液通过焰色反应验证
【解析】选C。某溶液A中加入足量盐酸酸化的H2O2溶液生成2.33 g沉淀和
0.224 L的气体1,则沉淀一定是0.01 mol BaSO4,气体1是0.01 mol二氧化碳,所以溶液A中一定含有0.01 mol Ba2+、0.01 mol HC,一定没有S;同时可知一定有0.01 mol HS;HC与Fe3+发生双水解反应,所以一定没有Fe3+;加入过量氢氧化钡,生成
8
0.17 g气体2,气体2一定是氨气,则溶液A中一定含有
0.01 mol N;根据电荷守恒,一定含有Cl-;不能确定是否有Na+,若没有Na+,n(Cl-)=0.01 mol,若有Na+,n(Cl-)>0.01 mol;根据以上分析,溶液A 中一定不存在Fe3+、S,故A正确;溶液A中肯定存在HC、HS、Ba2+、N,故B正确;溶液A 中一定存在Cl-,且n(Cl-)=0.01mol,故C错误;Na+焰色反应呈黄色,溶液A中可能存在Na+,为了确定是否存在,可取溶液通过焰色反应验证,故D正确。
4.某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下研究过程。该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
(1)装置1气密性的检验方法 __________________。
(2)若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 _________
_________________________。
(3)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:__________________。
【解析】(1)根据图示,检验装置1的气密性的方法为用止水夹夹紧1-2处橡胶管,打开分液漏斗活塞,然后向分液漏斗加水至形成一段液柱,一段时间后液柱不再下降,证明气密性良好;
(2)由题意可知,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置6中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以生成物为碳酸钠和CO,反应的化学方程式为2Na+2CO2Na2CO3+CO;
(3)根据碳不溶于水分析,将装置4中固体加足量水,有不溶黑色固体,则生成物中有碳。
答案: (1)用止水夹夹紧1-2处橡胶管,打开分液漏斗活塞,然后向分液漏斗加水至形成一段液柱,一段时间后液柱不再下降,证明气密性良好
(2)2Na+2CO2Na2CO3+CO
8
(3)将4中固体加足量水,若有不溶黑色固体,则生成物中有碳
5.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、N、S、Cl-、I-、HC。取该溶液进行实验:
实验步骤
实验现象
(1)取少量该溶液,测定溶液pH
pH=0
(2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热
有无色气体产生,气体遇空气变成红棕色
(3)取少量该溶液,加少量BaCl2溶液
有白色沉淀
(4)取(3)中上层清液,加足量AgHO3溶液
有白色沉淀,且不溶于稀硝酸
(5)取少量该溶液,加NaOH溶液
有白色沉淀,NaOH过量时沉淀部分溶解
由此判断:
(1)溶液中肯定不存在的离子是________,溶液中肯定存在的离子是________。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论):
__________________。
【解析】根据无色透明溶液,则原溶液中无Fe2+;根据实验(1)pH=0,呈酸性,则原溶液中无HC;根据实验(2)中的现象,原溶液中含有N,由于N(H+)具有强氧化性,则原溶液中无I-;根据实验(3),原溶液中含S,根据离子共存原则,则无Ba2+;由于在实验(3)中加入的是BaCl2,引入了Cl-,无法证明原溶液中是否有Cl-;根据实验(5)原溶液中含有Mg2+和Al3+。综上所述,溶液中一定不存在Fe2+、HC、I-,Ba2+,肯定存在N、S、Mg2+、Al3+,可能存在K+、Cl-。
答案:(1)Fe2+、HC、I-、Ba2+ N、S、Mg2+、Al3+
8
(2)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有(答案合理即可)
8
相关文档
- 2018届高考二轮复习苏教版第21讲物2021-07-0221页
- 2019届一轮复习人教版第30讲物质的2021-07-0215页
- 2020届高考化学一轮复习(山东专用) 2021-07-0217页
- 2019届一轮复习物质的检验、分离和2021-07-0216页
- 2021届高考化学一轮复习物质的检验2021-07-025页
- 2018届高考二轮复习人教版排查补漏2021-07-027页
- 2013高考综合复习 专题三物质的检2021-05-148页
- 高考化学新课标一轮总复习课时作业2021-05-1412页
- 高考化学总复习对对练考点24物质的2021-05-146页
- 备考高考化学150天全方案之排查补2021-05-136页