- 1.21 MB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第五章 物质结构 元素周期律
[考纲解读] 1.了解元素、核素和同位素的含义。2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。3.了解原子核外电子排布;掌握原子结构示意图。4.掌握元素周期律的实质。了解元素周期表的结构(周期、族)及其应用。5.以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。6.以第ⅠA和第ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。7.了解金属、非金属在元素周期表中的位置及其性质递变的规律。8.了解化学键的定义。了解离子键、共价键的形成。9.掌握电子式的表示方法。
第17讲 原子结构 化学键
一、原子的构成
1.原子的构成粒子
2.原子中的4个数量关系
(1)质子数(Z)=核电荷数=核外电子数=原子序数。
(2)质量数(A)=质子数+中子数。
(3)阳离子的核外电子数=质子数-所带电荷数。如Mg2+的核外电子数是10。
(4)阴离子的核外电子数=质子数+所带电荷数。如S2-的核外电子数是18。
3.“三素”——元素、核素、同位素
(1)元素、核素、同位素的概念及相互关系
(2)同位素的特征与应用
①同位素的特征
- 19 -
a.化学性质相同,物理性质不同。
b.天然存在的同一元素各核素所占的原子百分数一般固定。
②常见的重要核素及其应用
核素
U
C
H
H
O
用途
核燃料
用于考古断代
制氢弹
示踪原子
二、原子核外电子排布规律
1.核外电子排布规律
2.原子结构示意图
3.核外电子排布与元素性质的关系
(1)金属元素原子的最外层电子数一般小于4,较易失电子,易形成阳离子,在化合物中显正化合价。
(2)非金属元素原子的最外层电子数一般大于或等于4,较易得电子,活泼非金属原子易形成阴离子。在化合物中主要显负化合价。
(3)稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,化合价通常显0价。
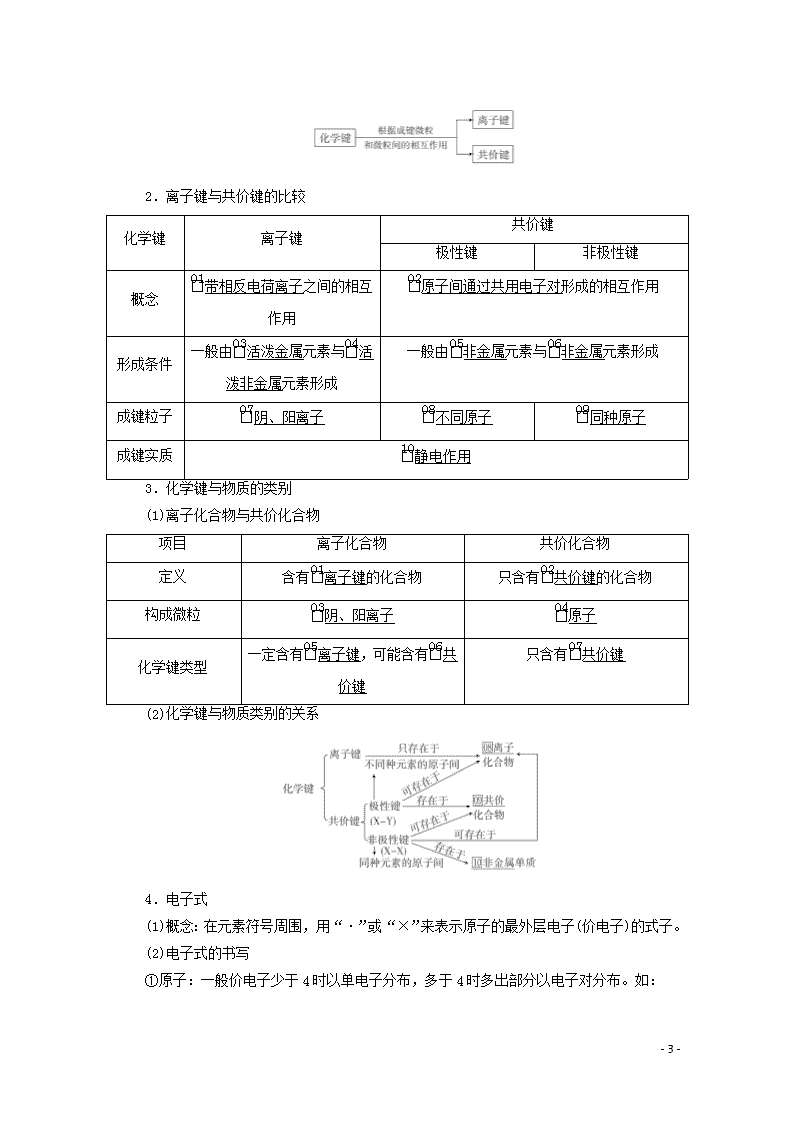
三、化学键
1.化学键
(1)概念:使离子相结合或原子相结合的作用力。
(2)分类
- 19 -
2.离子键与共价键的比较
化学键
离子键
共价键
极性键
非极性键
概念
带相反电荷离子之间的相互作用
原子间通过共用电子对形成的相互作用
形成条件
一般由活泼金属元素与活泼非金属元素形成
一般由非金属元素与非金属元素形成
成键粒子
阴、阳离子
不同原子
同种原子
成键实质
静电作用
3.化学键与物质的类别
(1)离子化合物与共价化合物
项目
离子化合物
共价化合物
定义
含有离子键的化合物
只含有共价键的化合物
构成微粒
阴、阳离子
原子
化学键类型
一定含有离子键,可能含有共价键
只含有共价键
(2)化学键与物质类别的关系
4.电子式
(1)概念:在元素符号周围,用“·”或“×”来表示原子的最外层电子(价电子)的式子。
(2)电子式的书写
①原子:一般价电子少于4时以单电子分布,多于4时多出部分以电子对分布。如:
- 19 -
NaNa MgMg Al
S Cl
②简单阳离子:其离子符号即电子式。如:Na+、Mg2+、Al3+。
③简单阴离子:写出元素符号,然后在其上、下、左、右标出最外层(包括得到的)电子数,并加“[ ]”围起来,然后在其右上角标出电荷。如:
S2- Cl-
④原子团:按原子间连接顺序将各原子的元素符号写出,然后将它们的最外层电子(包括得到和失去的一并分析)的共用和单独占有(孤电子对)情况在各元素符号周围标出,并加“[ ]”围起来,最后在其右上角标出电荷,注意相同原子不合并。如:
⑤单质及共价化合物
按原子间连接顺序将各原子的元素符号写出,然后将它们的最外层电子(包括得到和失去的一并分析)的共用和单独占有(孤电子对)情况在各元素符合周围标出,注意相同原子不合并,无“[ ]”,不标电荷。如:
⑥离子化合物:将化学式中离子的电子式按连接顺序写在一起,注意同性不相邻,相同不合并,离子合理分布。如:
NaOH
Na2O2
(3)用电子式表示化合物的形成过程
①离子化合物:左边是原子的电子式,右边是离子化合物的电子式,中间用“―
- 19 -
→”连接,用弯箭头表示出电子的转移方向,相同的原子或离子不合并。
如NaCl:
MgCl2:
②共价化合物:左边是原子的电子式,右边是共价化合物的电子式,中间用“―→”连接。
如HCl:。
四、范德华力、氢键
1.分子间作用力
(1)定义:把分子聚集在一起的作用力,又称范德华力。
(2)特点
分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
(3)变化规律
一般来说,对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。例如,熔、沸点:I2>Br2>Cl2>F2。
2.氢键
(1)定义:分子间存在的一种比分子间作用力稍强的相互作用。
(2)存在
氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点升高。
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)通过化学变化可以实现16O与18O间的相互转化。(×)
错因:同位素之间的转化不是化学变化,是核反应。
(2)所有物质中都存在化学键。(×)
错因:稀有气体中不存在化学键。
(3)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键。(×)
- 19 -
错因:H与卤素原子结合时形成共价键。
(4)非金属元素原子之间一定形成共价键,不可能形成离子键。(×)
错因:NH4Cl中NH与Cl-之间为离子键。
(5)最外层电子数为8的粒子一定是稀有气体元素原子。(×)
错因:Na+等最外层电子数为8,其不是稀有气体。
(6)CaCl2的电子式:。(×)
错因:CaCl2的电子式为。
(7)次氯酸(HClO)的电子式:。(×)
错因:HClO的电子式为。
2.教材改编题
(据人教必修二P11T4)放射性同位素铀U的原子核内的中子数与核外电子数之差为( )
A.143 B.92
C.51 D.32
答案 C
解析 U的原子核内的中子数与核外电子数之差为:235-92-92=51。
3.教材改编题
(据人教必修二P25T9)有以下9种物质:①Ne ②NH4Cl
③KNO3 ④NaOH ⑤Cl2 ⑥SO2 ⑦H2S ⑧Na2O2
⑨MgCl2
(1)既存在离子键又存在共价键的是________。
(2)不存在化学键的是________。
(3)属于共价化合物的是________。
(4)属于离子化合物的是________。
答案 (1)②③④⑧ (2)① (3)⑥⑦ (4)②③④⑧⑨
考点一 原子结构 核素
- 19 -
[解析] 40K的质子数是19,中子数是21,40Ca的质子数是20,中子数是20,A错误;原子最外层只有一个电子的元素不一定是金属元素,如氢元素是非金属元素,B错误;原子是由原子核和核外电子构成的,原子核由质子和中子构成,原子变成离子,变化的是核外电子,但核内质子不变,所以任何原子或离子的组成中都含有质子,C正确;互为同位素的不同核素间核外电子数相同,电子层排布相同,所以化学性质相同,但物理性质不同,D错误。
[答案] C
1.正确理解微粒的组成和结构
(1)有质子的原子不一定有中子,有质子的微粒不一定有电子。如H只有一个质子和一个电子,不含中子;H+只有一个质子,既没有中子也没有电子。
(2)质子数相同的粒子不一定属于同种元素,如Ne和H2O。
(3)任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子中。
(4)核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+、F-等,NH与OH-等。
(5)一个信息丰富的符号
2.正确理解元素、核素、同位素的概念
(1)元素、核素、同位素之间的关系
(2)不同核素可能具有相同的质子数,如H、H;也可能具有相同的中子数,如C、O;也可能具有相同的质量数,如C、N。
(3)核素之间的转化,既不是物理变化也不是化学变化,是核反应。
- 19 -
(4)同位素是指同一元素的不同“原子”间的关系,同素异形体是指同一元素的不同“单质”间的关系。
3.两种相对原子质量
(1)原子(即核素)的相对原子质量
一个原子(即核素)的质量与12C质量的的比值。一种元素有几种核素,就有几种不同核素的相对原子质量。
(2)元素的相对原子质量
是按该元素各种核素的相对原子质量和所占的原子百分比算出的平均值。如:Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。
1.下列说法不正确的是( )
①质子数相同的粒子一定是同一元素 ②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子 ③电子数相同的粒子不一定是同种元素 ④一种元素不能形成不同单质 ⑤某元素的相对原子质量取整数值就是质量数
A.②④⑤ B.①④⑤
C.②③④ D.②③
答案 B
解析 注意微观粒子包括原子、分子、离子等,H2O、NH3、Ne等微粒的质子数相同,不是同一种元素,所以①不正确,分析选项,选B(巧答)。
2.氢包括两种稳定核素:H和D,氧常见的核素有16O、17O和18O,下列有关说法正确的是( )
A.H2和D2互为同分异构体,其化学性质完全相同
B.HO、HO、HO互为同位素,都能与金属钠发生反应
C.18O2和18O3互为同素异形体,其密度之比为2∶3
D.电解一定量的DO时,阴、阳两极所得气体的质量之比约为2∶9
答案 D
解析 同分异构体的分子式相同,结构不同,H2和D2结构相同,A错误;16O、17O、18O互为同位素,HO、HO、HO既不互为同位素,也不是同素异形体,B错误;18O2和18O3互为同素异形体,但只有在同温同压下,它们的密度之比才为2∶3,C错误;电解一定量的DO时,阴、阳两极会收集到物质的量之比为2∶1的D2和18O2,其质量之比约为2∶9,D正确。
考点二 核外电子排布规律及应用
- 19 -
[解析] X、Y、Z是短周期主族元素,原子序数XX>Y,A错误;Z2X2Y4化学式是Na2C2O4,该物质属于强碱弱酸盐,水溶液显碱性,B正确;C2O没有很强的氧化性,C错误;Y与Z形成的两种常见化合物是Na2O、Na2O2,二者的阴、阳离子个数比都是1∶2,D错误。
[答案] B
1.1~20号元素的特殊的电子层结构
(1)最外层有1个电子的元素:H、Li、Na、K。
(2)最外层电子数等于次外层电子数的元素:Be、Ar。
(3)最外层电子数是次外层电子数2倍的元素:C。
(4)最外层电子数是次外层电子数3倍的元素:O。
(5)最外层电子数是内层电子数总数一半的元素:Li、P。
(6)最外层电子数是次外层电子数4倍的元素:Ne。
(7)次外层电子数是最外层电子数2倍的元素:Li、Si。
(8)次外层电子数是其他各层电子总数2倍的元素:Li、Mg。
(9)次外层电子数与其他各层电子总数相等的元素:Be、S。
(10)电子层数与最外层电子数相等的元素:H、Be、Al。
2.寻找“10电子”粒子和“18电子”粒子的方法
(1)“10电子”粒子
(2)“18电子”粒子
- 19 -
3.质子数和核外电子数分别相等的两种微粒关系
(1)可以是两种原子,如同位素原子。
(2)可以是两种分子,如CH4、NH3等。
(3)可以是两种带电荷数相同的阳离子,如NH、H3O+。
(4)可以是两种带电荷数相同的阴离子,如OH-、F-。
3.(2019·湖南名校高三大联考)A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素,A的单质是最理想的燃料,C原子次外层电子数是最外层的,E与C同主族。下列说法不正确的是( )
A.元素F的最高价氧化物对应的水化物一定是一种强酸
B.元素D与A一定形成共价化合物
C.元素B可能与元素A形成多种共价化合物
D.若元素D是非金属元素,则D的单质可能是良好的半导体材料
答案 B
解析 由题干信息可推断出A为H,C为O,E为S,F为Cl。Cl元素的最高价氧化物对应的水化物HClO4是一种典型的强酸,A项正确;D是F、Na、Mg、Al、Si、P元素中的一种,其中Mg、Na与H形成的化合物均是离子化合物,B项错误;若B为C元素,则其能与H元素形成多种共价化合物,C项正确;若D是Si元素,则其单质是良好的半导体材料,D项正确。
4.A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:
①A++C-===D+E↑;②B++C-===2D。
请回答:
(1)C-的电子式是____________。
(2)分别写出A+和D反应、B+和E反应的离子方程式:____________________、____________________。
(3)除D、E外,请再写出两种含10个电子的分子的分子式________________。
答案 (1)
(2)NH+H2ONH3·H2O+H+ H3O++NH3===NH+H2O
(3)CH4、Ne、HF(任选两种即可)
- 19 -
解析 因A+、C-、D、E均为10电子微粒,且A++C-===D+E↑,则A+为NH,C-为OH-,E为NH3,D为H2O,进而推知B+为H3O+。
考点三 化学键 物质构成
[解析] 根据题意,可以推断X为Ca、Y为Cl、Z为S、W为C。
(3)CS2为共价化合物,A错误;元素的非金属性越强,其气态氢化物越稳定,故稳定性HCl>H2S,C错误;核外电子总数相同的简单离子,质子数越大,半径越小,所以r(Ca2+)e>d>c>b
B.化合物Z中既含有极性键又含有非极性键
C.X与T在光照条件下反应只能生成两种不同的产物
D.电解熔融的W可以制备d的单质
答案 D
解析 a、b、c、d、e、f为原子序数依次增大的主族元素,原子序数均不大于20。b和c形成的一种化合物Z能造成温室效应,则b和c分别为碳元素和氧元素,Z为二氧化碳;a分别与b、c可形成10电子分子X和Y,则a为氢元素,X和Y分别为甲烷和水;d的氧化物W具有两性,则d为铝元素,W为氧化铝;e的单质T常温下为黄绿色气体,则e为氯元素,T为氯气;a与f同主族且f原子序数大于氯元素,则为钾元素。电子层数越多,原子半径越大,同周期主族元素从左到右原子半径依次减小,故原子半径:f>d>e>b>c,A错误;化合物Z为二氧化碳,只含有极性键,B错误;X与T在光照条件下反应能生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢,C错误;电解熔融的W(氧化铝)可以制备d的单质铝,D正确。
二、非选择题(共28分)
13.(14分)现有部分短周期主族元素的性质或原子结构如下表所示:
元素编号
元素性质或原子结构
X
周期序数=主族序数=原子序数
Y
原子最外层电子数为a,次外层电子数为b
Z
原子L层电子数为a+b,M层电子数为a-b
M
单质在自然界中的硬度最大
N
位于第三周期,最外层电子数是电子层数的2倍
(1)写出X、Y、Z、N四种元素的名称:X________,Y________,Z________,N________。
(2)由X、Y、Z、M、N五种元素两两组成的分子中,许多分子含有的电子数相等,写出符合下列要求的分子式:
①含10e-且呈正四面体结构的分子________;
②含14e-的双原子分子________;
③含16e-且能使溴水褪色的分子________;
④含18e-且常温下呈液态的分子________。
答案 (1)氢 氧 硅 硫
(2)①CH4 ②CO ③C2H4 ④H2O2
解析 (1)根据周期序数=主族序数=原子序数,推知X为氢元素;根据电子数L层=a+b,M层=a-b,最外层为a,次外层为b,得出b=2,a=6,从而推得Y、Z分别为氧元素、硅元素;金刚石在自然界中的硬度最大,故M为碳元素,N位于第三周期且最外层电子数是电子层数的2倍,则推得N为硫元素。
- 19 -
(2)①CH4为正四面体分子。②CO为双原子14e-分子。③乙烯为16e-分子,能和溴水发生加成反应,使溴水褪色。④H2O2含18e-在常温下为液态。
14.(14分)已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1∶2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。
请回答:
(1)写出B单质的电子式________。写出丙的结构式____________。
(2)戊与强碱反应的离子方程式:______________________________。
(3)丁中所包含的化学键类型有________(填字母)。
a.离子键
b.极性共价键
c.非极性共价键
(4)反应②中,0.5 mol NaClO参加反应时,转移1 mol电子,其化学方程式为___________________________。
答案 (1)
(2)Al(OH)3+OH-===AlO+2H2O
(3)bc
(4)2NH3+NaClO===N2H4+NaCl+H2O
解析 根据信息,丙是NH3,丁是N2H4,戊是Al(OH)3 ,D是H2,B是N2 ,A是Al,甲是AlN,乙是Al2O3。
(4)NH3与0.5 mol NaClO反应,转移1 mol电子,所以ClO-被还原为Cl-。
- 19 -
相关文档
- 浙江省浙北G22019-2020学年高一下2021-07-0310页
- 2021高考化学一轮复习专题质检卷52021-07-038页
- 2019-2020学年安徽省六安市舒城中2021-07-036页
- 【化学】天津市滨海新区2020届高三2021-07-0320页
- 2019-2020学年内蒙古第一机械制造(2021-07-0318页
- 2018届一轮总复习人教版第九章 电2021-07-0356页
- 化学(A)卷·2019届广西田阳高中高二12021-07-036页
- 2019届二轮复习元素周期律化学键作2021-07-039页
- 【化学】内蒙古锡林浩特市第六中学2021-07-0315页
- 2017-2018学年甘肃省兰州市第四中2021-07-037页