- 312.00 KB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
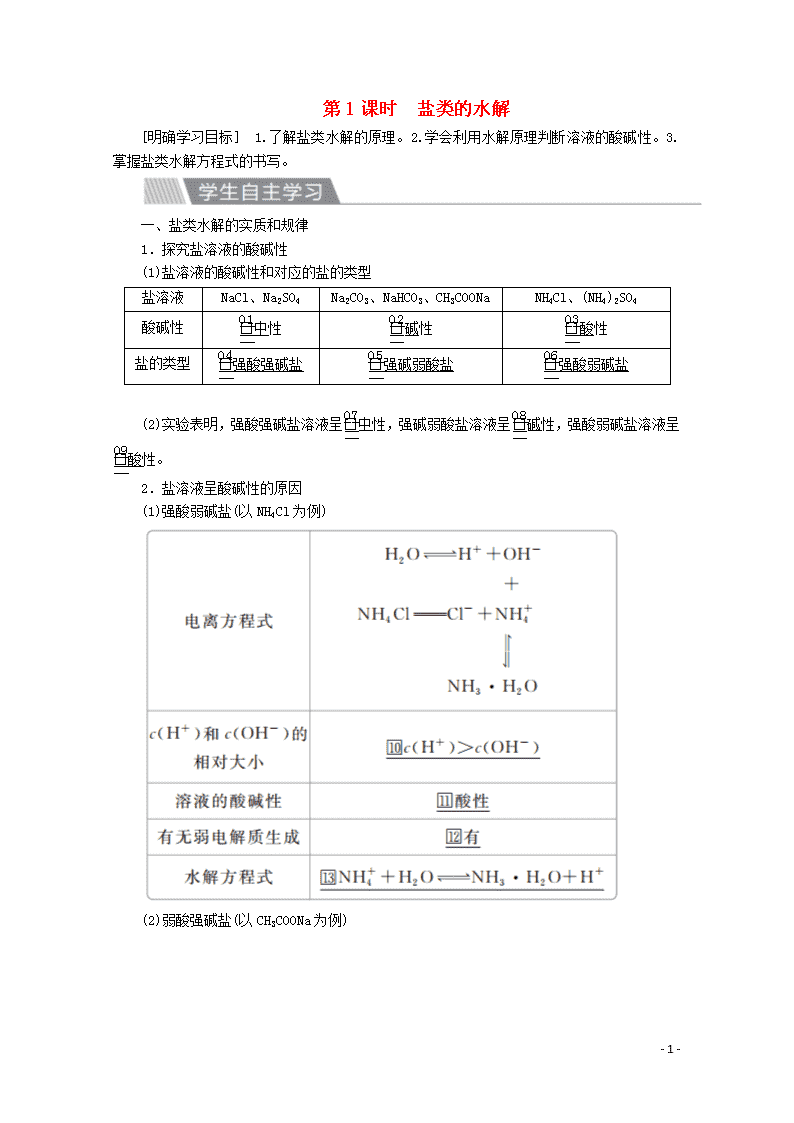
第1课时 盐类的水解
[明确学习目标] 1.了解盐类水解的原理。2.学会利用水解原理判断溶液的酸碱性。3.掌握盐类水解方程式的书写。
一、盐类水解的实质和规律
1.探究盐溶液的酸碱性
(1)盐溶液的酸碱性和对应的盐的类型
盐溶液
NaCl、Na2SO4
Na2CO3、NaHCO3、CH3COONa
NH4Cl、(NH4)2SO4
酸碱性
中性
碱性
酸性
盐的类型
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
(2)实验表明,强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性,强酸弱碱盐溶液呈酸性。
2.盐溶液呈酸碱性的原因
(1)强酸弱碱盐(以NH4Cl为例)
(2)弱酸强碱盐(以CH3COONa为例)
- 8 -
续表
3.盐类水解
(1)概念
在溶液中盐电离产生的阴、阳离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
(2)盐类的水解是中和反应的逆反应。
(3)结果
①生成弱酸或弱碱,促进了水的电离。
②破坏了水的电离平衡,使溶液呈现一定的酸碱性:强酸弱碱盐→酸性;强碱弱酸盐→碱性。
二、盐类水解离子方程式的书写
1.一元弱酸强碱盐:以CH3COONa为例:
CH3COO-+H2OCH3COOH+OH-。
2.一元弱碱强酸盐:以NH4Cl为例:
NH+H2ONH3·H2O+H+。
3.多元弱酸强碱盐(正盐):多元弱酸强碱盐水解是分步进行的,水解程度主要取决于
- 8 -
eq o(□,sup3(04))第一步反应,一般只写第一步。以Na2CO3为例:CO+H2OHCO+OH-。
4.多元弱碱强酸盐:多元弱碱强酸盐水解也是分步的,由于中间过程复杂,中学阶段仍写成一步,以CuCl2为例:Cu2++2H2OCu(OH)2+2H+。
5.多元弱酸的酸式盐:以NaHCO3为例:
HCO+H2OH2CO3+OH-。
1.盐类溶于水都一定水解吗?
提示:不一定。强酸强碱盐如:NaCl、NaNO3、K2SO4等就不水解。
2.Al2(SO4)3溶液和NaHCO3溶液混合,立即产生白色沉淀和大量气体,离子方程式如何书写?
提示:Al3++3HCO===Al(OH)3↓+3CO2↑
此类离子组有:Al3+与CO、HCO、S2-、HS-;Fe3+与CO、HCO。
- 8 -
一、盐类水解的实质和规律
1.盐类水解的实质
盐电离出的离子(弱碱阳离子或者弱酸阴离子)跟水电离出来的OH-或H+结合生成弱碱或弱酸,从而破坏了水的电离平衡,导致溶液中c(OH-)和c(H+)不相等,则溶液表现一定的酸碱性。
2.盐类水解的特点——逆、吸、弱、动
3.盐类水解及溶液酸碱性的规律(25 ℃)
[即时练]
1.下列能发生水解的粒子是( )
- 8 -
A.H B.Na+
C. D.CH3COO-
答案 D
解析 能发生水解的离子是弱酸根阴离子或弱碱阳离子,D项中CH3COO-能发生水解反应。
2.现有Fe3+、NH、Al3+、Na+、SO、AlO、S2-、SO、HCO、Cl-等离子,请按要求填空:
(1)水解使溶液呈碱性的离子是________。
(2)水解使溶液呈酸性的离子是________。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有________。
(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有________。
答案 (1)S2-、SO、AlO、HCO
(2)NH、Al3+、Fe3+
(3)Na+、SO、Cl-
(4)HCO
解析 (1)水解使溶液呈碱性的是弱酸的酸根离子:S2-、SO、AlO和HCO。
(2)水解使溶液呈酸性的是弱碱的阳离子:NH、Al3+、Fe3+。
(3)与酸和碱均不反应的是强酸的酸根离子或强碱的阳离子:Na+、SO、Cl-。
(4)与酸和碱均反应的是弱酸的酸式酸根离子:HCO。
规律方法
盐类水解的判定
在讨论盐溶液是否水解及水解后溶液的酸碱性时,先要抓住盐的组成进行分析。只有弱酸根(除Cl-、SO、NO、ClO、Br-、I-等以外的其他酸根)、弱碱阳离子(除K+、Na+、Ba2+、Ca2+、Rb+、Cs+等以外的其他阳离子)才水解。
二、盐类水解离子方程式的书写
1.盐类水解反应的离子方程式书写的一般模式:弱离子+H2O弱电解质+OH-(或H+)。
2.书写时注意的问题
(1)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,因此盐类水解的离子方程式中不标“↓”或“↑”,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
- 8 -
(2)盐类水解是可逆反应,是中和反应的逆反应,而中和反应是趋于完全的反应,所以盐的水解反应是微弱的,盐类水解的离子方程式一般不写“===”而写“”。
[即时练]
3.下列物质在常温下发生水解时,对应的水解方程式正确的是( )
A.Na2CO3:CO+H2O2OH-+CO2↑
B.NH4NO3:NH+H2ONH3·H2O+H+
C.CuSO4:Cu2++2H2OCu(OH)2↓+2H+
D.KF:F-+H2O===HF+OH-
答案 B
解析 A项,CO水解不会有CO2生成,错误;C项,不能生成Cu(OH)2沉淀,Cu(OH)2后不能标“↓”符号;D项,应用“”。
4.有下列五种盐溶液:①NaClO、②(NH4)2SO4、③Na2CO3、④AlCl3、⑤KNO3。回答下列问题:
(1)不会破坏水的电离平衡的是________,溶液呈酸性的是________,pH>7的是________(在室温下)。
(2)根据盐类水解的实质(弱离子+H2O)及水解反应的特点(可逆反应、程度微弱),写出下列盐类水解的离子方程式:
①NaClO:_______________________________________________________,
②(NH4)2SO4:____________________________________________________,
③Na2CO3:_______________________________________________________,
④AlCl3:_________________________________________________________。
答案 (1)⑤ ②④ ①③
(2)①ClO-+H2OHClO+OH-
②NH+H2ONH3·H2O+H+
③CO+H2OHCO+OH-
④Al3++3H2OAl(OH)3+3H+
解析 强酸强碱盐不水解,不影响水的电离平衡;强酸弱碱盐水解显酸性;强碱弱酸盐水解使溶液的pH>7。
规律方法
水解方程式书写的方法思路
(1)一判断:判断弱离子,书写化学式。
(2)二规范:写“”,不标“↑”“↓”。
(3)三注意:多元弱酸根分步水解,多元弱碱阳离子一步完成。
本章归纳总结
- 8 -
1.在盐类水解的过程中,下列说法正确的是( )
A.盐的电离平衡被破坏
B.水的电离程度一定会增大
C.溶液的pH一定会增大
D.c(H+)与c(OH-)的乘积一定会增大
答案 B
解析 大多数的盐为强电解质,在水中完全电离,A项错误;盐类水解促进水的电离,B项正确;强酸弱碱盐水解溶液呈酸性,pH减小,C项错误;一定温度下的稀溶液中,c(H+)与c(OH-)乘积是一个常数,D项错误。
2.下列物质的水溶液中,除了水分子外,不存在其他分子的是( )
A.HCl B.NH4NO3 C.Na2S D.HClO
答案 A
解析 A项HCl完全电离;B项NH水解,NH+H2ONH3·H2O+H+,有NH3·H2O分子;C项S2-水解,产生H2S分子;D项HClO是弱电解质,不完全电离,有HClO分子。
3.下列操作会促进H2O的电离,且使溶液pH>7的是( )
A.将纯水加热到90 ℃
B.向水中加少量NaOH溶液
C.向水中加少量Na2CO3溶液
D.向水中加少量FeCl3溶液
答案 C
解析 将纯水加热到90 ℃,水的电离程度增大,c(H+)=c(OH-)>10-7 mol·L-1,pH<7,A错误;向水中加少量NaOH溶液,水中c(OH-)增大,pH>7,但水的电离平衡向逆方向移动,即水的电离受到抑制,B错误;向水中加少量Na2CO3溶液,CO与H+结合,水中c(H+)减小,水的电离平衡向正方向移动,c(OH-)增大,c(OH-)>c(H+),pH>7,C正确;向水中加少量FeCl3溶液,Fe3+与OH-结合为弱电解质Fe(OH)3,水中c(OH-)减小,水的电离平衡向正方向移动,c(H+)增大,c(H+)>c(OH-),pH<7,D错误。
4.实验室有下列试剂,其中必须用带橡皮塞的试剂瓶保存的是( )
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水 ⑦浓HNO3 ⑧浓H2SO4
A.①⑥ B.①②③④⑥
- 8 -
C.①②③⑥⑦⑧ D.⑤⑦⑧
答案 B
解析 碱及水解呈碱性的盐,因OH-可与玻璃中的SiO2反应生成硅酸盐,使试剂瓶与玻璃瓶塞粘连,因而不能用带玻璃塞的试剂瓶保存,必须用带橡胶塞的试剂瓶保存。酸性及强氧化性物质不能用带橡胶塞的试剂瓶保存。
5.在一定条件下发生下列反应,其中属于盐类水解反应的是( )
A.NH+2H2ONH3·H2O+H3O+
B.HCO+H2OH3O++CO
C.HS-+H+H2S
D.Cl2+H2OH++Cl-+HClO
答案 A
解析 判断离子反应是否是水解反应或电离反应,可以将反应物和生成物中(一般含H3O+)分别去掉一个水分子,看反应能否成立。其中B是电离,D是氯气溶于水后存在的平衡。
6.(1)某二元酸(化学式用H2A表示)在水中的电离方程式是H2A===H++HA-,HA-H++A2-。
试完成下列问题:
Na2A溶液显________(填“酸性”“中性”或“碱性”)。理由是_________
(用离子方程式表示)。
(2)常温下,pH=5的NH4Cl溶液与pH=5的HCl溶液中由水电离出的c(H+)分别是________、________。
答案 (1)碱性 A2-+H2OHA-+OH-
(2)10-5 mol·L-1 10-9 mol·L-1
解析 (1)根据题意可知H2A第一步完全电离,第二步部分电离,所以HA-不水解,A2-水解。所以Na2A溶液显碱性,A2-+H2OHA-+OH-。
(2)NH水解促进水的电离,溶液中的H+来源于水的电离,此时水电离出的c(H+)为10-5 mol·L-1,在HCl溶液中,OH-来源于水的电离,此时,水电离出的c(H+)为 mol·L-1=10-9 mol·L-1。
- 8 -
相关文档
- 高中化学第三章水溶液中的离子平衡2021-07-032页
- 2018届二轮复习选择题命题区间5—2021-07-0372页
- 2020_2021学年高中化学第三章水溶2021-07-0312页
- 化学第三章水溶液中的离子平衡第12021-07-036页
- 高中化学选修4第3章水溶液中的离子2021-07-029页
- 2018届二轮复习水溶液中的离子平衡2021-07-0234页
- 化学第三章水溶液中的离子平衡第12021-07-026页
- 2019高中化学 第三章 水溶液中的离2021-07-0215页
- 2021新高考化学二轮总复习学案:专题2021-07-0225页
- 高中化学第3章水溶液中的离子平衡2021-07-026页