- 1.49 MB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题 01 化学反应速率与化学平衡原理综合应用
1.【2016 新课标Ⅱ卷】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化
法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)
的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应
条件是________;提高丙烯腈反应选择性的关键因素是________。
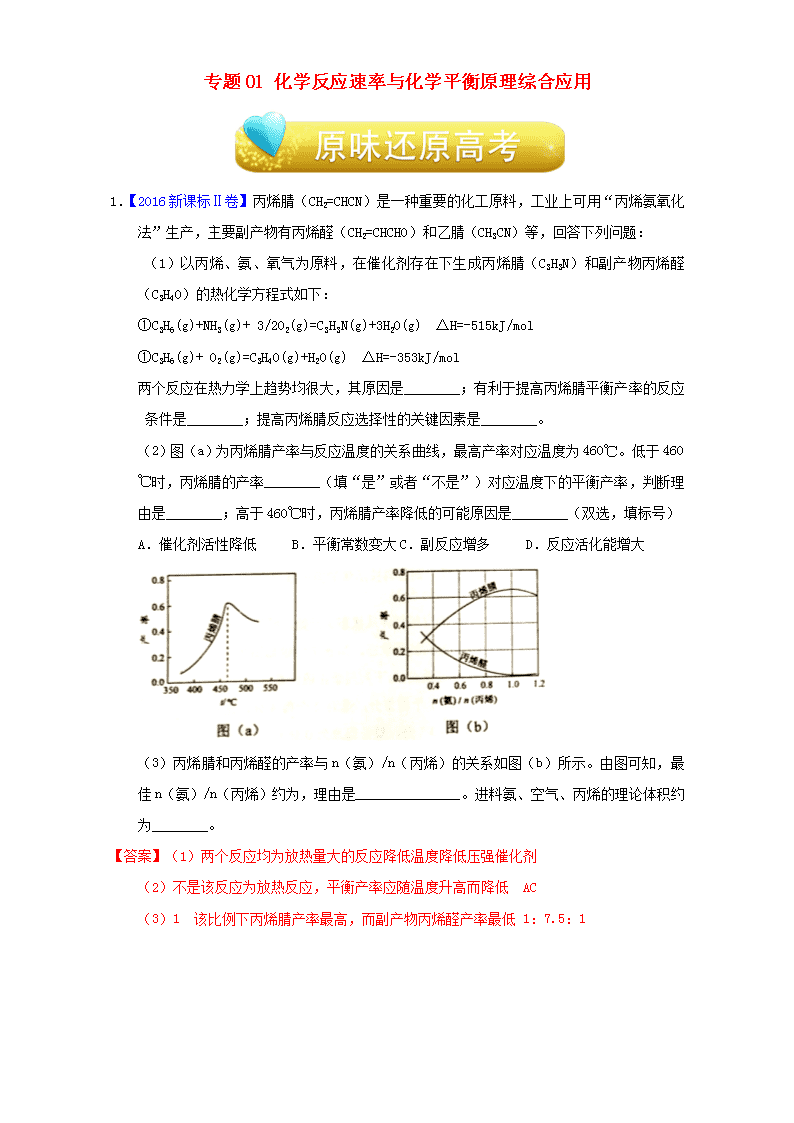
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为 460℃。低于 460℃
时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由
是________;高于 460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与 n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最
佳 n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约
为________。
【答案】(1)两个反应均为放热量大的反应降低温度降低压强催化剂
(2)不是该反应为放热反应,平衡产率应随温度升高而降低 AC
(3)1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1:7.5:1
2.【2016 新课标Ⅲ卷】煤燃烧排放的烟气含有 SO2 和 NOx,形成酸雨、污染大气,采用 NaClO2
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2 的化学名称为_______。
(2)在鼓泡反应器中通入含有 SO2 和 NO 的烟气,反应温度为 323 K,NaClO2 溶液浓度为 5×10
−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 SO4
2− SO3
2− NO3− NO2− Cl−
c/(mol·L−1) 8.35×10−4 6.87×10−6 1.5×10−4 1.2×10−5 3.4×10−3
①写出 NaClO2 溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO 的转化率
______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的 pH 逐渐______(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是
除了 SO2 和 NO 在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2 溶液脱硫、脱硝的反应中,SO2 和 NO 的平衡分压 pe 如图所示。
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增
大”、“不变”或“减小”)。
②反应 ClO2−+2SO3
2−===2SO4
2−+Cl−的平衡常数 K 表达式为___________。
(4)如果采用 NaClO、Ca(ClO)2 替代 NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2 相比 NaClO 具有的优点是_______。
②已知下列反应:
SO2(g)+2OH− (aq) ===SO3
2− (aq)+H2O(l) ΔH1
ClO− (aq)+SO3
2− (aq) ===SO4
2− (aq)+Cl− (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO4
2−(aq)ΔH3
则反应 SO2(g)+ Ca2+(aq)+ ClO− (aq) +2OH− (aq) === CaSO4(s) +H2O(l) +Cl− (aq)的
ΔH=______。
【答案】(1)亚氯酸钠;(2)①4OH-+3ClO2
-+4NO=4NO3
-+3Cl-+2H2O;提高②减小;
③大于;NO 溶解度较低或脱硝反应活化能较高(3)①减小;②
2 2
4
2 2
2 3
(Cl ) (SO )
(ClO ) (SO )
c cK c c
(4)①形成 CaSO4 沉淀,反应平衡向产物方向移动,SO2 转化率提高②△H1+△H2-△H3
【解析】
【考点定位】考查氧化还原反应、盖斯定律、外界条件对反应速率和平衡状态的影响等
【名师点睛】本题考查物质的名称、氧化还原反应方程式的书写、勒夏特列原理、图表数据和
图像、盖斯定律等化学理论知识,体现了知识的运用能力。平时的学习中注意对选修 4 学
习。依据题目中所给数据,再根据电子守恒、电荷守恒、原子守恒书写离子反应方程式;
化学平衡原理适用于任何化学平衡,如果改变影响平衡的一个条件,化学平衡会向能够减
弱这种改变的方向移动。化学平衡常数:一定条件下达到化学平衡,生成物浓度的幂之积
和反应物浓度的幂之积的比值,只受温度的影响;盖斯定律是对于一个化学反应,无论是
一步完成还是分几步完成,其反应热效应是相同的。本题是综合性试题,难度适中。
1、控制变量法探究影响化学反应速率的因素:影响化学反应速率的因素有多种,在探究相
关规律时,需要控制其他条件不变,只改变某一个条件,探究这一条件对反应速率的影响。
变量探究实验因为能够考查学生对于图表的观察、分析以及处理实验数据归纳得出合理结
论的能力,因而在这几年高考试题中有所考查。解答此类题时,要认真审题,清楚实验目
的,弄清要探究的外界条件有哪些。然后分析题给图表,确定一个变化的量,弄清在其他
几个量不变的情况下,这个变化量对实验结果的影响,进而总结出规律。然后再确定另一
个变量,重新进行相关分析。但在分析相关数据时,要注意题给数据的有效性。
2、“惰性气体”对化学平衡的影响:
①恒温、恒容条件:原平衡体系 充入惰性气体
体系总压强增大→体系中各组分的浓度不
变→平衡不移动。
②恒温、恒压条件:原平衡体系 充入惰性气体
容器容积增大,各反应气体的分压减小→
体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3、勒夏特列原理(平衡移动原理):
(1)不要把 v 正增大与化学平衡向正反应方向移动等同,只有 v 正>v 逆时,才使化学平衡
向正反应方向移动。
(2)不要把化学平衡向正反应方向移动与反应物转化率的提高等同,当反应物总量不变时,
化学平衡向正反应方向移动,反应物的转化率提高;当增大一种反应物的浓度,使化学平
衡向正反应方向移动时,会使另一种反应物的转化率提高,而本身的转化率降低。
(3)对原理中“减弱这种改变”的正确理解是升高温度时,化学平衡向吸热反应的方向移
动;增加反应物,化学平衡向反应物减少的方向移动;增大压强时,化学平衡向气体体积
缩小的方向移动。
(4)结果只是减弱了外界条件的变化,而不能完全抵消外界条件的变化。达到新化学平衡
时,此物理量更靠近改变的方向。如增大反应物 A 的浓度,化学平衡右移,但达到新化学
平衡时,A 的浓度比原化学平衡时大;同理,若改变的条件是温度或压强等,其变化也相
似。
(5)平衡移动原理不仅能用于判断化学平衡的移动方向,也能用于判断溶解平衡等其他平
衡移动的方向,可以说,平衡移动原理对所有的动态平衡都适用,如电离平衡、水解平衡
等。
(6)平衡移动原理能用来判断平衡移动的方向,但不能用来判断建立新平衡所需要的时间。
4、化学反应速率和化学平衡图像类试题是高考的热点题型,该类试题经常涉及到的图像类
型有物质的量(浓度)、速率—时间图像、含量—时间—温度(压强)图像、恒温、恒压曲线
等,图像中蕴含着丰富的信息量,具有简明、直观、形象的特点,命题形式灵活,难度不
大,解题的关键是根据反应特点,明确反应条件,认真分析图像充分挖掘蕴含的信息,紧
扣化学原理,找准切入点解决问题。
试题一般考查化学反应速率、化学平衡理论在化工生产中的应用,具体考点有:
(1)化学反应速率、化学平衡的相关计算;
(2)以图像、表格的形式考查影响化学反应速率的因素和化学平衡理论;
(3)外界条件对化学平衡的影响,以及对知识整合能力、分析和解决问题的能力;
(4)考查化学平衡常数,化学常数与温度、反应热的关系;利用物质的平衡浓度与温度判
断化学平衡常数的大小,及用浓度商的关系判断是否达到平衡状态。
(5)用化学反应速率、化学平衡理论在化工生产中的应用,同时考虑生产成本和经济效益
等。
审清题意
这类试题一般与图像结合在一起,在分析过程中,从反应开始(正反应是
吸热还是放热、体积是增大还是减小),然后相关影响因素、平衡建立等
观察图像
一看面,看清横、纵坐标分别代表的量的意义;二看线,看准线的变化趋
势,看清是连续的还是跳跃的,是渐变还是突变,条件改变变化程度的大
小;三看点,弄清曲线上点的含义,特别是起点、交点、拐点、极值点等。
当出现三个变量时,先确定一个变量,然后讨论另外两个变量之间的关系。
联想规律
联想外界条件的变化对反应速率及化学平衡的影响规律,并紧扣可逆反应
的特征,将图像与反应方程式相结合,搞清相关关系。
做出判断
抓住有关概念和有关物质的性质、反应规律及图像的特点,通过对比分析,
做出正确的判断。
总结如下:
1.Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分 K 值.
反应
大气固氮
N2(g)+O2(g) 2NO(g)
工业固氮
N2(g)+3H2(g) 2NH3(g)
温度/℃ 27 2000 25 400 450
K 3.8×10-31 0.1 5×108 0.507 0.152
①分析数据可知:大气固氮反应属于____________(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因____________。
③已知上述工业固氮反应的反应热△H = -92 kJ/mol,1 molN2、1 molH2 分子中的化学键
断裂所吸收的能量分别为 946 kJ、436 kJ,则 N—H 键断裂所吸收的能量为 ____________。
(2)工业固氮反应中,在其他条件相同时,分别测定 N2 的平衡转化率在不同压强(P1、P2)
下随温度变化的曲线,如图所示的图示中,正确的是____________(填“A”或“B”);比
较 p1、p2 的大小关系:____________。
Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g)
(3)在一定温度下,将 1mol N2 和 3mol H2 混合置于体积不变的密闭容器中发生反应,
达到平衡状态时,测得气体总物质的量为 2.8mol。
①达平衡时,H2 的转化率α1= ________。
②已知平衡时,容器压强为 8 MPa,则平衡常数 Kp= __________(保留小数点后两位数,用
平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)NO2、O2 和熔融 NaNO3 可制作燃料电池,其原理见图。
该电池在使用过程中石墨 I 电极上生成氧化物 Y,其电极反应为_________。
【答案】吸热 K 值小,正向进行的程度小(或转化率低),不
适合大规模生产 391 kJ/molAp2>pl60%0.26 (MPa)-2NO2+NO3
--e-=N2O5
2.氨气在生产、生活和科研中应用十分广泛。
(1)以 CO2 与 NH3 为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+72kJ·mol-1
H2O(l)=H2O(g) △H=+44kJ·mol-1
则反应 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=______kJ·mol-1
(2)某温度下,向容积为 100 ml 的密闭容器中通入 4molNH3 和 2molCO2 发生反应
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),物质 X 的浓度变化曲线如下图所示。
①前 5s 内,v(H2O)=__________。
②该条件下的平衡常数 K=_______。
(3)T℃时,将等物质的量的 NO 和 CO 充入体积为 2L 的密闭容器中,保持温度和体积不变,
反应过程(0——15min)中 NO 的物质的量随时间的变化如图所示。
①平衡时若保持温度不变,再向容器中充入 CO、N2 各 0.8mol,平衡将____(填“向左”“向
右”或“不”)移动。
②图中 a、b 分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过
程中 n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)。
③15min 时,若改变外界反应条件,导致 n(NO)发生如图所示的变化,则改变的条件可能是
____。
(4)垃圾渗滤液中含有大量的氨氮物质(用 NH3 表示)和氯化物,把垃圾渗滤液加入如图
所示的电解池(电极为惰性材料)中进行电解除去 NH3,净化污水。该净化过程分两步:第
一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成 N2。
①写出第二步反应的化学方程式_________。
②若垃圾渗滤液中氨氮物质的含量为 1.7%,则理论上电解 1t 该污水,电路中转移的电子
数为________。
【答案】-1311mol·L - 1·s - 12.5×10 - 3 向右 b 增大 CO 的物质的量浓度(或增大压强)
3Cl2+2NH3=N2+6HCl(或 3Cl2+8NH3=N2+6NH4Cl)3×103NA
点晴:侧重于考查学生对基础知识的综合应用能力和计算能力,注意把握三段式在化学平衡计
算中的应用,注意题干信息的应用是关键,该电解池(电极为惰性材料)电解除去 NH3,净化污
水.该净化过程分两步:第一步电解产生氧化剂,即产生能将氨氧化为氮气的物质,第二步氧
化剂氧化氨氮物质生成 N2,据电解池的工作原理结合发生的反应来回答。
3.雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物 PM2.5,
其主要来源为燃煤、机动车尾气等。因此,对 PM2.5、SO2、NOx 等进行研究具有重要意义。
请回答下列问题:
(1)将 PM2.5 样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 K+ Na+ NH4
+ SO4
2- NO3
- Cl-
浓度 mol/L 4×10-6 6×10-6 2×10-5 4×10-5 3×10-5 2×10-5
根据表中数据判断试样的 pH=_________。
(2)汽车尾气中 NOx 和 CO 的生成:
①已知汽缸中生成 NO 的反应为:N2(g)+O2(g) 2NO(g) △H>0 恒温,恒容密闭容器中,
下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO 的物质的量之比为 1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生 CO,有人设想按下列反应除去 CO,2CO(g)=2C(s)+O2(g),已
知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少 SO2 的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含 SO2 的烟气。
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g) 2CO2(g)+N2(g);△H<0,若该
反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到 t1 时刻达到
平衡状态的是_________(填序号)。(如图中 v 正、K、n、w 分别表示正反应速率、平衡常
数、物质的量、质量分数)
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性
炭可处理大气污染物 NO。在 5L 密闭容器中加入 NO 和活性炭(假设无杂质)。一定条件下
生成气体 E 和 F。当温度分别在 T1℃和 T2℃时,测得各物质平衡时物质的量(n/mol)如下
表:
物质
温度/℃
活性炭 NO E F
初始 3.000 0.10 0 0
T1 2.960 0.020 0.040 0.040
T2 2.975 0.050 0.025 0.025
(1)写出 NO 与活性炭反应的化学方程式______________________;
(2)计算上述反应 T1℃时的平衡常数 K1=________;若 T1<T2,则该反应的△H________0(填
“>”、“<”或“=”)。
(3)上述反应 T1℃时达到化学平衡后再通入 0.1molNO 气体,则达到新化学平衡时 NO 的转
化率为________;
【 答 案 】 4D 不 能 C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3
kJ•mol-1BDC(s)+2NO(g)=CO2(g)+N2(g)4<80%
4.二甲醚(DME)被誉为“21 世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=−90.7 kJ·mol−1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=−23.5 kJ·mol−1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=−41.2 kJ·mol−1
回答下列问题:
(1)则反应 3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=___________kJ·mol−1。
(2)反应②达平衡后采取下列措施,能提高 CH3OCH3 产率的有___________。
A.加入 CH3OH B.升高温度 C.增大压强 D.移出 H2O E.使用催化剂
(3)以下说法能说明反应 3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)达到平衡状态的有
___________。
A.H2 和 CO2 的浓度之比为 3∶1
B.单位时间内断裂 3 个 H—H 同时断裂 1 个 C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
( 4 ) 一 定 量 的 CO2 与 足 量 的 碳 在 体 积 可 变 的 恒 压 密 闭 容 器 中 反 应 :
C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(p 分)=气体总压(p 总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550 ℃时,平衡后若充入惰性气体,
平衡__________(填“正移”、“逆移”或“不移动”)。
②650 ℃时,反应达平衡后 CO2 的转化率为_____________(保留 2 位有效数字)。
③T 时,用平衡分压代替平衡浓度表示的化学平衡常数 Kp=_________p 总。
【答案】−246.1;D;DE;>;正移;25%;0.5
5.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用 CO 或 CO2 来生产燃料甲醇。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 平衡常数
温度℃
500 800
①2H2(g)+CO(g) CH3OH(g) K1 2.5 0.15
②H2(g)+CO2(g) H2O (g)+CO(g) K2 1.0 2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) K3
(1)反应②是________________(填“吸热”或“放热”)反应。
(2)某温度下反应①中 H2 的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。
则平衡状态由 A 变到 B 时,平衡常数 K(A)_____________K(B)(填“>”、“<”或“=”)。
据反应①与②可推导出 K1、K2 与 K3 之间的关系,则 K3=_______(用 K1、K2 表示)。
(3)在 3 L 容积可变的密闭容器中发生反应②,已知 c(CO)与反应时间 t 变化曲线Ⅰ如右
上图所示,若在 t0 时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(4)一种甲醇燃料电池,使用的电解质溶液是 2mol·L-1 的 KOH 溶液。
请写出加入(通入)b 物质一极的电极反应式_________________;
每消耗 6.4g 甲醇转移的电子数为_______________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将 a mol/L 的醋酸与 b
mol/LBa(OH)2 溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含 a 和 b 的代数式表
示该混合溶液中醋酸的电离常数 Ka 为________________。
【答案】吸热=K1·K2 加催化剂将体积压缩为 2L
O2+4e-+2H2O = 4OH-1.2NA(1.2×6.02×1023)2×10-7b/(a-2b)
6.金属稼是一种广泛用于电子工业和通讯领域的重要金属,稼元素(31Ga)在元素周期表中位于
第四周期,IIIA 族,化学性质与铝元素相似。
(1)稼元素的原子结构示意图是_______________________。
(2)工业上利用 Ga 与 NH3 高温条件下合成固体半导体材料氮化稼(GaN)同时又有氢气生成。
反应中,每生成 3molH2 时就会放出 30.8kJ 的热量。
①反应的热化学方程式是________________________;
②反应的化学平衡常数表达式是________,温度升高时,反应的平衡常数_____________(填
“变大”“变小”或“不变”);
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是__________
A.I 图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温或加压
B.II 图像中纵坐标可以为镓的转化率
C.III 图像中纵坐标可以为化学反应速率
D.IV 图像中纵坐标可以为体系内混合气体平均相对分子质量
(3)工业上提纯镓的方法很多,其中以电解精炼法为多。具体原理如下:以待提纯的粗稼(内
含 Zn、Fe、Cu 杂质)为阳极,以高纯稼为阴极,以 NaOH 水溶液为电解质溶液。 在电流作
用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电
析出高纯镓。
① 己 知 离 子 氧 化 性 顺 序 为 : Zn2+
相关文档
- 江苏省2020届高考化学二轮复习仿真2021-07-0318页
- 2021高考化学全国通用一轮习题:第四2021-07-036页
- 2020高考化学考前微专题突破练十二2021-07-038页
- 全国版2021高考化学一轮复习第33讲2021-07-0349页
- 2021版高考化学一轮复习核心素养微2021-07-033页
- 2021版高考化学一轮复习课时提升作2021-07-039页
- 山东专用2020届高考化学二轮复习题2021-07-033页
- 2020届高考化学二轮复习有机合成与2021-07-038页
- 专题12 有机化学基础-备战2021年高2021-07-0329页
- 2021高考化学人教版一轮复习规范演2021-07-0314页