- 3.39 MB
- 2021-07-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
节
物质的检验、分离和提纯
考纲点击:
掌握常见物质检验、分离和提纯的方法。
回归教材
一、物质的分离和提纯
1.
物质分离、提纯的区别
(1)
物质的分离
将混合物的各组分分离开来,获得几种纯净物的过程。
(2)
物质的提纯
将混合物中的杂质除去而得到纯净物的过程,又叫物质的
净化或除杂。
方法
装置或主要仪器
说明
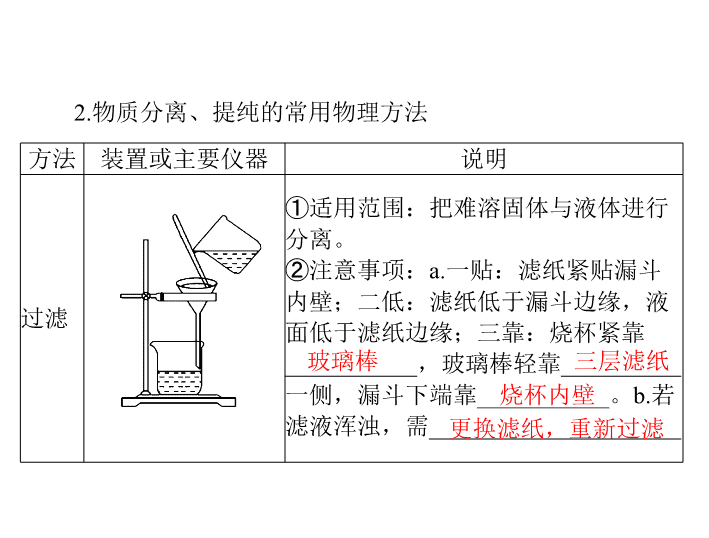
过滤
①
适用范围:把难溶固体与液体进行
分离。
②注意事项:
a.
一贴:滤纸紧贴漏斗
内壁;二低:滤纸低于漏斗边缘,液
面低于滤纸边缘;三靠:烧杯紧靠
___________
,玻璃棒轻靠
__________
一侧,漏斗下端靠
___________
。
b.
若
滤液浑浊,需
_____________________
2.
物质分离、提纯的常用物理方法
玻璃棒
三层滤纸
烧杯内壁
更换滤纸,重新过滤
(
续表
)
溶液飞溅
大量晶体
方法
装置或主要仪器
说明
蒸发
①
适用范围:分离固体溶质和溶剂。
②
注意事项:
a.
玻璃棒的作用:搅拌,防止局部温度过高造成
__________
。
b.
当有
____________
析出时,停止加热,用余热蒸干
(
续表
)
大
互不混溶
不反应
下口
上层
方法
装置或主要仪器
说明
萃取和分液
①
适用范围:
a.
萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来。
b.
分液:两种液体互不相溶,易分层。用于分离两种互不相溶的液体混合物。
②
注意事项:
a.
溶质在萃取剂中的溶解度要比在原溶剂中
____
。
b.
萃取剂与原溶剂
____________
。
c.
萃取剂与溶质
____________
。
d.
分液时,分液漏斗中的下层液体从
______
放出,
________
液体从上口倒出
方法
装置或主要仪器
说明
蒸馏
(
分馏
)
①
适用范围:互溶的
________
相差
较大的液体混
合物。
②注意事项:
a.
温度计的水银球在
蒸馏烧瓶的
____________
。
b.
蒸馏烧瓶中要加沸石或碎瓷片防
暴沸。
c.
冷凝管水流方向应为
__________
______________________
(
续表
)
沸点
支管口处
低进高出或
下口进上口出
方法
装置或主要仪器
说明
升华
①
适用范围:混合物中某种组分易升
华,利用物质易升华的性质在加热条
件下分离的方法。
②注意事项:应与物质的分解反应区
分,如
NH
4
Cl NH
3
↑
+
HCl↑
,
属于化学变化
(
续表
)
胶体
轻金属盐或铵盐
(
续表
)
方法
装置或主要仪器
说明
渗析
①
适用范围:分离提纯
________
与小分子
(
或离子
)
组成的混合液。
②
注意事项:要不断更换烧杯中的蒸馏水
(
或用流动水
)
以提高渗析效果
盐析
①
适用范围:利用蛋白质在加某些
______________________[
如
Na
2
SO
4
、
(NH
4
)
2
SO
4
等
]
时,其溶解度降低而析出的性质来分离的方法。
②
注意事项:盐析后过滤
[
特别提醒
]
创新装置
(1)
过滤装置的创新
——
抽滤
由于水流的作用,使图
1
装置
a
、
b
中气体的压强减小,故
使过滤速率加快。
图
1
(2)
蒸馏、冷凝装置的创新应用
图
2
图
3
图
4
图
2
、图
3
、图
4
,由于冷凝管竖立,使
液体混合物能冷凝
回流,若以此容器做反应容器,可使反应物循环利用,提高了
反应物的转化率。
(3)
洗气装置的创新
——
双耳球吸收法
图
5
图
5
中,
由于双耳球上端球形容器的容积较大,能有效地
防止倒吸。故该装置既能除去气体中的气态杂质,又能防止倒
吸。
方法
原理
典例
加热
分解法
混合物中混有热稳定性差
的杂质时,可直接加热,使
热稳定性差的杂质分解而
分离出去
纯碱中混有小苏打
沉淀法
在混合物中加入某试剂,使
杂质离子以沉淀形式分离
出去的方法
加适量
AgNO
3
溶液除去
KNO
3
溶液中的
KCl
3.
物质分离、提纯的化学方法
(
续表
)
方法
原理
典例
转化法
不能通过一次反应达到分离的目的时,要经过转化为其他物质才能分离,然后将转化物质恢复为原物质
分离
Fe
3
+
和
Al
3
+
时,可加入过量的
NaOH
溶液,生成
Fe(OH)
3
沉淀和
NaAlO
2
溶液,过滤后,向
Fe(OH)
3
中加入盐酸重新生成
Fe
3
+
,向
NaAlO
2
中通入过量
CO
2
,生成
Al(OH)
3
沉淀,过滤后向
Al(OH)
3
中加入盐酸重新生成
Al
3
+
酸碱
溶解法
被提纯物质不与酸碱反应,而杂质可与酸碱发生反应
用盐酸除去
SiO
2
中的石灰石,用
NaOH
溶液除去铁粉中的铝粉
(
续表
)
方法
原理
典例
氧化
还原法
①
对混合物中混有的还原性杂质,可加入适当的氧化剂将其氧化为被提纯物质;
②
对混合物中混有的氧化性杂质,可加入适当的还原剂将其还原为被提纯物质
通入
Cl
2
将
FeCl
3
中混有的
FeCl
2
氧化成
FeCl
3
,达到除杂目的;将过量铁粉加入混有
FeCl
3
的
FeCl
2
溶液中,振荡、过滤,可除去
FeCl
3
杂质
调节
pH
法
通过加入试剂来调节溶液的
pH
,使溶液中某种成分沉淀分离的方法
CaCl
2
溶液中含有
FeCl
3
杂质,由于
FeCl
3
的水解,溶液呈酸性,可采用调节溶液
pH
的方法将
Fe
3
+
沉淀,因此,可加
CaCO
3
(
续表
)
[
特别提醒
]
分离、提纯物质遵循的
“
四原则”“三必须”
二、物质的检验
1.
离子检验
(1)
常见阳离子
的检验
蓝色沉淀
白
灰绿
红褐
红
无明显
红
红褐
现象
⑤NH
4
④Al
3+
产生白色沉淀,继续加入
________
溶
液,白色沉淀又会
________
+
共热,生成使湿润的红色石蕊试纸
____
的气体
NaOH
溶解
变蓝
浅紫
黄
⑥K
+
火焰呈
________
色
(
透过蓝色钴玻璃
)
⑦Na
+
火焰呈
______
色
石蕊
甲基橙
材中给定的方法,如检验
Fe
3+
用
KSCN
溶液。
[
特别提醒
]
(1)
阳离子的检验除了一些特殊的方法
(
焰色反应、
KSCN
溶
液显色反应
)
外,我们一般用
NaOH
溶液即可鉴别。
(2)
在没有特殊要求时,如果有多种检验方法,应该选择教
(3)
含
Fe
3
+
、
Fe
2
+
的混合溶液中检验
Fe
2
+
的方法是加 入
K
3
[Fe(CN)
6
]
溶液,产生蓝色沉淀或滴加几滴酸性
KMnO
4
溶液,
KMnO
4
浅紫色褪去。
(2)
常见阴离子的检验
红
蓝
无
无
利用酸碱指示剂检验:
利用盐酸和其他试剂检验:
白色沉淀
刺激性
白色沉淀
HCO
3
-
HSO
3
-
Cl
-
、
Br
-
、
I
-
的检验:
Cl
-
Br
-
I
-
Br
-
①
硝酸酸化的硝酸银溶液。
I
-
蓝
[
特别提醒
]
2.
气体检验
(1)
可燃性气体的检
验
(2)
酸性气体的检验
先变浑浊后变澄清
褪去
又恢复红色
白烟
红
(3)
碱性气体
(NH
3
)
的检验
白烟
蓝
(4)
强氧化性气体的检验
(5)NO
的检验
——
无色气体,与空气接触后立即变为红棕
色。
复燃
黄绿
刺激性
蓝
红棕
刺激性
[
特别提醒
]
(1)
检验气体时,要防止气体之间的互相干扰,如
Cl
2
、
SO
2
均能使品红溶液褪色。
(2)
中学阶段只学过一种碱性气体,所以只要使湿润的红色
石蕊试纸变蓝的气体一般都是氨气。
基础测评
1.(2018
年山东威海模拟
)
下列实验操作正确的是
(
)
。
A.
向混有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶
液,振荡静置,用装置甲分液,放出水相后再从分液漏斗下口
放出有机相
B.
用装置乙加热分解法除去
Na
2
CO
3
中混有的少量
NaHCO
3
C.
用装置丙除去氯气中的
HCl
气体
D.
除去
Cu
粉中混有的
CuO
:加适量稀硫酸后,过滤、洗
涤
答案:
D
A.
冷水浸泡
B.
加热煎制
C.
箅渣取液
D.
灌装保存
2.(2016
年北京卷
)
下列中草药煎制步骤中,属
于过滤操作
的是
(
)
。
解析:
A
项,冷水浸泡属于物质的溶解,故错误;
B
项,
加热煎制属于加热,故错误;
C
项,箅渣取液属于过滤操作,
故正确;
D
项,灌装是液体转移,故错误。
答案:
C
选项
操作
现象
结论
A
向某浓溶液中加入铜
片和浓硫酸并加热
有红棕色刺激性
气味的气体产生
原溶液中一定
-
有
NO
3
B
向某溶液中滴入氯水,
再滴加
KSCN
溶液
溶液显红色
原溶液中一定
有
Fe
2+
C
向某无色溶液中加入
硝酸钡溶液
产生白色沉淀,沉
淀不溶于稀硝酸
原溶液中一定
-
2
有
SO
4
D
将某气体通入酸性
KMnO
4
溶液中
溶液褪色
该气体一定是
C
2
H
4
3.(2018
年陕西汉中模拟
)
根据实验操作和现象所得出的结
论正确的是
(
)
。
4.(2018
年河南郑州模拟
)
下列各组物质,不用任何试剂即
可鉴别的是
(
)
。
A.NaCl
、
NaBr
、
KI
三种无色溶液
B.HCl
、
NaCl
、
NaNO
3
、
Na
2
CO
3
四种溶液
C.NaBr
、
HCl
、
KCl
三种溶液
D.
淀粉、淀粉
-
碘化钾、碘化钾、溴水四种溶液
解析:
NaCl
、
NaBr
、
KI
三种无色溶液要用
AgNO
3
溶液鉴
别,
A
不符合题意;
HCl
、
NaCl
、
NaNO
3
、
Na
2
CO
3
四种溶液两
两混合,有气泡产生的是
HCl
和
Na
2
CO
3
两种溶液,依据互滴
法可鉴别
HCl
和
Na
2
CO
3
,剩余的是
NaCl
和
NaNO
3
两种溶液需
再用
AgNO
3
溶液鉴别,
B
不符合题意;
NaBr
、
HCl
、
KCl
三种
溶液需先用
Na
2
CO
3
溶液鉴别出
HCl
,再用
AgNO
3
溶液鉴别出
NaBr
和
KCl
,
C
不符合题意;淀粉、淀粉
-
碘化钾、碘化钾、溴
水四种溶液中溴水有颜色,溴水与碘化钾溶液
反应生成碘单质,
溶液颜色加深,溴水与淀粉
-
碘化钾溶液反应生成碘单质,碘单
质与淀粉反应使溶液呈蓝色,剩余的为淀粉溶液,
D
符合题意。
答案:
D
5.(2018
年安徽合肥模拟
)
根据下列实验事实得出的结论正
确的是
(
)
。
解析:
A
项,也可能含有
Ba
2+
;
B
项,也可能是
H
2
S
或
CO
气体;
C
项,也
可能是浓硝酸。
答案:
D
考点一
考向
1
物质的分离与提纯
古典文献中物质的分离、提纯方法
[
典例
1
](2017
年新课标
Ⅰ
卷
)《
本草衍义
》
中对精制砒霜过
程有如下
叙述:
“
取砒之法,将生砒就置火上,以器覆之,令
砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者
次之。”文中涉及的操作方法是
(
)
。
A.
蒸馏
B.
升华
C.
干馏
D.
萃取
解析:
“将生砒就置火上,以器覆之,令砒烟上飞着覆器,
遂凝结
……
”
,属于固体直接转化为气体,类似于碘的升华,
因此涉及的操作方法是升华,故选
B
。
答案:
B
下列说法错误的是
(
考向
2
根据物理性质选择分离方法
[
典例
2
](2018
年河南高中毕业班考前预测
)
按以下实验方案
可从海洋动物柄海鞘中提取具有
抗肿瘤活性的天然产物。
A.
步骤
(1)
需要过滤装置
C.
步骤
(3)
需要用到坩埚
)
。
B.
步骤
(2)
需要用到分液漏斗
D.
步骤
(4)
需要蒸馏装置
. .
解析:
滤液与不溶物是用过滤的方法分离的,
A
正确;分
离水层与有机层,需要用分液漏斗,
B
正确;溶液蒸发结晶应
用蒸发皿,
C
错误;用蒸馏的方法从有机层溶液中蒸出甲苯,
D
正确。
答案:
C
[
方法技巧
]
依据物理性
质选择分离、提纯的方法
(1)“
固+固
”
混合物的分离
(
提纯
)
(2)“
固+液
”
混合物的分离
(
提纯
)
(3)“
液+液”混合物的分离
(
提纯
)
考向
3
根据化学性质选择分离方法
[
典例
3
]
在测定
Na
2
SO
4
和
NaCl
的混合物中
Na
2
SO
4
的质量
分数时,常采用在混合物的溶液中加入过量
BaCl
2
溶液,沉淀
SO
2
-
,然后过滤、洗涤、烘干、称量得到
BaSO
4
质量的方法。
试问:
(1)
怎样判断
SO
2
-
是否沉淀完全?
(2)
过滤完毕后,为什么要洗涤沉淀
(
即洗涤沉淀的目的
)?
(3)
沉淀的洗涤方法?
(4)
怎样判断沉淀是否洗净?
4
4
若产生白色沉淀,说明
SO
2
-
未沉淀完全,反之则沉淀完
全。
答案:
(1)
取上层清液少许于试管中,再加入
BaCl
2
溶液,
(2)
洗去可溶性杂质
(Na
+
、
Cl
-
等
)
。
(3)
沿玻璃棒向漏斗中注水至浸没沉淀,待水自然流下后,
再重复
2
~
3
次。
(4)
取最后一次滤出液少许于试管中,滴加稀
HNO
3
酸化的
AgNO
3
溶液,若产生白色沉淀,说明
沉淀未洗净,反之已洗净。
4
[
答题模板
]
(1)
沉淀洗涤的答题模板
注洗涤液
(
沿玻璃棒向漏斗中注入洗涤液
)
↓
标准
(
使洗涤液完全浸没沉淀或晶体
)
↓
重复
(
待洗涤液流尽后,重复操作
2
~
3
次
)
(2)
沉淀是否洗净的答题模板
取样
(
取少量最后一次洗涤液于一洁净的试管中
)
↓
加试剂
[
加入
××
试剂
(
必要时加热,如检验
NH
+
)]
↓
现象
(
不产
生
××
沉淀、溶液不
变
××
色或不产生
××
气
体
)
↓
结论
(
说明沉淀已经洗涤干净
)
4
离出
X
的两种方案,下列说法中不合理的是
(
考向
4
物质分离提纯的实验方案及流程分析
[
典例
4
](2018
年重庆沙坪坝模拟
)
下图表示从原混合物中分
)
。
. . .
A.
若含
X
的混合物为溴水,可通过方案
Ⅰ
进行分离,加入
试剂为
CCl
4
,充分振荡后液体分层,下层为
X
的
CCl
4
溶液
B.
若含
X
的混合物为
BaSO
4
、
BaSO
3
的混合物,可通过方
案
Ⅱ
进行分离得到
X
,加入试剂为稀硝酸,
X
为
BaSO
4
C.
若含
X
的混合物为乙醇和乙酸乙酯的混合物,可通过方
案
Ⅰ
进行分离,加入试剂为饱和
NaOH
溶液,残留液中含有乙
酸钠
D.
若含
X
的混合物为
Fe
、
Al
,可通过方案
Ⅱ
进行分离,加
入的试剂是过量的
NaOH
溶液,
1 mol X
与足量氯气完全反应
时,转移
3 mol
电子
解析:
A
项,溴易溶于四氯化碳、微溶于水,四氯化碳的
密度比水的大,在混合液的下层,该方法合理;
B
项,
BaSO
3
被稀硝酸氧化成硫酸钡,然后通过过滤得到
BaSO
4
,该方法合
理;
C
项,分离乙醇和乙酸乙酯时,应该选用饱和碳酸钠溶液,
若用
NaOH
溶液,乙酸乙酯会与
NaOH
溶液反应,该方法不合
理;
D
项,铝可与
NaOH
溶液反应,铁与氯气反应生成氯化铁,
1 mol
铁与足量氯气完全反应时,转移
3 mol
电子,该描述合理。
答案:
C
[
思维建模
]
化学方法除杂的一般思路
【
拓展演练
】
1.(2018
年江苏卷
)
下列有关从海带中提取碘的实验原理和
装置能达到实验目的的是
(
)
。
甲
乙
丙
丁
A.
用装置甲灼烧碎海带
B.
用装置乙过滤海带灰的浸泡液
C.
用装置丙制备用于氧化浸泡液中
I
-
的
Cl
2
D.
用装置丁吸收氧化浸泡液中
I
-
后的
Cl
2
尾气
解析:
A
项,灼烧碎海带应用坩埚;
B
项,海带灰的浸泡
液用过滤法分离获得含
I
-
的溶液;
C
项,
MnO
2
与浓盐酸反应制
Cl
2
需要加热;
D
项,尾气
Cl
2
应用
NaOH
溶液吸收。
答案:
B
2.(2018
年河南平顶山检测
)
海洋植物如海带、海藻中含有
大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻
中提取碘的流程如下图:
(1)
实验室焙烧海带,需要下列仪器中的
______(
填字母
)
。
a.
试管
b.
烧杯
c.
坩埚
d.
泥三角
e.
三脚架
f.
酒精灯
(2)
指出提取碘的过程中有关的实验操作名称:①
______
,
③
________
。
(3)
提取碘的过程中,可选择的有机试剂是
______(
填字母
)
。
A.
甲苯、酒精
C.
汽油、乙酸
B.
四氯化碳、苯
D.
汽油、甘油
(4)
为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧
杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及
必要的夹持仪器、物品,尚缺少的玻璃仪器有
______________
、
______________
。
(5)
小组用
CCl
4
萃取碘水中的碘,在上
图的分液漏斗中,下
层液体呈
________
色;他们打开分液漏斗活塞,却未见液体流
下,原因
可能是
____________________________________
。
(6)
从含碘的有机溶液中提取碘和回收有机溶剂,还
须经过
蒸馏,指出下面实验装置图中的错误之处:
①_______________________________________________
;
②
_______________________________________________
;
③
_______________________________________________
。
(7)
进行上述蒸馏操作时,使用水浴加热的原因是
________
_______
,最后晶体碘在
________
里聚集。
解析:
海带要在坩埚中焙烧,选择萃取剂要与水互不相溶。
蒸馏操作时注意冷凝水的方向,加热烧杯要垫石棉网。
萃取分液
(3)B
答案:
(1)cdef (2)
过滤
(4)
分液漏斗
普通漏斗
(5)
紫红
分液漏斗上口活塞小孔未与空气相通
②
温度计插到了液体中
③
冷凝管进出
(6)①
缺石棉网
水的方向颠倒
(7)
使蒸馏烧瓶受热均匀,控制加热温度不至过高
蒸馏烧
瓶
考点二
考向
1
物质的检验
常见离子的检验
[
典例
5
](2018
年安徽淮北模拟
)
下列离子在未知溶液中的检
验方法正确的是
(
)
。
[
答题模板
]
离子检验简答题的答题模板
[
方法技巧
]
无色溶液中溶质的检验程序
选项
实验操作
现象
结论
A
将某气体通入
FeCl
2
溶液中
溶液由浅绿色
变为黄色
该气体中一定含
有
Cl
2
B
将某气体与湿润的
淀粉
-KI
试纸接触
试纸变蓝色
该气体一定是还
原性气体
C
将某气体通过灼热
的
CuO
粉末
粉末由黑变红
该气体中一定含
有
H
2
D
将某气体与湿润的
红色石蕊试纸接触
试纸变蓝色
该气体中一定含
有
NH
3
考向
2
气体的检验
[
典例
6
](2018
年天津塘沽模拟
)
下列有关实验操作、现象和
结论正确的是
(
)
。
解析:
A
项中气体还可能是
O
2
、
O
3
、
NO
2
等;
B
项中气体
一定是氧化性气体;
C
项中还可能是
CO
等。
答案:
D
[
答题模板
]
常见气体检验答题模板
(
以
CO
2
的检验为例
)
【
拓展演练
】
3.(2015
年天津卷
)
下列关于物质或离子检验的叙述正确的
是
(
)
。
解析:
A
项,
Fe
3
+
遇
KSCN
会使溶液呈现红色,
Fe
2
+
遇
KSCN
不反应无现象,如果该溶液既含
Fe
3
+
,又含
Fe
2
+
,滴加
KSCN
溶液,溶液呈红色,则证明存在
Fe
3
+
但并不能证明无
Fe
2
+
,错误;
B
项,气体通过无水硫酸铜,粉末变蓝,则发生反应:
CuSO
4
+
5H
2
O===CuSO
4
·5H
2
O
,
CuSO
4
·5H
2
O
为蓝色,故可证明原气体中含有水蒸气,正确;
C
项,灼烧白色粉末,火焰呈黄色,证明原粉末中有
Na
+
,
Na
+
焰色反应为黄色,但并不能证明无
K
+
,因为黄光可遮住紫光,故
K
+
焰色反应需透过蓝色的钴玻璃滤去黄光后观察,错误;
D
项,能使澄清石灰水变浑浊的气体有
CO
2
、
SO
2
等,故将气体通入澄清石灰水,溶液变浑浊,则原气体不一定是
CO
2
,错误。
答案:
B
4.(2018
年华中师大附中模拟
)
为确定某溶液的离子组成,
进行如下实验:①测定溶液的
pH
,溶液显强碱性;②取少量溶
液加入稀盐酸至溶液呈酸性,产生无色无味且能使澄清石灰水
变浑浊的气体;③在②溶液中再滴加
Ba(NO
3
)
2
溶液,产生白色
沉淀;④取③中上层清液继续滴加
Ba(NO
3
)
2
溶液至无沉淀时,
再滴加
AgNO
3
溶液,产生白色沉淀。根据实验现象,以下
推测
正确的是
(
)
。
考点三
考向
1
常见物质的鉴别
物质的鉴别
[
典例
7
](2018
年山东济南模拟
)
常温下,欲鉴别物质的量浓
度均为
0.1 mol·L
-
1
的
KCl
、
(NH
4
)
2
SO
4
、
NH
3
·H
2
O
和
H
2
SO
4
四瓶
)
。
无色溶液,下列实验方案最佳的是
(
A.
用
pH
试纸鉴别
B.
分别闻气味和用
pH
试纸鉴别
C.
分别用
BaCl
2
和
NaOH
溶液鉴别
D.
用
Ba(OH)
2
溶液鉴别
解析:
用
pH
试纸测定各溶液的
pH
,
pH
小 于
7
的 是
(NH
4
)
2
SO
4
和
H
2
SO
4
,且
H
2
SO
4
溶液的
pH
比
(NH
4
)
2
SO
4
溶液的
小,
KCl
溶液的
pH
等于
7
,
NH
3
·H
2
O
溶液的
pH
大于
7
。
答案:
A
一般类型
鉴别方法
不用试剂
①
先依据外观特征,鉴别出其中的一种或几种,然
后再利用它或它们去鉴别其他几种物质
②
若均无明显外观特征,可考虑能否用加热或焰色
反应等方法鉴别出一种或几种物质
③
若以上两种方法都不能鉴别时,可考虑两两混合
或相互滴加,记录反应现象,分析确定
[
方法技巧
]
物质鉴别的
一般类型和方法
一般类型
鉴别方法
只用一种
试剂
①
先分析被鉴别物质的水溶性、密度、颜色等,初
步将被鉴别物质确定或分组
②
在鉴别多种酸、碱、盐的溶液时,可依据“相反
原理”确定试剂进行鉴别。即被鉴别的溶液多数呈
酸性时,可选用碱或水解呈碱性的盐溶液作试剂;
若被鉴别的溶液多数呈碱性时,可选用酸或水解呈
酸性的盐溶液作试剂
③
可考虑用已检出的物质为试剂做后续鉴别
任选或
限选试剂
此类题目不限制所加试剂的种类或在指定范围内选
择试剂,可有多种解法,题目考查的形式往往是从
众多的鉴别方案中选择最佳方案,其要求是操作步
骤简单,试剂选用最少,现象最明显
(续表)
[
典例
8
](2018
年福建泉州五校联考
)
在一无色溶液中检验出
有
Ba
2
+
、
Ag
+
,同时又测得其酸性很强。某学生还要鉴
定此溶
液中是否大量存在:
其实,这些离子中有一部分不必再鉴定就能加以否定,你
认为不必鉴定的离子组是
(
A.③⑤⑥⑦⑩
C.③④⑦⑧⑨
)
。
B.①②⑤⑥⑧⑨
D.①②③⑤⑥⑩
[
方法技巧
]
离子鉴别的四项基本原则
(3)
电中性原则
溶液呈电中性,一定既有阳离子,又有阴离子,且溶液中
正电荷总数与负电荷总数相等。
(
这一原则可帮助我们确定一些
隐含的离子
)
(4)
进出性原则
通常在实验过程中使用,是指在实验过程中反应生成的离
子或引入的离子对后续实验的干扰。
【
拓展演练
】
5.(2018
年天津卷
)
由
下列实验及现象推出的相应结论正确
的是
(
)
。
实验
现象
结论
某溶液中滴加
K
3
[Fe(CN)
6
]
溶液
产生蓝色沉淀
原溶液中有
Fe
2
+
,无
Fe
3
+
B.
向
C
6
H
5
ONa
溶液中通入
CO
2
溶液变浑浊
酸性:
H
2
CO
3
>
C
6
H
5
OH
C.
向含有
ZnS
和
Na
2
S
的悬浊液中滴加
CuSO
4
溶液
生成黑色沉淀
K
sp
(CuS)<
K
sp
(ZnS)
D.①
某溶液中加入
Ba(NO
3
)
2
溶液
②再加足量盐酸
①
产生白色沉淀
②仍有白色沉淀
Cu
2+
一定与溶液中的
S
2
-
反应得到黑色的
CuS
沉淀,不能证明
解析:
A
项,某溶液中滴加
K
3
[Fe(CN)
6
]
溶液,产生蓝色沉
淀,说明溶液中有
Fe
2
+
,但是无法证明是否有
Fe
3
+
,错误。
B
项,向
C
6
H
5
ONa
溶液中通入
CO
2
,溶液变浑浊,说明生成了苯
酚,根据强酸制弱
酸的原则,得到碳酸的酸性强于苯酚,正确。
C
项,向含有
ZnS
和
Na
2
S
的悬浊液中滴加
CuSO
4
溶液,虽然
ZnS
为不溶物,但是溶液中还有
Na
2
S
,加入硫酸铜溶液后,
发生了沉淀转化,错误。
D
项,向溶液中加入硝酸钡
溶液,得
到白色沉淀
(
有很多可能
)
,再加入盐酸时,溶液中就会同时存
在硝酸钡电离的硝酸根
和盐酸电离的氢离子,溶液具有硝酸的
强氧化性,如果上一步得到的是亚硫酸钡沉淀,此步就会被氧
化为硫酸钡沉淀,依然不溶,则无法证明原溶液中有硫酸根离
子,错误。
答案:
B
6.(2016
年新课标
Ⅱ
卷
)
某白色粉末由两种物质组成,为鉴
别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足
量稀盐酸,有气泡产生,固体全部溶解
②
取少量样品加入足
量稀硫酸有气泡产生,振荡后仍有固体存在
)
。
该白色粉末可能为
(
A.NaHCO
3
、
Al(OH)
3
C.Na
2
SO
3
、
BaCO
3
B.AgCl
、
NaHCO
3
D.Na
2
CO
3
、
CuSO
4
解析:
A
项,
NaHCO
3
、
Al(OH)
3
中加入足量稀硫酸有气泡
生,生成硫酸钠
、硫酸铝、二氧化碳和水,最终无固体存在,
错误;
B
项,
AgCl
不溶于水和酸,加入水后,碳酸氢钠溶解,
而
AgCl
不溶,再加入足量稀盐酸,
AgCl
仍然不溶,固体不能
全部溶解,错误;
C
项,亚硫酸钠和碳酸钡中加入水,碳酸钡
不溶于水使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应
生成氯化钡、二氧化碳和水,固体全部溶解,再将样品加入足
量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀、二氧化碳和
水,符合题意,正确;
D
项,
Na
2
CO
3
、
CuSO
4
中加热足量稀硫
酸,振荡后无固体存在,错误。
答案:
C
温度
/℃
0
10
20
30
40
50
60
70
80
90
100
溶解
度
/g
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
溶解度曲线在物质分离提纯中的应用
1.
溶解度的表示方法
(1)
列表法
硝酸钾在不同温度时的溶解度:
(2)
曲线法
2.
溶解度曲线的含义
(1)
不同物质在各温度时的溶解度不同。
(2)
曲线与曲线交点的含义:表示两物质在某温度时有相同
的溶解度。
(3)
能很快比较出两种物质在某温度时溶解度的大小。
(4)
能反映出溶解度随温度的变化趋势。
[
典例
]
(2018
年山东青岛模拟
)
高氯酸铵可用作火箭推进剂,
实验室可由
NaClO
3
等原料制取
(
部分物质溶解度如图
)
,其实验
流程如下:
(
已知氯酸钠受热分解生成高氯酸钠和氯化钠
)
(1)80 ℃
时浸取液冷却至
0 ℃
过滤,滤渣的主要成分为
____________(
写化学式
)
。
(2)
反应器中加入氯化铵饱和溶液发生反应的离子方程式
为
_______________________________________
。
解析:
(1)80 ℃
时浸取液主要含有
NaClO
4
和
NaCl
,
NaClO
4
溶解度受温度影响较大,而
NaCl
受温度影响很小,当冷却至
0 ℃
时,
NaClO
4
会因温度降低溶解度减小而析出,所以滤渣中
主要物质是
NaClO
4
。
(2)
反应器中含有
NaClO
4
,加入氯化铵饱
和溶液后,根据不同物质的溶解度相对大小关系,可知溶解度
[
演练
]
(2018
年河北衡水一中模拟
)
根据下列各组溶解度曲
线图,判断分离提纯方法。
(1)
根据下图①中
Na
2
SO
4
和
Na
2
SO
4
·10H
2
O
的溶解度曲线
(g/100 g H
2
O)
,由
Na
2
SO
4
溶液得到
Na
2
SO
4
固体的操作为将溶
液升温结晶、
____________
、用乙醇洗涤后干燥。用乙醇洗涤
而不用水洗的原因是
__________________________
。
图①
图②
(2)
根据图②所示相关物质的溶解度曲线。在实验室中提纯
过硫酸钾粗产品的实验具体操作依次为将过硫酸钾粗产品溶于
适量水中,
______________________
,干燥。
(3)
根据图①中红矾钠
(Na
2
Cr
2
O
7
·2H
2
O)
和
Na
2
SO
4
的溶解度
曲线。从
Na
2
Cr
2
O
7
和
Na
2
SO
4
的混合溶液中提取红矾钠的操作
为先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是
__________________________________________________
,然
后将滤液
__________
,从而析出红矾钠。
答案:
(1)
趁热过
滤
防止形成
Na
2
SO
4
·10H
2
O
(2)
在不超过
80 ℃
的条件下加热浓缩,冷却结晶,过滤,
用冷水洗涤
(3)
有利于
Na
2
SO
4
结晶析出,又能防止
Na
2
Cr
2
O
7
·2H
2
O
结晶
析出
冷却结晶
相关文档
- 陕西省白水中学2018-2019学年高二2021-07-0310页
- 化学卷·2018届四川省攀枝花十二中2021-07-0344页
- 2018-2019学年江苏省宿迁市高一上2021-07-037页
- 广东省揭阳市揭西县2019-2020学年2021-07-037页
- 陕西省渭南市韩城市司马迁中学20202021-07-0315页
- 四川省宜宾市南溪二中2019-2020学2021-07-034页
- 辽宁省大连海湾高级中学2019-20202021-07-0310页
- 2018-2019学年江苏苏州高级中学高2021-07-035页
- 【化学】吉林省长春市第二实验中学2021-07-038页
- 化学卷·2018届广西壮族自治区田阳2021-07-039页