- 718.57 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019学年度第二学期第二次月考
高一化学试卷
可能用到的相对原子质量:H 1 O 16 N 14 Na 23 Al 27 Cl 35.5 Fe 56 Zn 65
一.单项选择题(本题包括15小题,每题2分,共30分。每小题只有一个选项符合题意)
1.下列解释不科学的是
A.“水滴石穿”主要原因是溶有CO2的雨水与CaCO3作用生成了可溶性的Ca(HCO3)2的缘故
B.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气体减少形成“负压”的缘故
C.严格地讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体并没有得到转化或吸收
D.“雨后彩虹”、“海市蜃楼”既是一种光学现象,也与胶体的知识有关
2.下列化学用语表示正确的是
A.中子数为8的氮原子: B.硫离子的结构示意图:
C.铵根离子的电子式: D.聚丙烯的结构简式
3.设NA为阿伏加德罗常数的数值。下列说法正确的是
A.1mol甲苯含有9NA个C-H键
B.15g甲基(-CH3)所含有的电子数是9 NA个
C.1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为10NA
D.标准状况下,2.24 L CHCl3的原子总数为0.5 NA
4.水溶液中能大量共存的一组离子是
A.H+、NO3-、I-、Cl- B.Cu2+、Br-、H+、SO42-
C.Al3+、Mg2+、CO32-、NO3- D.NH4+、Cl-、OH-、HCO3-
5.对中国古代著作涉及化学的叙述,下列解读错误的是
A.《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2
B.《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐
C.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
D.《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油
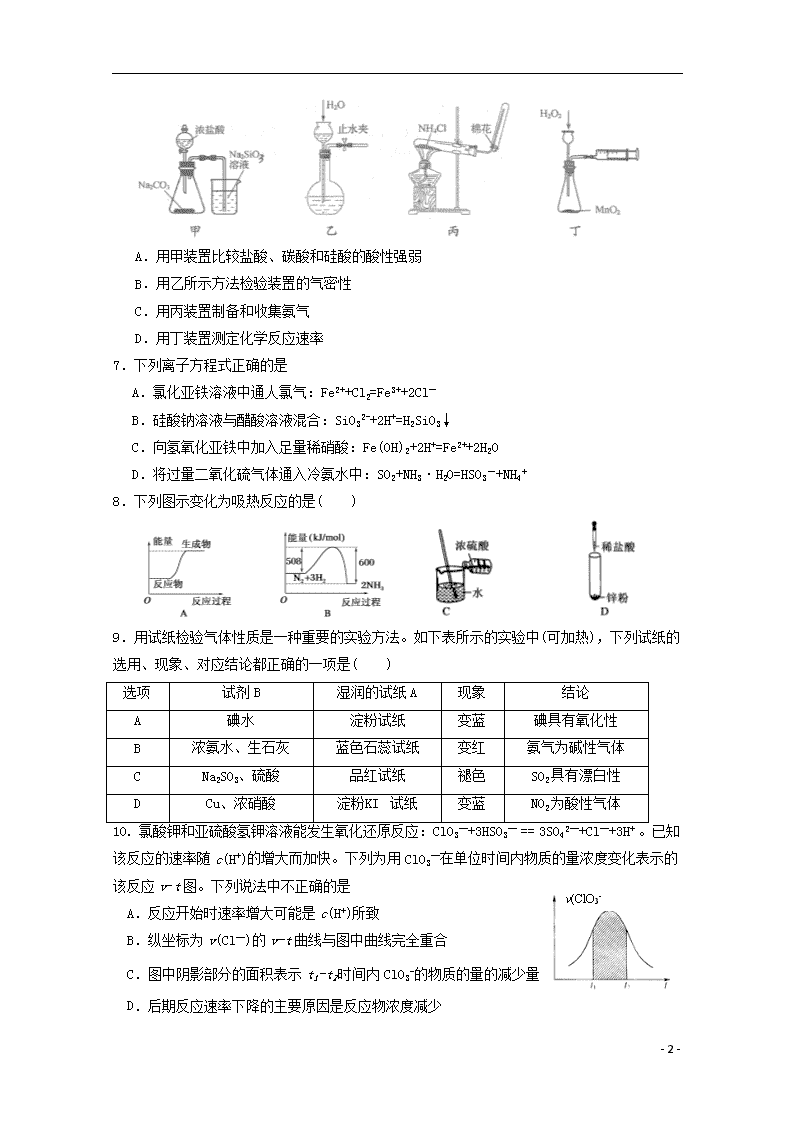
6. 用下列实验装置和方法进行的相应实验,能达到实验目的的是
- 10 -
A.用甲装置比较盐酸、碳酸和硅酸的酸性强弱
B.用乙所示方法检验装置的气密性
C.用丙装置制备和收集氨气
D.用丁装置测定化学反应速率
7.下列离子方程式正确的是
A.氯化亚铁溶液中通人氯气:Fe2++Cl2=Fe3++2Cl-
B.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
C.向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
D.将过量二氧化硫气体通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
8.下列图示变化为吸热反应的是( )
9.用试纸检验气体性质是一种重要的实验方法。如下表所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )
选项
试剂B
湿润的试纸A
现象
结论
A
碘水
淀粉试纸
变蓝
碘具有氧化性
B
浓氨水、生石灰
蓝色石蕊试纸
变红
氨气为碱性气体
C
Na2SO3、硫酸
品红试纸
褪色
SO2具有漂白性
D
Cu、浓硝酸
淀粉KI试纸
变蓝
NO2为酸性气体
10. 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3—+3HSO3— == 3SO42—+Cl—+3H+ 。已知该反应的速率随c(H+)的增大而加快。下列为用ClO3—在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是
v(ClO3-)
A.反应开始时速率增大可能是c(H+)所致
B.纵坐标为v(Cl—)的v-t曲线与图中曲线完全重合
C.图中阴影部分的面积表示t1-t2时间内ClO3-的物质的量的减少量
D.后期反应速率下降的主要原因是反应物浓度减少
- 10 -
11.下列说法中正确的是
A.原电池放电过程中,负极质量一定减轻,或正极的质量一定增加
B.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
C.为加快一定量的Zn与足量稀硫酸反应的速率,且不影响生成H2总量,可加入少量CuSO4溶液
D.某海水电池总反应表示为:5MnO2+2Ag+2NaCl=== Na2Mn5O10+2AgCl,则负极反应式:Ag-e-+Cl-===AgCl
12. 下列条件一定能使反应速率加快的是
①增加反应物的物质的量②升高温度③缩小反应容器的体积④加入生成物⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
13. 将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
选项
X
Y
A
SO2
H2S
B
Cl2
CO2
C
NH3
CO2
D
SO2
NO2
14.在给定条件下,下列加点物质在化学反应中能被完全消耗的是( )
A.用浓盐酸与二氧化锰共热制氯气
B.标准状况下,将1 g铝片投入20 mL 18 mol·L-1硫酸中
C.向100 mL 4 mol·L-1硝酸中加入5.6 g铁
D.在5×107 Pa、500 ℃和铁触媒催化的条件下,用氮气和氢气合成氨
15. 化合物(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是
A.b的同分异构体只有d和p两种
B.b、d、p的二氯代物均只有三种
C.b、d、p均可与酸性高锰酸钾溶液反应
D.b、d、p中只有b的所有原子处于同一平面
二.不定项选择题(本题包括5小题,每题4分,共20分。每小题只有一个或两个选项符合题意)
16. 分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
A. 分枝酸的分子式为C10H10O6
B.可与乙醇、乙酸反应,且反应类型相同
- 10 -
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
17. 一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.CH4+H2O = 3H2+CO,1 mol CH4参加反应转移12 mol电子
B.电极A为正极
C.电池工作时,CO32-错误!未找到引用源。向电极A移动
D.O2在B电极上被氧化
18.向硝酸钠溶液中加入铜粉不发生反应,若加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是
A.Na2 SO4 B.NaHCO3 C.NaHSO4 D. FeCl3
19.某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-的几种离子。取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离):一份固体溶于水得无色透明溶液,加入足量Ba2+,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。下列说法正确的是( )
A.该固体中一定有NH4+、CO32-、SO42-、Na+
B.该固体中一定没有Cu2+、Na+、Cl-
C.该固体中只含有NH4+、Cl-、CO32-、SO42-
D.根据以上实验,无法确定该固体中有Na+
20.硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:
NO2+NO+2NaOH=2 NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:
4NH3 + 6NO = 5N2 + 6H2O
将一定量NO和NO2的混合气体通入300 mL 5mol/LNaOH溶液中,恰好被完全吸收。下列说法正确的
A.原混合气体中NO在标准状况下的体积可能为16.8 L
B.所得溶液中NaNO3和NaNO2的物质的量之比不可能为1︰2
C.若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L
D.在用氨气处理氮氧化物时,氮氧化物发生还原反应
- 10 -
三、非选择题(70分)
21.(23分)完成下列各小题
Ⅰ.(7分)按要求书写:
(1)相对分子质量为72且沸点最低的烷烃的结构简式 ▲ ;
(2)分子式为C4H10O的饱和一元醇有多种,不能发生催化氧化的醇分子结构简式 ▲ ,
(3)欲区分和,应选用 ▲ ;欲除去混在乙醇中的水,应选用 ▲ (填试剂),然后 ▲ (填方法)。
(4)科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质。
①如果将CO2和H2以1︰4的比例混合,通人反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:CO2 +4H2→ ▲ +2H2O
②若将CO2和H2以1︰3的比例混合,使之发生反应生成某种重要的化工原料和水,则生成的该重要化工原料可能是 ▲ (填字母)。
A.烷烃 B.烯烃 C.芳香烃
Ⅱ.(8分)按要求书写下列化学方程式
(1)写出制取硝基苯的化学反应方程式 ▲ ;
(2)写出氢氧燃料电池在KOH介质中负极电极反应式 ▲ ;
(3)氯气是重要的化工原料,可以用来制备很多化工产品,比如可以制备净水剂高铁酸钾(K2FeO4),写出碱性条件下,由氯化铁制备高铁酸钾的离子方程式 ▲ ;
(4)1,3-丁二烯与等物质的量的溴在60℃时发生1,4-加成的反应: ▲
Ⅲ.(8分) 有一种有机物X的键线式如右图所示。
(1)X的分子式为 ▲ 。
(2)有机物Y是X的同分异构体,且属于芳香族化合物,则Y的结构简式是 ▲ 。
(3)Y在一定条件下可生成高分子化合物,该反应的化学方程式是 ▲ 。
(4)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有_▲___种。
22. (8分)在2 L密闭容器中,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
- 10 -
(1)上述反应___▲_____(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是___▲___。用O2表示从0~2s内该反应的平均速率v=___▲_____。
(3)能说明该反应已达到平衡状态的是___▲_____(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变
23.(8分)有关物质的转化关系如下图所示(部分物质与条件已略去)。已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65g•mol-1,C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱。
(1)B的化学式为 ▲ 。
(2)K的电子式为 ▲ 。
(3)写出反应①的化学方程式: ▲ 。
(4)写出反应②的离子方程式: ▲ 。
24.(8分) 以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
生成Ca(ClO)2的化学方程式为 ▲ 。
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O ,氯化完成后过滤。
①滤渣的主要成分为 ▲ (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] ▲ 1∶5
- 10 -
(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中尽可能多地析出KClO3固体的方法是 ▲ 。
25.(11分)实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
已知:亚硝酸钠易潮解,易溶于水和液氨,其水溶液呈碱性,微溶于乙醇、甲醇、乙醚等有机溶剂,有毒。亚硝酸钠有咸味,又被用来制造假食盐
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用 ▲ (选填装置编号)。请写出生石灰在此反应中的两个作用
▲ 、 ▲ 。
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_ ▲ (选填装置编号)中加入 ▲ 以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为 ▲ 。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
▲ (写两点)
- 10 -
26.(12分)高氯酸钠可以用于制备火箭推进剂高氯酸铵。以粗盐为原料制备高氯酸钠晶体(NaClO4•H2O)的流程如下:
(1)“精制”中,由粗盐(含Ca2+、Mg2+、SO42-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。加入Na2CO3溶液的作用是 ▲ 。
(2)“电解”分2步进行,其反应分别为
NaCl+3H2O NaClO3+3H2↑
NaClO3+H2O NaClO4+H2↑
(3)“除杂”的目的是除去少量未被电解的NaClO3,该反应的化学方程
式为 ▲ 。
(4)“分离”的操作分别是加热浓缩、 ▲ 、冷却结晶、过滤、洗涤、干燥。
(各物质的溶解度如右图所示)
(5)室温下将得到的高氯酸钠晶体加入氯化铵饱和溶液中,反应的离子方程式为:
▲
(6)为确定所得高氯酸钠晶体(NaClO4•H2O)的纯度(含有少量Na2SO4杂质),进行如下实验:
①准确称取3.00 g样品加水充分溶解,所得溶液转移至容量瓶并配置成100 mL溶液。
②量取25.00 mL溶液,加入足量的KI溶液充分反应(ClO4-被还原成Cl-),再滴加1.000 mol·L-1 Na2S2O3溶液进行反应(反应为I2+2 Na2S2O3=2 NaI+Na2S4O6),恰好消耗40.00 mL Na2S2O3溶液。
根据以上数据计算样品中高氯酸钠晶体(NaClO4•H2O)纯度。(写出计算过程,保留四位有效数字)
- 10 -
江苏省启东中学2017-2018学年度第二学期月考
高一化学参考答案
单项选择题:(共30分,每小题2分)
1.B 2.C 3.B 4.B 5.A 6.B 7.D 8.A 9.C 1 0.A.
11. D 12.C 13. B 14. C 15. D
不定项选择(共20分,每小题4分)
16.AB 17.C 18.CD 19.A 20. AD
21(共23分)
Ⅰ(共7分,每空1分)
(1) (2)(CH3)3COH (3) 酸性KMnO4溶液或溴水;生石灰、蒸馏
(4)①C H4 ② B.
Ⅱ. (8分,每空2分)
(1)
(2)Al—3e-+4OH-=AlO2-+2H2O
(3)2Fe3++3Cl2+16OH-=2FeO42-+6Cl-+8H2O(2分)
Ⅲ(8分,每空2分)
C8H8 (2) (3) (4) 2
22 (8分,每空2分) (1)是 (2)b 1.5×10-3mol·(L·s)-1 (3)bc
23. (8分,每空2分)(1)NaN 3(2)略
(3)CuO+2 NaN 3 撞击Cu+ Na 2O+3 N 2
(4)3Cu+8H++2NO===3Cu2++2NO↑+4H2O
24(8分,每空2分)
(1)①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;
(2)①CaCO3、Ca(OH)2 ②<;
- 10 -
(3)蒸发浓缩、冷却结晶
25(11分)(1)D CaO与水反应,减少了溶剂;CaO遇水放热,降低了NH3的溶解度(或促使氨水分解)(每空1分)
(2)E 碱石灰或CaO或固体氢氧化钠(每空2分)
(3)NaNO2 +NH4Cl== NaCl+ N 2 ↑+2H2O(2分)
(4)Cu和CuO可以循环使用,节省试剂;避免使用有毒的NaNO2,污染小(2分)
26. (12分)(1)除去Ca2+和过量的Ba2+ (2分) (3)2NaClO3+SO2=2ClO2+Na2SO4 (2分)
(4)趁热过滤(2分) (5)ClO4-+ NH4+ =NH4ClO4↓ (2分)
(6)25ml溶液中,
NaClO4·H2O ~ 4I2 ~ 8Na2S2O3 ( 1分)
1 8
n (NaClO4)=5×10-3mol 4×10-2 mol
3.0g样品中含n (NaClO4·H2O)=5×10-3mol×4=2×10-2mol ( 1分)
3.0g样品中m (NaClO4·H2O)= 2×10-2mol×140.5g·mol -=2.81g ( 1分)
3. 0g样品中w (NaClO4·H2O)=93.67% ( 1分)
- 10 -