- 830.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
仿真冲刺练(三)
(时间:100分钟,满分:120分)
可能用到的相对原子质量:H—1 C—12 N—14
O—16 Cl—35.5
一、单项选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.2019年政府工作报告提出:继续坚定不移地打好包括污染防治在内的“三大攻坚战”。下列做法不符合这一要求的是( )
A.推广新能源汽车,减少氮氧化物排放
B.研发可降解塑料,控制白色污染产生
C.直接灌溉工业废水,充分利用水资源
D.施用有机肥料,改善土壤微生物环境
2.下列化学用语表示正确的是( )
A.H2S的电子式:H+[]2-H+
B.间硝基甲苯的结构简式:
C.质子数为35、中子数为45的溴原子:Br
D.NaHS溶液显碱性的原因:HS-+H2OS2-+H3O+
3.下列有关物质性质与用途具有对应关系的是( )
A.SiO2熔点很高,可用于制造坩埚
B.NaOH能与盐酸反应,可用作胃酸中和剂
C.Al(OH)3是两性氢氧化物,氢氧化铝胶体可用于净水
D.HCHO可以使蛋白质变性,可用于人体皮肤伤口消毒
4.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明溶液中:Ca2+、Cu2+、Br-、Cl-
B.能使酚酞变红的溶液中:K+、Na+、CO、AlO
C.c(ClO-)=1 mol·L-1的溶液中:Fe2+、Al3+、NO、I-
D.=0.1 mol·L-1的溶液中:NH、Mg2+、SO、CH3COO-
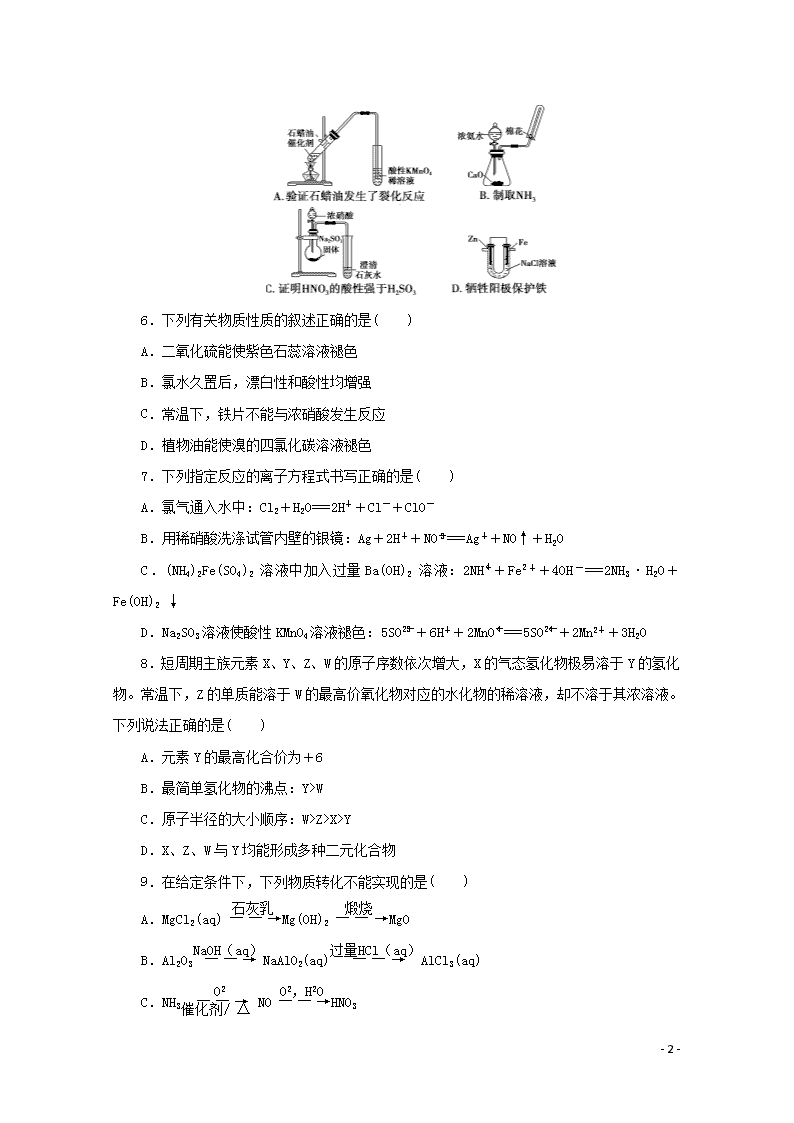
5.用下列装置进行相应实验,不能达到实验目的的是( )
- 18 -
6.下列有关物质性质的叙述正确的是( )
A.二氧化硫能使紫色石蕊溶液褪色
B.氯水久置后,漂白性和酸性均增强
C.常温下,铁片不能与浓硝酸发生反应
D.植物油能使溴的四氯化碳溶液褪色
7.下列指定反应的离子方程式书写正确的是( )
A.氯气通入水中:Cl2+H2O===2H++Cl-+ClO-
B.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO===Ag++NO↑+H2O
C.(NH4)2Fe(SO4)2 溶液中加入过量Ba(OH)2 溶液:2NH+Fe2++4OH-===2NH3·H2O+Fe(OH)2 ↓
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO+6H++2MnO===5SO+2Mn2++3H2O
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物。常温下,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是( )
A.元素Y的最高化合价为+6
B.最简单氢化物的沸点:Y>W
C.原子半径的大小顺序:W>Z>X>Y
D.X、Z、W与Y均能形成多种二元化合物
9.在给定条件下,下列物质转化不能实现的是( )
A.MgCl2(aq)Mg(OH)2MgO
B.Al2O3NaAlO2(aq)AlCl3(aq)
C.NH3NOHNO3
- 18 -
D.SiO2H2SiO3Na2SiO3
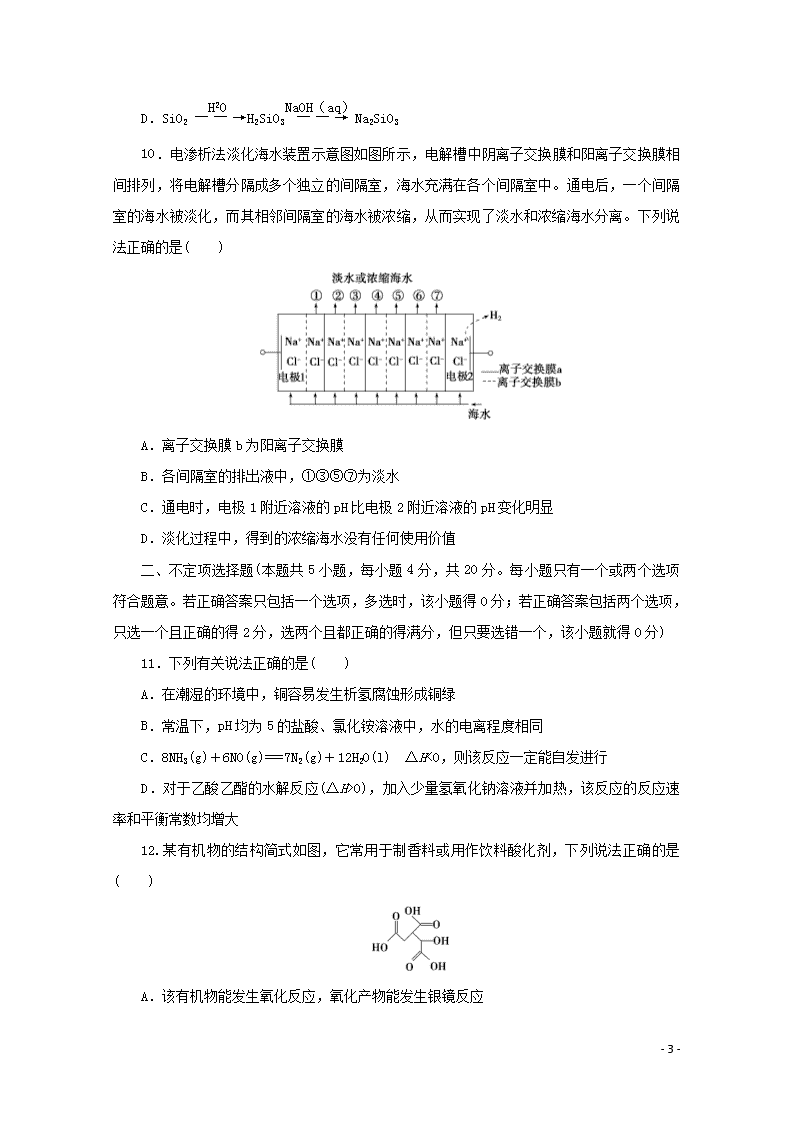
10.电渗析法淡化海水装置示意图如图所示,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )
A.离子交换膜b为阳离子交换膜
B.各间隔室的排出液中,①③⑤⑦为淡水
C.通电时,电极1附近溶液的pH比电极2附近溶液的pH变化明显
D.淡化过程中,得到的浓缩海水没有任何使用价值
二、不定项选择题(本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分)
11.下列有关说法正确的是( )
A.在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿
B.常温下,pH均为5的盐酸、氯化铵溶液中,水的电离程度相同
C.8NH3(g)+6NO(g)===7N2(g)+12H2O(l) ΔH<0,则该反应一定能自发进行
D.对于乙酸乙酯的水解反应(ΔH>0),加入少量氢氧化钠溶液并加热,该反应的反应速率和平衡常数均增大
12.某有机物的结构简式如图,它常用于制香料或用作饮料酸化剂,下列说法正确的是( )
A.该有机物能发生氧化反应,氧化产物能发生银镜反应
- 18 -
B.该有机物分子内所有碳原子可能在同一平面内
C.该有机物能溶于水,相同分子间在一定条件下能相互反应生成高聚酯
D.1 mol该有机物与足量的Na反应可生成 44.8 L H2
13.下表中的实验内容不能达到实验目的或不能得出相应实验结论的有( )
选项
实验内容
实验目的或实验结论
A
向足量的酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH)
将乙二醇转化为乙二酸(H2C2O4)
B
向KI溶液中滴入CuSO4溶液,有白色沉淀生成,但无气体产生,再加入四氯化碳振荡,四氯化碳层呈紫色
说明白色沉淀可能为CuI
C
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸
研究浓度对反应速率的影响
D
向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层
区别植物油和矿物油
14.25 ℃时,下列有关说法正确的是( )
A.AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1>K2
B.0.1 mol·L-1的NaHA溶液的pH=4.3:c(HA-)>c(H+)>c(A2-)>c(H2A)
C.pH=2的HA溶液与pH=12的NaOH溶液任意比混合:c(OH-)+c(A-)=c(Na+)+c(H+)
D.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO)+c(HCO)]
15.恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正 x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆·x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是( )
- 18 -
A.该反应为放热反应,v正(a)S>N>O,C项错误;O与Al只能形成Al2O3,D项错误。
9.解析:选D。D项,SiO2不能与H2O反应,错误。
10.解析:选B。根据电极2上生成氢气可知,电极2上水电离出的H+放电,为阴极,则电极1上Cl-放电,为阳极,最左室中Cl-浓度降低,根据溶液呈电中性知,①中Cl-向最左室移动,故离子交换膜b为阴离子交换膜,A项错误;①中Cl-向最左室移动,Na+向②中移动,则①的排出液为淡水,同理可推出,③⑤⑦的排出液也为淡水,B项正确;通电时,电极1上Cl-放电,溶液pH变化不大,而电极2上水电离出的H+放电,溶液pH增大,C项错误;淡化过程中,得到的浓缩海水可以用于提炼其他化学物质,如食盐、金属镁、溴等,有较大的使用价值,D项错误。
11.解析:选D。A项,根据金属活动顺序,Cu不能置换出氢气,在潮湿的环境中,铜容易发生的是吸氧腐蚀而不是析氢腐蚀,错误;B项,常温下,pH为5的盐酸中HCl电离出的H+抑制水的电离,水电离出的氢离子浓度为10-9mol/L,而pH为5的氯化铵溶液中NH发生水解,促进水的电离,水电离出的氢离子浓度为10-5 mol/L,故二者中水的电离程度不同,错误;C项,因为该反应ΔH<0,且随着反应的进行气体分子数减少,即ΔS<0,根据反应自发进行条件ΔG=ΔH-TΔS<0可知,该反应在低温下才能自发进行,错误;D项,
- 18 -
乙酸乙酯的水解反应为CH3COOC2H5+H2OCH3COOH+C2H5OH,加入NaOH溶液后,NaOH与CH3COOH反应,促进平衡正向移动,由于该反应是吸热反应(ΔH>0),升高温度,平衡常数增大,同时反应速率加快,正确。
12.解析:选C。该有机物中的羟基能被氧化为羰基,含有羰基的物质不能发生银镜反应,A项错误;结合CH4为正四面体结构可知,该有机物中所有碳原子不可能共平面,B项错误;该有机物含有羟基和羧基,能溶于水,相同分子间能发生缩聚反应生成高聚酯,C项正确;羧基和羟基均能与金属Na反应,1 mol该物质能与4 mol Na反应生成2 mol H2,但没有给出气体所处的条件,故无法确定其体积,D项错误。
13.解析:选A。A项,KMnO4与乙二醇(HOCH2CH2OH)能发生氧化还原反应生成二氧化碳,且高锰酸钾可氧化乙二酸(H2C2O4),结论不合理,故错误;B项,向KI溶液中滴入CuSO4溶液发生氧化还原反应生成CuI、碘,则有白色沉淀生成,但无气体产生,再加入四氯化碳振荡,四氯化碳层呈紫色,故正确;C项,只有浓度一个变量,可研究浓度对反应速率的影响,故正确;D项,植物油属于酯类,热的烧碱溶液能使其水解,而矿物油属于烃类,和烧碱不反应,可以用热的烧碱溶液来鉴别,故正确。
14.解析:选BC。溶度积只与温度有关,所以K1=K2,故A错误;0.1 mol·L -1的NaHA溶液的pH=4.3,说明HA-的电离程度大于HA-的水解程度,所以溶液中存在c(HA-)>c(H+)>c(A2-)>c(H2A),故B正确;pH=2的HA溶液与pH=12的NaOH溶液任意比混合后溶液中存在的离子有Na+、H+、OH-、A-,根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),故C正确;浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液,因体积不能确定,所以不能确定离子浓度之间的关系,故D错误。
15.解析:选BC。A项,由题图可知,T2 K先达到平衡,说明T2>T1,在高温下,SiHCl3对应的物质的量分数小,说明升高温度平衡正向移动,即该反应为吸热反应,且v正(a)>v逆(b),错误;B项,移走生成物,可以促进平衡正向移动,提高SiHCl3的转化率,正确;C项,在T2 K下达到平衡时,有x(SiHCl3)=0.75,x(SiH2Cl2)=x(SiCl4)=0.125,v正=v逆,即k正x2(SiHCl3)=k逆x(SiH2Cl2)x(SiCl4),===,k正和k逆仅与温度有关,点a处,=×=×=,正确;D项,再充入1 mol SiHCl3,反应物浓度增大,反应正向进行,对于平衡的结果,可以看成是在原平衡的基础上加压,由于加压时平衡不移动,所以x(SiH2Cl2)不变,错误。
16.解析:(1)硼砂的化学式为Na2B4O7·10H2O,钠元素的化合价为+1,
- 18 -
氧元素的化合价为-2,根据化合物中各元素化合价代数和为0可知,硼元素的化合价为+3;用H2SO4调pH为2~3,Na2B4O7在酸溶液中生成H3BO3,反应的离子方程式为B4O+2H++5H2O4H3BO3;加热H3BO3得到B2O3,Mg与B2O3发生置换反应得到粗硼:3Mg+B2O32B+3MgO。(2)加热MgCl2·6H2O时,氯化镁水解生成氢氧化镁和HCl,在HCl氛围中加热可以抑制MgCl2的水解。(3)若起始电解质溶液pH=1,则pH=2时,溶液中氢离子浓度减小0.1 mol·L-1-0.01 mol·L-1=0.09 mol·L-1,由反应Mg+H2O2+2H+===Mg2++2H2O可知,Mg2+的物质的量浓度为0.045 mol·L-1;Ksp[Mg(OH)2]=5.6×10-12,常温下当溶液pH=6时,c(OH-)=10-8 mol·L-1,H+浓度减小0.1 mol·L-1-10-6 mol·L-1≈0.1 mol·L-1,溶液中Mg2+的浓度约为0.05 mol·L-1,则Qc=c(Mg2+)×c2(OH-)≈0.05×10-16=5×10-18C>Ni,所以元素电负性由大到小的顺序为O>C>Ni。CO的结构式为C≡O,三键中有1个σ键和2个π键,故CO分子中π键与σ键的个数比为2∶1。
答案:(1)2 23 3d54s1
(2)O sp3 sp2
(3)分子 O>C>Ni 2∶1
B.解析:(1)草酸和乙醇在浓硫酸做催化剂,68~70 ℃的条件下发生酯化反应,反应的化学方程式为HOOCCOOH+2C2H5OH+2H2O。冷凝水应从下口流进、上口流出。(2)用蒸馏的方法分离出乙醇和苯。(3)用饱和碳酸氢钠溶液可除去未反应完的草酸和做催化剂的硫酸等酸性物质。(4)步骤4收集182~184 ℃的馏分,操作为蒸馏,还需用到的玻璃仪器有温度计和酒精灯。(5)反应中乙醇过量,由可知45 g HOOCCOOH理论上生成73 g,产率为×100%≈78%。
答案:(1) +2CH3CH2OH+2H2O a
(2)蒸馏
(3)除去草酸、硫酸等酸性物质
(4)温度计、酒精灯
(5)78%
- 18 -
- 18 -