- 384.07 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微考点52 电化学原理在金属腐蚀、防护及环保中的应用
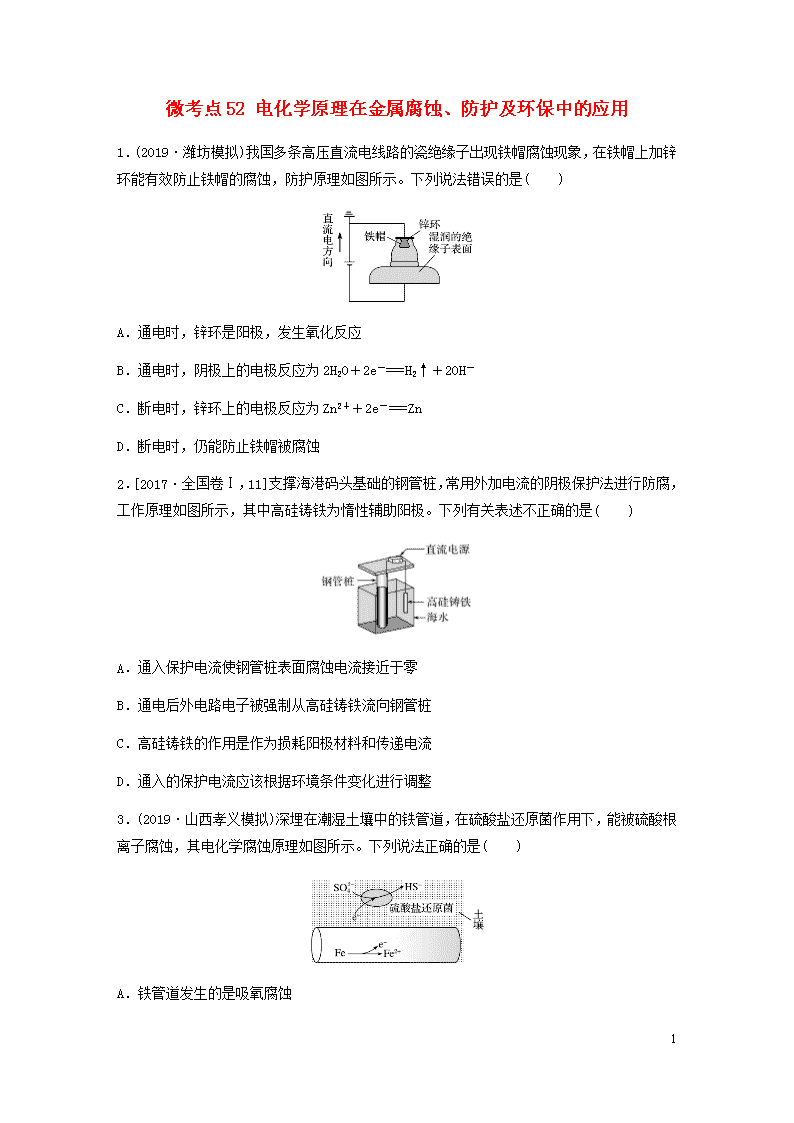
1.(2019·潍坊模拟)我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应为Zn2++2e-===Zn
D.断电时,仍能防止铁帽被腐蚀
2.[2017·全国卷Ⅰ,11]支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
3.(2019·山西孝义模拟)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理如图所示。下列说法正确的是( )
A.铁管道发生的是吸氧腐蚀
8
B.输送暖气的管道也易发生此类腐蚀
C.这种情况下,土壤的pH增大
D.管道上刷富铜油漆可以延缓管道的腐蚀
4.工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是( )
已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A.碳棒上发生的电极反应:4OH--4e-===O2↑+2H2O
B.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小
C.为了提高Ni的产率,电解过程中需要控制废水的pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
5.(2019·昆明质检)铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是 ( )
A.H+由右室进入左室
B.Ce4+从电解槽的c口流出,且可循环使用
C.阴极的电极反应式:2HNO2+6H++6e-===N2↑+4H2O
D.若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
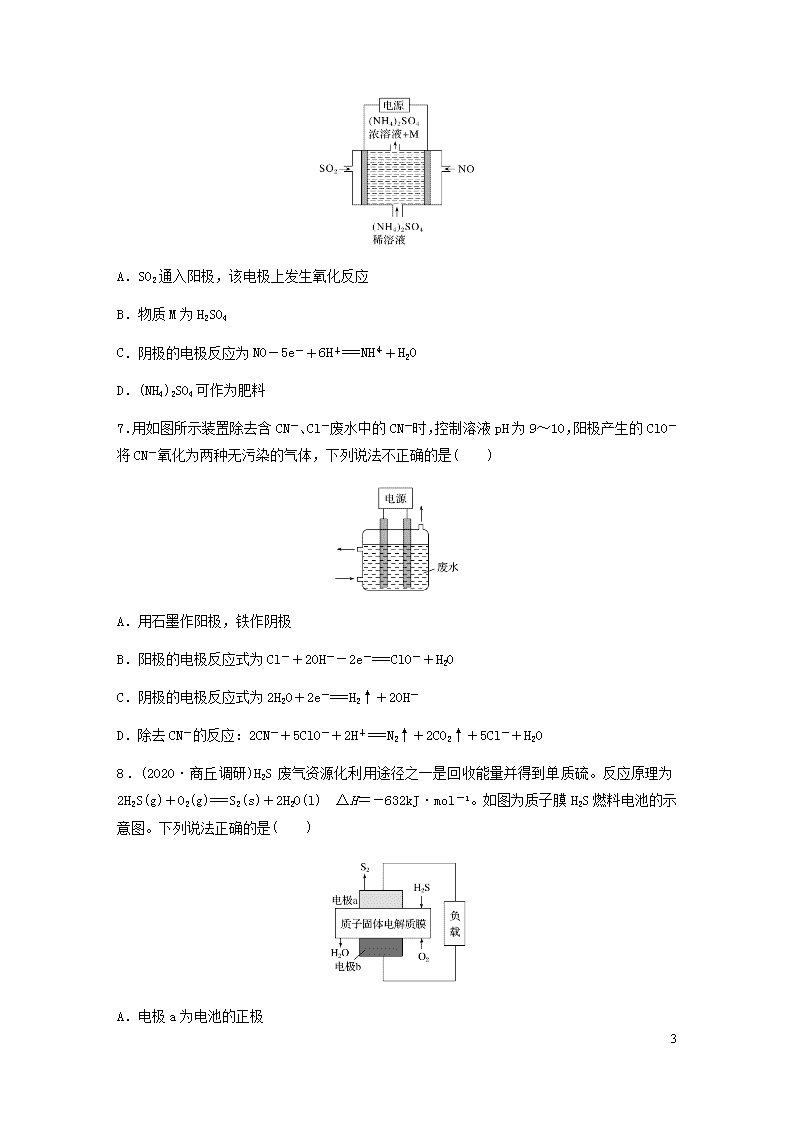
6.(2019·贵阳模拟)如图电解装置可将雾霾中的NO、SO2分别转化为NH和SO。下列关于该装置的说法错误的是( )
8
A.SO2通入阳极,该电极上发生氧化反应
B.物质M为H2SO4
C.阴极的电极反应为NO-5e-+6H+===NH+H2O
D.(NH4)2SO4可作为肥料
7.用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为Cl-+2OH--2e-===ClO-+H2O
C.阴极的电极反应式为2H2O+2e-===H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O
8.(2020·商丘调研)H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为2H2S(g)+O2(g)===S2(s)+2H2O(l) ΔH=-632kJ·mol-1。如图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
A.电极a为电池的正极
8
B.电极b上发生的电极反应为O2+2H2O+4e-===4OH-
C.电路中每流过4mol电子,电池内部释放632kJ热能
D.每17gH2S参与反应,有1molH+经质子膜进入正极区
9.(2020·宣城月考)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意如图,下列说法不正确的是( )
A.a为电源正极
B.阳极区溶液中发生的氧化还原反应为Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O
C.若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.1molCr2O被还原
D.阴极区附近溶液pH降低
10.按照要求回答下列问题。
(1)工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,
依次发生的反应有:
ⅰ.CN--2e-+2OH-===CNO-+H2O
ⅱ.2Cl--2e-===Cl2↑
ⅲ.3Cl2+2CNO-+8OH-===N2+6Cl-+2CO+4H2O
①a为电源________(填“正”或“负”)极。
8
②通电过程中溶液pH不断________(填“增大”“减小”或“不变”)。
③除去1molCN-,外电路中至少需要转移________mol电子。
④为了使电解池连续工作,需要不断补充__________________________________________。
(2)利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2来解决环境污染问题。
①阴极的电极反应式为:_______________________________________________________
_____________________________________________________________________________。
②阳极的电极反应式为:_______________________________________________________
_____________________________________________________________________________。
③电解时,H+通过阳离子交换膜的方向是________________________________________
____________________________________________________________________________。
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
①图中a极要连接电源的__________(填“正”或“负”)极,C口流出的物质是________________。
②SO放电的电极反应式为_______________________________________________________
_______________________________________________________________________________。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因:_______________________
8
_______________________________________________________________________________。
(4)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术,如图为MFC碳氮联合同时去除的氮转化系统原理示意图。
①A极的电极反应式为___________________________________________________________,
A、B两极生成CO2和N2的物质的量之比为________。
②用化学用语简述NH去除的原理:________________________________________________
______________________________________________________________________________。
8
答案精析
1.C
2.C [钢管桩接电源的负极,高硅铸铁接电源的正极,通电后,外电路中的电子从高硅铸铁(阳极)流向正极,从负极流向钢管桩(阴极),A、B正确;C项,题给信息高硅铸铁为“惰性辅助阳极”不损耗,错误。]
3.C
4.B [电极反应式为
阳极:4OH--4e-===2H2O+O2↑
阴极:Ni2++2e-===Ni、2H++2e-===H2↑
A项正确;B项,由于C室中Ni2+、H+不断减少,Cl-通过阴离子膜从C室移向B室,A室中OH-不断减少,Na+通过阳离子膜从A室移向B室,所以B室中NaCl溶液的物质的量浓度不断增大,错误;C项,由于H+的氧化性大于Ni2+(低浓度)的氧化性,所以为了提高Ni的产率,电解过程中需要控制废水的pH,正确;D项,若去掉阳离子膜,在阳极Cl-首先放电生成Cl2,反应总方程式发生改变,正确。]
5.C [A项,根据电解原理,H+由左室向右室移动,错误;B项,空气污染物NO通常用含Ce4+溶液吸收,生成HNO2、NO,N的化合价升高,Ce4+的化合价降低,然后对此溶液进行电解,又产生Ce4+,根据电解原理,应在阳极上产生Ce4+,即Ce4+从a口流出,可循环使用,错误;C项,根据电解原理,阴极上得电子,化合价降低,HNO2转化为无毒物质,即转化为N2,阴极电极反应式为2HNO2+6H++6e-===N2↑+4H2O,正确;D项33.6L甲烷参与反应转移电子物质的量为mol=12mol,理论上可转化HNO2的物质的量为12×mol=4mol,错误。]
6.C
7.D [若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极,阳极须为惰性电极,可用石墨作阳极,故A项正确;阳极Cl-失去电子生成ClO-,发生氧化反应,又已知溶液呈碱性,故B项正确;在碱性条件下,水电离出的H+在阴极得电子生成H2,发生还原反应,故C项正确;溶液pH为9~10,呈碱性,反应物中不可能含有大量的H+,故D项错误。]
8.D
8
9.D [根据图示,a作阳极,b作阴极,电极反应式为阳极:Fe-2e-===Fe2+,阴极:2H++2e-===H2↑,然后发生Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,由于在阴极区c(H+)减小,故pH增大。根据6H2~6Fe2+~Cr2O得,当有13.44L(标准状况)H2放出时,应有0.1molCr2O被还原。]
10.(1)①正 ②减小 ③5 ④NaOH和NaCl
(2)①2HSO+2H++2e-===S2O+2H2O
②SO2+2H2O-2e-===SO+4H+ ③由阳极室到阴极室
(3)①负 硫酸
②SO-2e-+H2O===SO+2H+
③H2OH++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
(4)①CH3COO--8e-+2H2O===2CO2↑+7H+ 5∶2
②NH在好氧微生物反应器中转化为NO:NH+2O2===NO+2H++H2O,NO在MFC电池正极转化为N2:2NO+12H++10e-===N2↑+6H2O
8
相关文档
- 湖北省荆州市2019-2020高一化学上2021-07-0520页
- 2017-2018学年湖南省隆回县一中高2021-07-0520页
- 黑龙江省大庆十中2020届高三上学期2021-07-0515页
- 高考化学第一轮复习课件第2讲 富2021-07-057页
- 陕西省吴起高级中学2018-2019学年2021-07-058页
- 全国卷I2020届高考化学模拟试卷精2021-07-0512页
- 【化学】山东省济宁市微山县第二中2021-07-059页
- 2017-2018学年河南省林州一中高二2021-07-0517页
- 2020高中化学 芳香烃(基础)知识讲解2021-07-057页
- 2020届化学高考二轮复习(浙江)离子方2021-07-057页