- 184.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业(二)
A组—基础巩固
一、热化学方程式的意义
1.热化学方程式2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1中,化学式前面的化学计量数表示( )
A.分子数 B.体积
C.质量 D.物质的量
解析 热化学方程式与普通化学方程式不同,热化学方程式中化学计量数只表示物质的量,所以计量数可以是分数或小数。
答案 D
2.已知H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是( )
A.2 L HF(g)分解成1 L H2(g)与1 L F2(g)吸收270 kJ热量
B.1 mol H2(g)与1 mol F2(g)反应生成2 mol HF(l)放出的热量小于270 kJ
C.在相同条件下,1 mol H2(g)与1 mol F2(g)的总能量大于2 mol HF(g)的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
解析 由于热化学方程式中的化学计量数只表示对应物质的物质的量,不表示其体积或分子个数,故A、D两项错误;由于从HF(g)变为HF(l)要放出热量,因此1 mol H2(g)与1 mol F2(g)反应生成2 mol HF(l)放出的热量大于270 kJ,B项错误;由于该反应为放热反应,故E(反应物)>E(生成物),C项正确。
答案 C
3.下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g) 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
C.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应数值均为57.3 kJ
D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
解析 反应物总能量大于生成物总能量,为放热反应,则不能判断SO2、SO3的能量大小,故A项错误;完全燃烧放出热量多,放热反应ΔH<0,前者放热多,则ΔH1<ΔH2,故B项正确;弱酸、弱碱电离吸热,浓硫酸稀释放热,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1表示稀的强酸、强碱生成1 mol水时放出57.3 kJ热量,故C项错误;ΔH>0,石墨能量低,则石墨更稳定,故D项错误。故选B。
答案 B
7
二、热化学方程式的书写
4.已知在25 ℃、101 kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2===2H2O ΔH=-142.9 kJ/mol
B.2H2(g)+O2(g)===2H2O(l) ΔH=-142.9 kJ/mol
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
D.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ/mol
解析 书写热化学方程式要注意反应热的数值与反应物的物质的量和物质的聚集状态有关。
答案 C
考查内容 热化学方程式的书写
5.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)中和热一定是强酸跟强碱反应放出的热量。( )
(2)1 mol酸与1 mol碱完全反应放出的热量为中和热。( )
(3)在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热。( )
(4)表示中和热的离子方程式为:H++OH-===H2O ΔH=-57.3 kJ/mol。( )
答案 (1)× (2)× (3)√ (4)×
6.已知充分燃烧a g乙烯气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙烯燃烧的热化学方程式正确的是( )
A.C2H4(g)+3O2(g)===2CO2(g)+2H2O(l)
ΔH=-2b kJ/mol
B.C2H4(g)+3O2(g)===2CO2(g)+2H2O(l)
ΔH=+2b kJ/mol
C.2C2H4(g)+6O2(g)===4CO2(g)+4H2O(l)
ΔH=-2b kJ/mol
D.2C2H4(g)+6O2(g)===4CO2(g)+4H2O(l)
ΔH=+b kJ/mol
解析 乙烯燃烧是放热反应,ΔH为负值,通过定性判断,排除B、D两项,生成1 mol CO2时,放热b kJ,故生成2 mol CO2时,放热2b kJ。
答案 A
考查内容 热化学方程式的书写
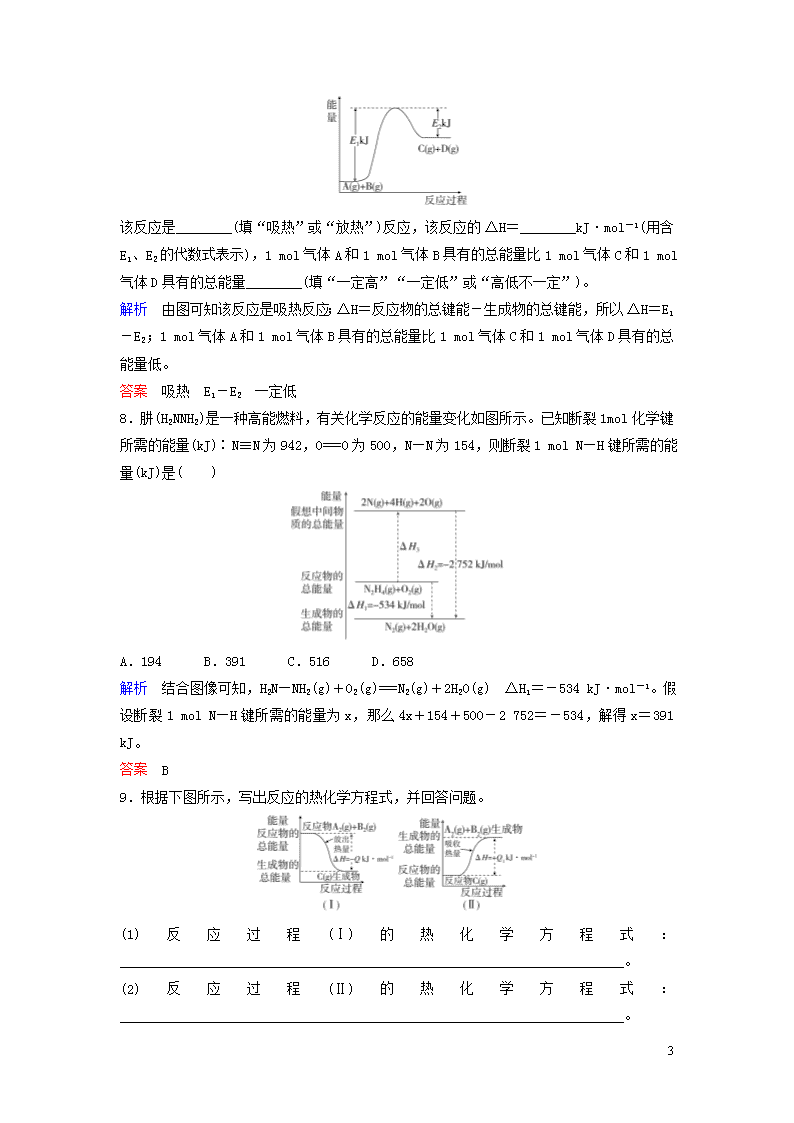
7.已知某反应A(g)+B(g)===C(g)+D(g)过程中的能量变化如图所示,回答问题。
7
该反应是________(填“吸热”或“放热”)反应,该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。
解析 由图可知该反应是吸热反应;ΔH=反应物的总键能-生成物的总键能,所以ΔH=E1-E2;1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量低。
答案 吸热 E1-E2 一定低
8.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ)∶N≡N为942,O===O为500,N—N为154,则断裂1 mol N—H键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658
解析 结合图像可知,H2N—NH2(g)+O2(g)===N2(g)+2H2O(g) ΔH1=-534 kJ·mol-1。假设断裂1 mol N—H键所需的能量为x,那么4x+154+500-2 752=-534,解得x=391 kJ。
答案 B
9.根据下图所示,写出反应的热化学方程式,并回答问题。
(1)反应过程(Ⅰ)的热化学方程式:________________________________________________________________________。
(2)反应过程(Ⅱ)的热化学方程式:________________________________________________________________________。
7
(3)Q与Q1的关系:Q________Q1(填“大于”“小于”或“等于”)。
解析 由图(Ⅰ)可知,A2(g)与B2(g)化合生成C(g)为放热反应,而图(Ⅱ)中C(g)分解生成A2(g)和B2(g)为图(Ⅰ)反应的逆反应,故二者的ΔH数值相等,符号相反,即Q=Q1。
答案 (1)A2(g)+B2(g)===C(g)ΔH=-Q kJ/mol
(2)C(g)===A2(g)+B2(g)ΔH=+Q1 kJ/mol
(3)等于
考查内容 热化学方程式的书写及ΔH的比较
10.长征Ⅱ火箭推进器中盛有强还原剂肼(N2H4)和强氧化剂液态双氧水(H2O2)。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应放出256.0 kJ的热量。
(1)该反应的热化学方程式为________________________________________________________________________。
(2)则16 g液态肼与液态双氧水反应生成气态水时放出的热量是________ kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________________________________________________________。
解析 (1)N2H4(肼)与H2O2发生氧化还原反应生成N2和H2O,反应方程式为:N2H4+2H2O2===N2+4H2O。1 mol肼反应生成气态水时放出的热量为=640 kJ,故其热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-640 kJ/mol。
(2)16 g液态肼与H2O2完全反应生成2 mol气态水时放出=320 kJ热量。
(3)反应产物是N2和水,对环境不会造成污染。
答案 (1)N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)
ΔH=-640.0 kJ/mol
(2)320 (3)对环境无污染
考查内容 热化学方程式的书写及计算
B组—能力提升
11.化学反应A2+B2===2AB的能量变化如下图所示,则下列说法中正确的是( )
A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键时能放出x kJ的能量
7
C.断裂2 mol A—B键时需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
解析 由图示可知:1 mol A2和1 mol B2的总能量高于2 mol AB的总能量,故该反应为放热反应,A、D两项错误;断裂化学键时需要吸收能量,B项错误,C项正确。
答案 C
考查内容 能量变化与反应本质的关系
12.(2017·海南,节选)碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
已知:
①2NaOH(s)+CO2(g)===Na2CO3(s)+H2O(g)
ΔH1=-127.4 kJ·mol-1
②NaOH(s)+CO2(g)===NaHCO3(s)
ΔH2=-131.5 kJ·mol-1
反应2NaHCO3(s)===Na2CO3(s)+H2O(g)+CO2(g)的ΔH=________ kJ·mol-1。
解析 ①-2×②得,2NaHCO3(s)===Na2CO3(s)+H2O(g)+CO2(g)
ΔH=+135.6 kJ·mol-1。
答案 +135.6
C组—高分突破
13.标准状况下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+O2(g)ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+O2(g)
ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g)
ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g)
ΔH=-485 kJ·mol-1
解析 化学反应的焓变等于反应物总键焓与生成物总键焓的差,由此可确定D项正确。
答案 D
考查内容 焓变与键能的关系,热化学方程式的书写
7
14.(2017·课标全国Ⅰ)近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________________________________________________________________、
________________________________________________________________________,
制得等量H2所需能量较少的是________。
解析 ①H2SO4(aq)===SO2(g)+H2O(l)+O2(g)ΔH1=+327
kJ·mol-1
②SO2(g)+I2(s)+2H2O(l)===2HI(aq)+H2SO4(aq)ΔH2===-151 kJ·mol-1
③2HI(aq)===H2(g)+I2(s)ΔH3=+110 kJ·mol-1
④H2S(g)+H2SO4(aq)===S(s)+SO2(g)+2H2O(l)ΔH4=+61 kJ·mol-1
①+②+③,整理可得系统(Ⅰ)的热化学方程式
H2O(l)===H2(g)+O2(g) ΔH=+286 kJ·mol-1;
②+③+④,整理可得系统(Ⅱ)的热化学方程式
H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1。
根据系统(Ⅰ)、系统(Ⅱ)的热化学方程式可知:每反应产生1 mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统(Ⅱ)。
答案 H2O(l)===H2(g)+O2(g)
ΔH=+286 kJ·mol-1
H2S(g)===H2(g)+S(s)ΔH=+20 kJ·mol-1
系统(Ⅱ)
7
7