- 454.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时达标作业35 晶体结构与性质
基础题
1.根据下列几种物质的熔点和沸点数据,判断下列有关说法中,错误的是( )
物质
NaCl
MgCl2
AlCl3
SiCl4
单质B
熔点/℃
810
710
190
-68
2 300
沸点/℃
1 465
1 418
182.7
57
2 500
注:AlCl3熔点在2.5×105 Pa条件下测定。
A.SiCl4是分子晶体
B.单质B是原子晶体
C.AlCl3加热能升华
D.MgCl2所含离子键的强度比NaCl大
2.离子晶体熔点的高低取决于晶体中晶格能的大小。判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是( )
A.KCl>NaCl>BaO>CaO
B.NaCl>KCl>CaO>BaO
C.CaO>BaO>NaCl>KCl
D.CaO>BaO>KCl>NaCl
3.下面有关晶体的叙述中,不正确的是( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
4.现有四种晶体,其离子排列方式如图所示,其中化学式正确的是( )
5.
8
磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。如图是Mn和Bi形成的某种晶体的结构示意图(白球均在六棱柱内),则该晶体物质的化学式可表示为( )
A.Mn2Bi B.MnBi
C.MnBi3 D.Mn4Bi3
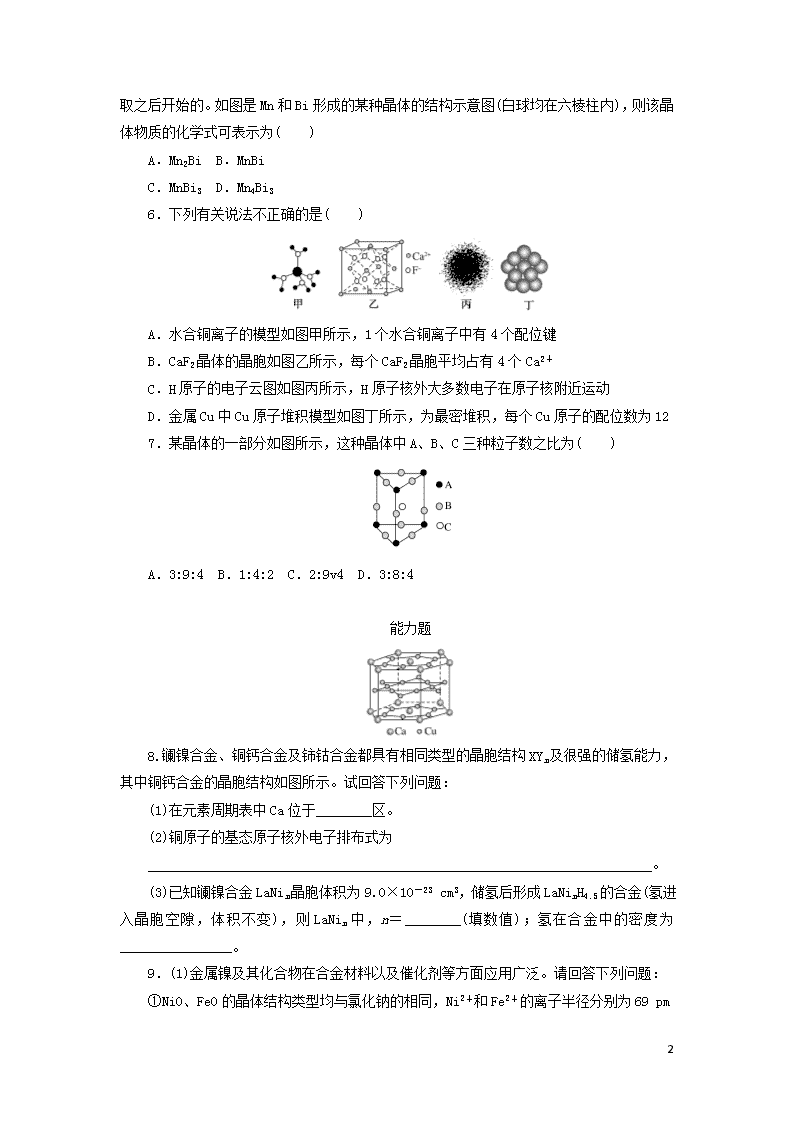
6.下列有关说法不正确的是( )
A.水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B.CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+
C.H原子的电子云图如图丙所示,H原子核外大多数电子在原子核附近运动
D.金属Cu中Cu原子堆积模型如图丁所示,为最密堆积,每个Cu原子的配位数为12
7.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比为( )
A.3:9:4 B.1:4:2 C.2:9v4 D.3:8:4
能力题
8.镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn及很强的储氢能力,其中铜钙合金的晶胞结构如图所示。试回答下列问题:
(1)在元素周期表中Ca位于________区。
(2)铜原子的基态原子核外电子排布式为
________________________________________________________________________。
(3)已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=________(填数值);氢在合金中的密度为________________。
9.(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69
8
pm和78 pm,则熔点FeO________NiO(填“<”或“>”);
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为________。
(2)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
①用A、B、O表示这类特殊晶体的化学式:
________________________________________________________________________
________________________________________________________________________。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为________。
③下列有关说法正确的是________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
10.元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)基态磷原子核外有________种运动状态不同的电子。
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如下所示,则其中“2”原子的结构示意图为________,“8”原子的电子排布式为________。
8
(3)氢化镁储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为________,晶胞的体积为________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体
NaCl
KCl
CaO
晶格能/(kJ·mol-1)
786
715
3401
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
11.(1)钠、钾、铬、钼、钨等金属晶体的晶胞属于体心立方,则该晶胞中属于1个体心立方晶胞的金属原子数目是________。氯化铯晶体的晶胞如图1,则Cs+位于该晶胞的________,而Cl-位于该晶胞的________,Cs+的配位数是________。
(2)铜的氢化物的晶体结构如图2所示,写出此氢化物在氯气中燃烧的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)图3为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。
(4)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图4所示),已知3种离子晶体的晶格能数据如下表:
离子晶体
NaCl
KCl
CaO
晶格能/kJ·mol-1
786
715
3 401
则这4种离子晶体(不包括NaCl)熔点从高到低的顺序是________________________。
8
课时达标作业35 晶体结构与性质
1.解析:三类不同的晶体由于形成晶体的粒子和粒子间的作用力不同,因而表现出不同的性质。原子晶体具有高的熔、沸点,硬度大、不能导电;而离子晶体也具有较高的熔、沸点、较大的硬度,在溶液中或熔化状态下能导电;分子晶体熔、沸点低,硬度小、不导电,熔化时无化学键断裂,据这些性质可确定晶体类型。根据上述性质特点及表中数据进行分析,NaCl的熔、沸点均比MgCl2高,所以NaCl晶体中的离子键应比MgCl2强,故D不正确。
答案:D
2.解析:离子晶体中,晶格能越大,晶体熔、沸点越高;离子所带电荷总数越多,半径越小,晶格能越大。
答案:C
3.解析:氯化钠晶体中每个Na+周围距离相等且紧邻的Na+共有12个,B项错误。
8
答案:B
4.解析:A.A离子个数是1,B离子个数=1/8×8=1,所以其化学式为AB,故A错误;B.E离子个数=1/8×4=1/2,F离子个数=1/8×4=1/2,E、F离子个数比为1:1,所以其化学式为EF,故B错误;C.X离子个数是1,Y离子个数=1/2×6=3,Z离子个数=1/8×8=1,所以其化学式为XY3Z,故C正确;D.A离子个数=1/8×8+1/2×6=4,B离子个数=12×1/4+1=4,A、B离子个数比1:1,所以其化学式为AB,故D错误。
答案:C
5.解析:由晶体的结构示意图可知:白球代表Bi原子,且均在六棱柱内,所以Bi为6个。黑球代表Mn原子,个数为:12×+2×+1+6×=6(个),则二者的原子个数比为6:6=1:1。
答案:B
6.解析:电子云是用来表示电子出现的概率,但不代表有一个电子在那里,C项错。
答案:C
7.解析:A粒子数为6×=;B粒子数为6×+3×=2;C粒子数为1;故A、B、C粒子数之比为:2:1=1:4:2。
答案:B
8.解析:(3)由铜钙合金的晶胞结构图知,铜、钙合金中,N(Cu)=12×+6×+6=15,N(Ca)=12×+2×=3,==,因镧镍合金与铜钙合金的晶胞结构相同,则在LaNin中=,n=5。1 mol合金中含有NA个该合金的晶胞,则ρ·9.0×10-23 cm3·NA=M,ρ=≈0.083 g·cm-3。
答案:(1)s
(2)1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)5 0.083 g·cm-3
9.解析:(1)①NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高。由于Ni2+的离子半径小于Fe2+的离子半径,则熔点NiO>FeO。②δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3。
(2)①由图1可知,晶胞中A位于顶点,晶胞中含有A为8×
8
=1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×=3,则化学式为ABO3。
②设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有3(1-x)+2x+3m+4n=6、m+n=1,解之得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为(1-x) :x。
③A.由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;B.氮元素的2p轨道电子处于半充满状态,稳定性强,因此氮元素的第一电离能大于氧元素的第一电离能,故B错误;C.元素的电负性越强,金属性越弱,故C正确;D.图中堆积方式为镁型,故D错误。
答案:
(1)①< ②4:3
(2)①ABO3 ②(1-x) :x ③A、C
10.解析:(1)P的核外有15个电子,每个电子的运动状态均不同。
(2)第三周期元素的单质,除Ar外,只有Cl2为气体,熔点较低,单质硅为原子晶体,熔点最高。
(3)该晶体的晶胞中含有2个“MgH2”,则晶胞的体积为÷ρ= (cm3)。
(4)晶格能越大,离子晶体的熔点越高,而晶格能与离子的电荷和半径有关,可以判断晶格能:MgO>CaO>KCl,则熔点:MgO>CaO>KCl。
答案:(1)15
(2) 1s22s22p63s23p2或[Ne]3s23p2
(3)MgH2
(4)MgO>CaO>KCl 12
11.解析:(1)体心立方晶胞中,1个原子位于体心,8个原子位于立方体的顶点,故1个晶胞中金属原子数为8×+1=2;氯化铯晶胞中,Cs+位于体心,Cl-位于顶点,Cs+的配位数为8。(2)由晶胞可知,粒子个数比为1:1(铜为8×+6×=4,H为4),化学式为CuH,+1价的铜与-1价的氢均具有较强的还原性,氯气具有强氧化性,产物为CuCl2和HCl。(3)由晶胞结构可知,黑球有1个,灰球有1个,白球有3个,由电荷守恒可知n(Mg2+) :n(K+) :n(F-)=1:1:3,故白球为F-。(4)从3种离子晶体的晶格能数据可知,离子所带电荷越大、离子半径越小,离子晶体的晶格能越大,离子所带电荷数:Ti3+>Mg2+,离子半径:Mg2+MgO>CaO>KCl。
答案:
8
(1)2 体心 顶点 8
(2)2CuH+3Cl22CuCl2+2HCl
(3)F-
(4)TiN>MgO>CaO>KCl
8
相关文档
- 2021版化学名师讲练大一轮复习鲁科2021-07-052页
- 高中化学人教版选修三(学业分层测评2021-07-058页
- 化学人教版选修3学案:第三章 晶体2021-07-059页
- 高中化学选修三第三章--晶体结构与2021-07-0529页
- 2019届一轮复习人教版晶体结构与性2021-07-057页
- 高中化学第三章晶体结构与性质第四2021-07-059页
- 2020届高考化学一轮复习晶体结构与2021-07-0510页
- 2018届一轮复习鲁科版专题二十七物2021-07-0516页
- 2019届高考化学一轮复习晶体结构与2021-07-0532页
- 2020届一轮复习人教版第11章第3节2021-07-0511页