- 496.95 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题六 化学反应与能量
一、单项选择题
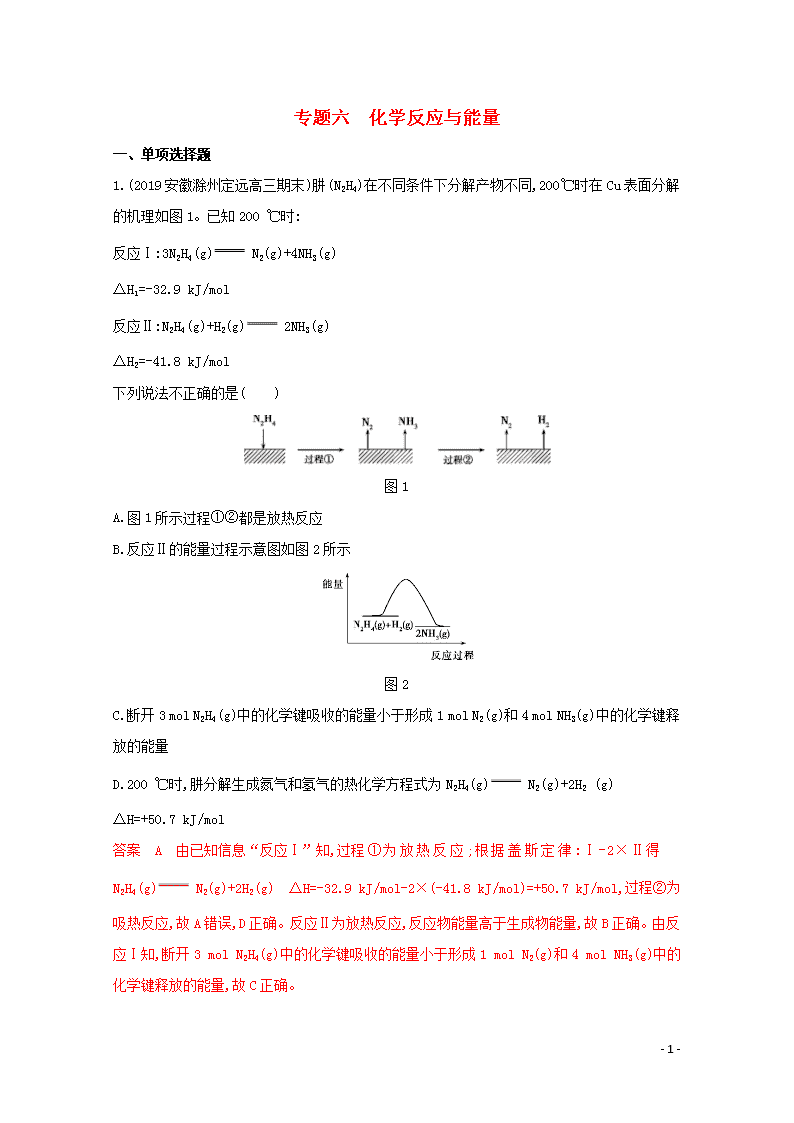
1.(2019安徽滁州定远高三期末)肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。已知200 ℃时:
反应Ⅰ:3N2H4(g) N2(g)+4NH3(g)
ΔH1=-32.9 kJ/mol
反应Ⅱ:N2H4(g)+H2(g) 2NH3(g)
ΔH2=-41.8 kJ/mol
下列说法不正确的是( )
图1
A.图1所示过程①②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
图2
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g) N2(g)+2H2 (g) ΔH=+50.7 kJ/mol
答案 A 由已知信息“反应Ⅰ”知,过程①为放热反应;根据盖斯定律:Ⅰ-2×Ⅱ得N2H4(g) N2(g)+2H2(g) ΔH=-32.9 kJ/mol-2×(-41.8 kJ/mol)=+50.7 kJ/mol,过程②为吸热反应,故A错误,D正确。反应Ⅱ为放热反应,反应物能量高于生成物能量,故B正确。由反应Ⅰ知,断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量,故C正确。
- 10 -
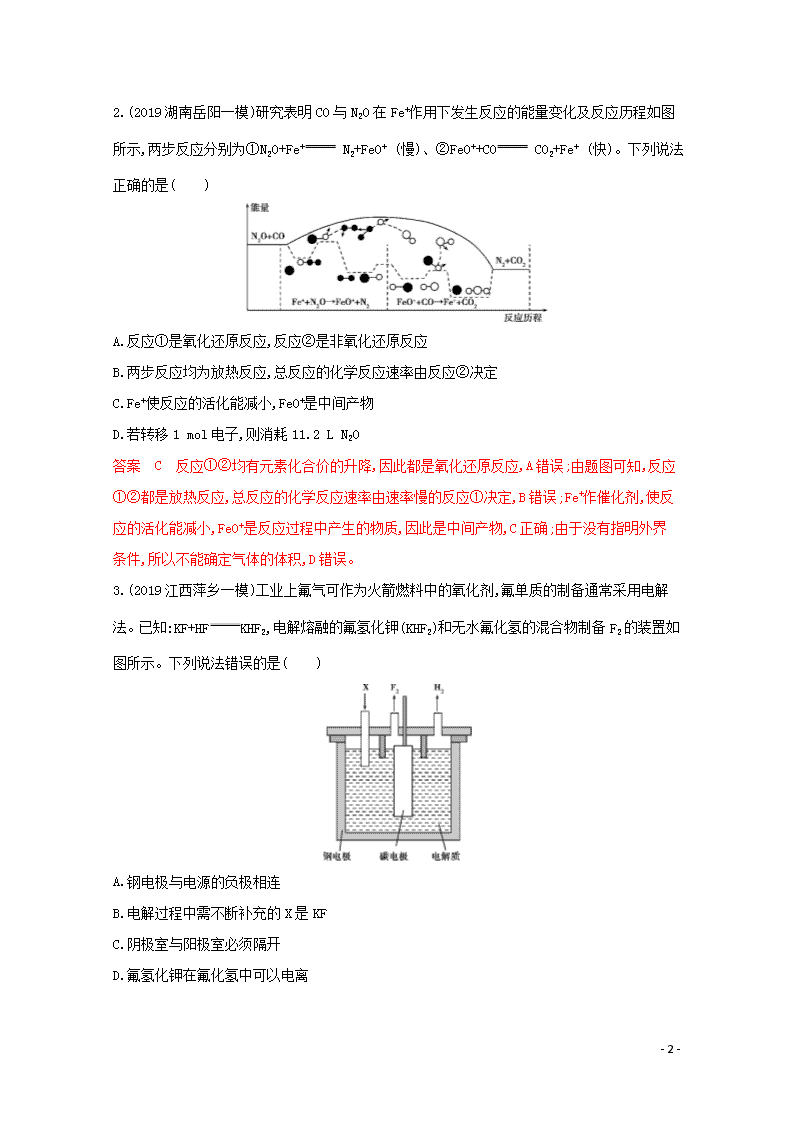
2.(2019湖南岳阳一模)研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为①N2O+Fe+ N2+FeO+ (慢)、②FeO++CO CO2+Fe+ (快)。下列说法正确的是( )
A.反应①是氧化还原反应,反应②是非氧化还原反应
B.两步反应均为放热反应,总反应的化学反应速率由反应②决定
C.Fe+使反应的活化能减小,FeO+是中间产物
D.若转移1 mol电子,则消耗11.2 L N2O
答案 C 反应①②均有元素化合价的升降,因此都是氧化还原反应,A错误;由题图可知,反应①②都是放热反应,总反应的化学反应速率由速率慢的反应①决定,B错误;Fe+作催化剂,使反应的活化能减小,FeO+是反应过程中产生的物质,因此是中间产物,C正确;由于没有指明外界条件,所以不能确定气体的体积,D错误。
3.(2019江西萍乡一模)工业上氟气可作为火箭燃料中的氧化剂,氟单质的制备通常采用电解法。已知:KF+HF KHF2,电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物制备F2的装置如图所示。下列说法错误的是( )
A.钢电极与电源的负极相连
B.电解过程中需不断补充的X是KF
C.阴极室与阳极室必须隔开
D.氟氢化钾在氟化氢中可以电离
- 10 -
答案 B 根据装置图,逸出的气体为H2和F2,说明电解质中减少的是氢元素和氟元素,因此电解过程中需不断补充的X是HF。
4.(2019安徽芜湖一模)以熔融Na2CO3为电解质,H2和CO混合气为燃料的电池,原理如下图所示。下列说法正确的是( )
A.b是电池的负极
B.a电极的反应为CO+CO32--2e- 2CO2、H2+CO32--2e- H2O+CO2
C.电子由a电极经熔融Na2CO3向b电极移动
D.a、b两极消耗的气体的物质的量之比是1∶1
答案 B A项,b电极上氧气得电子与二氧化碳反应生成碳酸根离子,则b是电池的正极,错误;B项,a为负极,负极上一氧化碳和氢气被氧化分别生成二氧化碳和水,a电极的反应为CO+CO32--2e- 2CO2、H2+CO32--2e- H2O+CO2,正确;C项,a为负极,b为正极,电子经外电路由负极流向正极,错误;D项,a电极的反应为CO+CO32--2e- 2CO2、H2+CO32--2e- H2O+CO2,b电极的反应为O2+2CO2+4e- 2CO32-,则a、b两极消耗的气体的物质的量之比是2∶1,错误。
5.(2019江西七校第一次联考)随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是( )
A.该电池的优点是不产生污染气体,且液体燃料便于携带
B.电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C.该燃料电池的电极材料采用多孔纳米碳材料,目的是增大接触面积,增加吸附量
D.该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e- N2↑+4H2O
- 10 -
答案 D A项,该燃料电池中,联氨和空气中的氧气反应生成氮气和水,不会造成大气污染,同时液态联氨便于携带,正确;B项,该原电池中,正极上氧气得到电子最终生成氢氧根离子,氢氧根离子移向负极,所以离子交换膜要选取阴离子交换膜,正确;C项,因为电池中正、负极上为气体参与的反应,所以采用多孔纳米碳材料,可以增加反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,正确;D项,通入N2H4的电极为负极,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e- N2↑+4H2O,错误。
6.(2019河北保定模拟)用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法中不正确的是( )
A.X为直流电源的负极,Y为直流电源的正极
B.阳极反应为4OH--4e- 2H2O+O2↑
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
答案 B 根据Na+和SO32-的移动方向可知,Pt(Ⅰ)为阴极,电极反应式为2H++2e-H2↑,
Pt(Ⅱ)为阳极,电极反应式为SO32--2e-+H2OSO42-+2H+。
7.(2018课标Ⅱ,12,6分)我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,ClO4-向负极移动
- 10 -
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-2CO32-+C
D.充电时,正极反应为Na++e-Na
答案 D 本题考查二次电池的工作原理。放电时,负极反应为4Na-4e-4Na+,正极反应为3CO2+4e-C+2CO32-;Na+移向正极,CO32-、ClO4-移向负极,A、C正确;充电过程与放电过程相反,B正确;充电时,阳极反应为2CO32-+C-4e-3CO2↑,D错误。
二、不定项选择题
8.工业上通过电化学原理在铝表面形成氧化膜来提高其抗腐蚀能力,工作原理如图所示。下列说法中不正确的是( )
A.碳棒可用铜棒代替,其作用是传递电流
B.通电一段时间后,溶液的pH增大
C.通电后电子被强制从碳棒通过电解质溶液流向铝片使铝表面形成氧化膜
D.可通过调节滑动变阻器来控制氧化膜的形成速率
答案 BC 根据电解原理,碳棒为阴极,铜棒能够代替碳棒,其作用是传递电流,A项正确;阳极反应式为2Al-6e-+3H2O Al2O3+6H+,阴极反应式为2H++2e- H2↑,总电解反应式为2Al+3H2O Al2O3+3H2↑,通电一段时间后硫酸浓度增大,c(H+)增大,即溶液pH减小,B项错误;电解质溶液中没有电子通过,C项错误;滑动变阻器可调节电路中电流的强度,即可以控制氧化膜的形成速率,D项正确。
9.通过电解法分离NaHSO3与Na2SO3的混合物,其装置如图所示。下列说法不正确的是( )
- 10 -
A.阳极的电极反应式为4OH--4e- 2H2O+O2↑
B.阳极区c(H+)增大,H+由a室经阳离子交换膜进入b室
C.外电路每转移0.2 mol电子,有0.2 mol Na+从b室进入c室
D.c室得到Na2SO3的原因是OH-+HSO3- H2O+SO32-
答案 C 阳极区OH-放电被消耗,电极反应式为4OH--4e- 2H2O+O2↑,阴极发生还原反应,电极反应式为2H2O+2e- 2OH-+H2↑。外电路每转移0.2 mol电子,不仅有Na+转移,还有H+转移,故C错误。
10.一种新型的铝离子可充电电池的示意图如下,已知放电时电池反应为xAl+VO2 AlxVO2。
下列说法正确的是( )
A.放电时,Al3+向VO2电极移动
B.放电时,电能转化为化学能
C.充电时,阳极发生的反应为AlxVO2-3xe- xAl3++VO2
D.充电时,离子液体中Al3+的浓度不断变小
答案 AC 根据放电时电池反应可知,铝为负极,放电时,阳离子向正极迁移,A项正确;放电时,化学能转化为电能,B项错误;充电时,阳极发生氧化反应,AlxVO2在生成VO2的同时释放出Al3+,C项正确;阳极释放的Al3+与阴极上还原的Al3+的数目相等,离子液体中Al3+的浓度不变,D项错误。
- 10 -
三、非选择题
11.(2017课标Ⅲ,28节选)已知:
As(s)+32H2(g)+2O2(g) H3AsO4(s) ΔH1
H2(g)+12O2(g) H2O(l) ΔH2
2As(s)+52O2(g) As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l) 2H3AsO4(s)的ΔH= 。
答案 2ΔH1-3ΔH2-ΔH3
解析 结合题给信息,根据盖斯定律计算得ΔH=2ΔH1-3ΔH2-ΔH3。
12.(2019广州外国语学校模拟)乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH<0。
(1)若该反应体系的能量随反应过程的变化关系如图所示,则该反应的ΔH= kJ·mol-1(用含a、b的式子表示)。
(2)几种化学键的键能如下表所示,实验测得上述反应的ΔH=-152 kJ·mol-1,则表中的x= 。
化学键
CO
H—H
CC
C—H
O—H
键能/(kJ·mol-1)
803
436
x
414
463
答案 (1)-2(b-a) (2)620
解析 (1)ΔH等于正反应的活化能与逆反应的活化能的差。由图可知反应2CO2(g)+6H2(g)
C2H4(g)+4H2O(g)为放热反应,ΔH=-2(b-a)kJ·mol-1。(2)ΔH=(4×803+6×436-4×414-x-8×463)kJ·mol-1=-152 kJ·mol-1,解得x=620。
- 10 -
命题拓展预测
1.N2O和CO是环境污染性气体,可在催化条件下转化为无害气体,反应进程中的能量变化如图所示。下列说法正确的是( )
A.加入催化剂使反应的ΔH变小
B.该反应的热化学方程式为N2O(g)+CO(g) CO2(g)+N2(g) ΔH=-226 kJ·mol-1
C.反应物的总键能大于生成物的总键能
D.该反应正反应的活化能大于逆反应的活化能
答案 B 对于特定化学反应,加入催化剂只是改变化学反应途径,不改变化学反应的反应热,A项错误;该反应的热化学方程式为N2O(g)+CO(g) CO2(g)+N2(g) ΔH=Ea1-Ea2=
(134-360) kJ·mol-1=-226 kJ·mol-1,B项正确;该反应为放热反应,反应物的总键能小于生成物的总键能,C项错误;该反应正反应的活化能为134 kJ·mol-1,逆反应的活化能为360 kJ·mol-1,即该反应逆反应的活化能大于正反应的活化能,D项错误。
2.《Journal of Energy Chemistry》报导我国科学家设计的CO2熔盐捕获与转化装置如图。
下列有关说法正确的是( )
A.a为负极
B.熔盐可用KOH溶液代替
C.d极电极反应式为CO32-+4e- C+3O2-
D.转移1 mol电子可捕获CO2 5.6 L(标准状况下)
- 10 -
答案 CD 由题图所示,c电极上O2-失电子被氧化,故c作阳极,则a为正极,A项错误;若用KOH溶液作电解质,则该装置为电解水的装置,阴极上是氢离子得电子生成氢气,当电解质溶液吸收足量的二氧化碳后变为碳酸氢钾溶液,不能再吸收二氧化碳,B项错误;d电极得电子,反应式为CO32-+4e- C+3O2-,C项正确;碳元素化合价由+4变为0,则转移1 mol电子可捕获CO2 5.6 L(标况下),D项正确。
3.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
回答下列问题:
(1)外电路的电流方向是由 极流向 极(填字母)。
(2)电池正极反应式为 。
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为 ,阴极产生的物质A的化学式为 。
答案 (1)b a (2)MnO2+e-+Li+ LiMnO2
(3)3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O 2∶1
(4)2H2O-4e-+4CO32- 4HCO3-+O2↑ H2
解析 (1)Li为负极,MnO2为正极,原电池工作时,外电路的电流方向从正极到负极,即从b极流向a极。
- 10 -
(2)MnO2为正极,被还原,电极反应式为MnO2+e-+Li+ LiMnO2。
(3)MnO2与KOH和KClO3在高温下反应,生成K2MnO4和KCl,其中Mn元素的化合价由+4升高为+6,Cl元素化合价由+5降低为-1,根据得失电子守恒、原子守恒配平方程式为3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O。
(4)由题图可知,阳极反应式为4CO32-+2H2O-4e- 4HCO3-+O2↑;阴极上H+得到电子生成氢气,则阴极产生的物质A的化学式为H2。
- 10 -