- 74.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
热化学方程式
学习目标
1.认识热化学方程式的意义
2.会计算化学反应的ΔH
3.会书写热化学方程式
重点
化学方程式的书写
难点
有关ΔH的计算
学法指导
在理解化学反应的能量变化首先取决于化学键的强弱,对于一个特定的反应还与参加反应物质的量与物质的状态有关的基础上理解热化学方程式的意义,从而能正确书写热化学方程式和ΔH的计算
自学引导︵学生课前必须完成︶
一、自主学习:(请同学们认真阅读课本3-4页,你一定能完成下列问题)
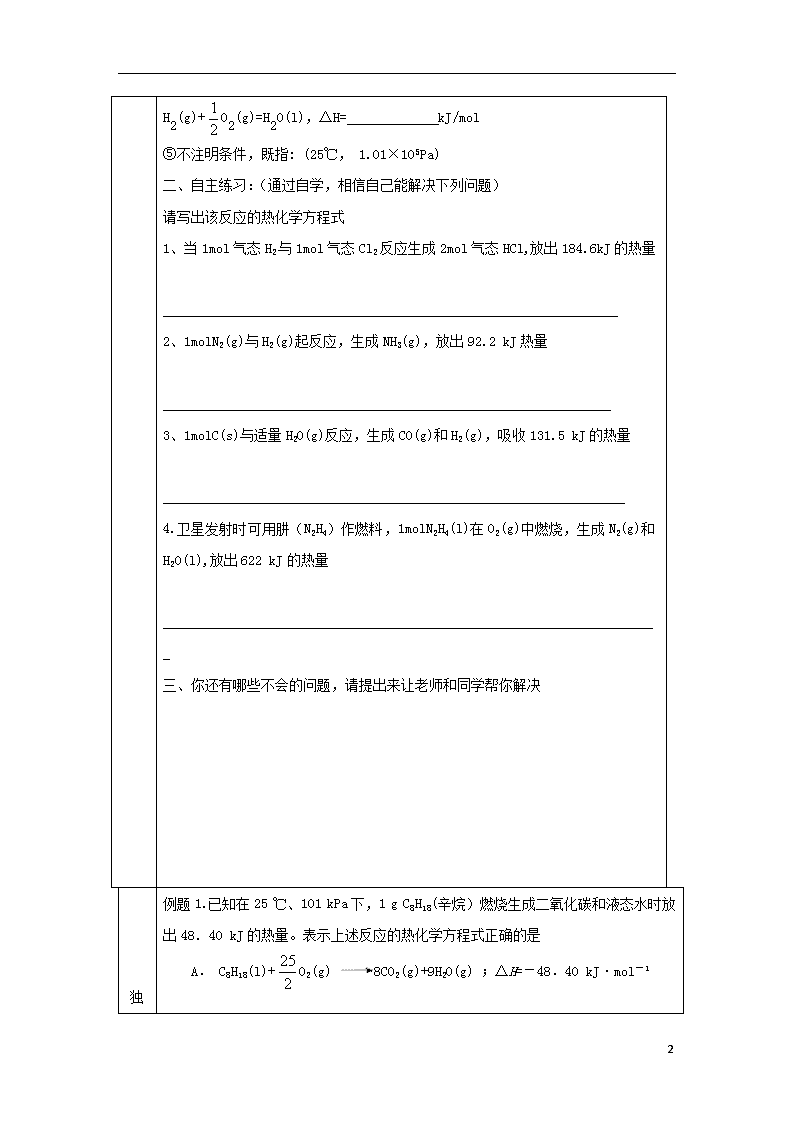
1. 化学方程式,叫做热化学方程式。热化学方程式不仅表明了化学反应中的 变化,也表明了化学反应中的 变化。
2、H2(g)+O2(g)===H2O(l) ; ΔH=-285.8 kJ·mol-1,表示在 ℃,_
Pa, mol H2与 mol O2完全反应生成 态水时 的热量是285.8 kJ。
H2O(l) === H2(g)+O2(g); ΔH=________ kJ·mol-1,
3、热化学方程式各物质前的化学计量数表示物质的量,因此,它可以是 _数,也可以是 数。对于相同物质的反应,当化学计量数不同时,其ΔH 。
即使化学计量数相同,当反应物和生成物的状态不同时,△H数值____________
同一种物质的气态能量______液态_______固体(填“高于”或“低于”)
小结:书写热化学方程式的注意事项
①标聚集状态【s(固体)、l(液体)、g(气体)】
②右端标ΔH(ΔH由三部分组成即符号+数值+kJ/mol)
△H:吸热用“ ”,放热用:“ ”且“+”不省略。
③计量数单位是“ ”,而不是“ ”。
④计量数可用分数,但热量值要相应变化。如:
2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ/mol
5
H2(g)+O2(g)=H2O(l),△H= kJ/mol
⑤不注明条件,既指: (25℃, 1.01×105Pa)
二、自主练习:(通过自学,相信自己能解决下列问题)
请写出该反应的热化学方程式
1、当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6kJ的热量
_________________________________________________________________
2、1molN2(g)与H2(g)起反应,生成NH3(g),放出92.2 kJ热量
________________________________________________________________
3、1molC(s)与适量H2O(g)反应,生成CO(g)和H2(g),吸收131.5 kJ的热量
__________________________________________________________________
4.卫星发射时可用肼(N2H4)作燃料,1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622 kJ的热量
_______________________________________________________________________
三、你还有哪些不会的问题,请提出来让老师和同学帮你解决
例题1.已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ的热量。表示上述反应的热化学方程式正确的是
A. C8H18(l)+O2(g) 8CO2(g)+9H2O(g) ;ΔH=-48.40 kJ·mol-1
5
独立思考
合作探究
B. C8H18(l)+O2(g) 8CO2(g)+9H2O(l) ;ΔH=-5 518 kJ·mol-1
C. C8H18(l)+ O2(g) 8CO2(g)+9H2O ;ΔH=+5 518 kJ·mol-1
D. C8H18(l)+ O2(g) 8CO2(g)+9H2O(l) ;ΔH=-48.40 kJ·mol-1
例题2.在同温同压下,下列各组热化学方程中△H1>△H2的是( )
A、2H2(g)+O2(g)==2H2O(g);△H1
2H2(g)+O2(g)==2H2O(l); △H2
B、S(g)+O2(g)==SO2(g); △H1
S(s)+O2(g)==SO2(g); △H2
C、C(s)+1/2O2(g)==CO(g); △H1
C(s)+ O2(g)==CO2 (g); △H2
D、H2(g)+ Cl2(g)==2HCl(g); △H1
1/2H2(g)+1/2Cl2(g) ==HCl(g);△H2
巩固练习
1.石墨和金刚石都是碳元素的单质,石墨在一定条件下可转化为金刚石。已知12 g石墨完全转化成金刚石时,要吸收E kJ的能量,下列说法正确的是( )
A.石墨不如金刚石稳定 B.金刚石不如石墨稳定
C.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多
2.在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A. CH3OH(l)+O2(g) CO2(g)+2H2O(l) ;ΔH=+725.8 kJ·mol-1
B. 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) ;ΔH=-1 452 kJ·mol-1
C. 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) ;ΔH=-725.8 kJ·mol-1
D. 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) ; ΔH=+1 452 kJ·mol-1
5
3.以NA代表阿伏加德罗常数,则关于热化学方程式
C2H2(g)+O2(g) 2CO2(g)+H2O(l) ;ΔH=-1 300 kJ·mol-1的说法中,正确的是
A.当10NA个电子转移时,该反应放出1 300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1 300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1 300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1 300 kJ的能量
4.家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧反应的热化学方程式_______________。已知1 mol液态水汽化时需要吸收44 kJ的热量,则1 mol丁烷完全燃烧并生成气态水时放出的热量为______kJ。
4.298 K、101 kPa时,合成氨反应的热化学方程式为N2(g)+3H2(g)2NH3(g); ΔH=-92.38 kJ·mol-1。在该温度下,取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在情况下进行反应,测得反应放出的热量总是少于92.38 kJ,其原因是什么?
学习体会
达标测试:
5
1.我们把拆开1 mol 共价键所吸收的能量或生成1 mol共价键所放出的能量叫键能,已知Cl—Cl键的键能为247 kJ·mol-1。下列有关键能的叙述正确的是
A.要拆开1 mol Cl—Cl键需吸收247 kJ能量
B.要形成1 mol Cl—Cl键需吸收247 kJ能量
C.要拆开1 mol Cl—Cl键需放出247 kJ能量
D.要形成1 mol Cl—Cl键需放出247 kJ能量
2.石墨和金刚石都是碳元素的单质,石墨在一定条件下可转化为金刚石。已知12 g石墨完全转化成金刚石时,要吸收E kJ的能量,下列说法正确的是( )
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多
3、 1 g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94 kJ的热量,相应的热化学方程式为 ( )
A.C+H2O=CO+H2 ΔH=+10.9 kJ/ mol
B.C(s)+H2O(g)=CO(g)+H2(g) ΔH=+10.94 kJ/ mol
C.C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.28 kJ/ mol
D.1/2C(s)+ 1/2H2O(g)= 1/2CO(g)+ 1/2H2(g ) ΔH=+65.64 kJ/ mol
4、已知1mol白磷转化成1mol红磷,放出18.39 kJ热量,又知:P4(白,s)+5O2 = 2P2O5(s) ΔH1,4P(红,s)+5O2 = 2P2O5 (s)ΔH2
则ΔH1和ΔH2的关系正确的是( )
A.ΔH1>ΔH2 B.ΔH1<ΔH2
C.ΔH1=ΔH2 D.无法确定
5
相关文档
- 2020高中化学 期末君之讲稿(二十)离2021-07-053页
- 2020_2021学年高中化学第四章电化2021-07-059页
- 2020年高中化学 第03章 水溶液中的2021-07-0512页
- 高中化学 电解质溶液中粒子浓度主2021-07-054页
- 2019-2020学年高中化学课时作业3元2021-07-057页
- 高中化学 3_1_1甲烷的性质课时提升2021-07-055页
- 2020年高中化学 第4章 电化学基础2021-07-055页
- 2020高中化学第二章烃和卤代烃第一2021-07-056页
- 高中化学 1_3《化学反应热的计算》2021-07-0524页
- 2020版高中化学 第3章 重要的有机2021-07-055页