- 454.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密★启用前
北京市第 101 中学 2017-2018 学年高二下学期期末考试化学
试题
试卷副标题
考试范围:xxx;考试时间:100 分钟;命题人:xxx
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第 I 卷(选择题)
请点击修改第 I 卷的文字说明
评卷人 得分
一、单选题
1.下列能量的转化过程中,由化学能转化为电能的是
A B C D
铅蓄电池放电 风力发电 水力发电 太阳能发电
A.A B.B C.C D.D
2.下列化学用语正确的是
A.HSO3
-+ H2O SO32- + OH- B.Al3+ + 3H2O == 3H+ + Al(OH)3↓
C.NaHCO3 == Na+ + HCO3
- D.H2S 2H+ + S2-
3.下列关于金属腐蚀与防护的说法不正确的是
图① 图② 图③
A.图①,放置于干燥空气中的铁钉不易生锈
B.图②,若断开电源,钢闸门将发生吸氧腐蚀
C.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D.图③,若金属 M 比 Fe 活泼,可防止输水管腐蚀
4.下列溶液一定呈中性的是( )
A.pH=7 的溶液 B.c(H+)=c(OH-)=10-6mol/L 的溶液
C.使酚酞试液呈无色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
5.如图所示是 298K 时,N2 与 H2 反应过程中能量变化的曲线图,下列叙述不正确的是
A.在温度、体积一定的条件下,通入 1mol N2 和 3mol H2 反应后放出的热量为 92kJ
B.a 曲线是加入催化剂时的能量变化曲线
C.加入催化剂,也不能提高 N2 的转化率
D.该反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=﹣92 kJ/mol
6.下列实验事实不能用平衡移动原理解释的是
A.pH=11 的氨水稀释 10 倍后溶液 pH>10
B.将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C.对 2HI(g) H2(g)+I2(g),减小容器体积,气体颜色变深
D.水垢中含有 CaSO4,可先用 Na2CO3 溶液浸泡处理,而后用盐酸去除
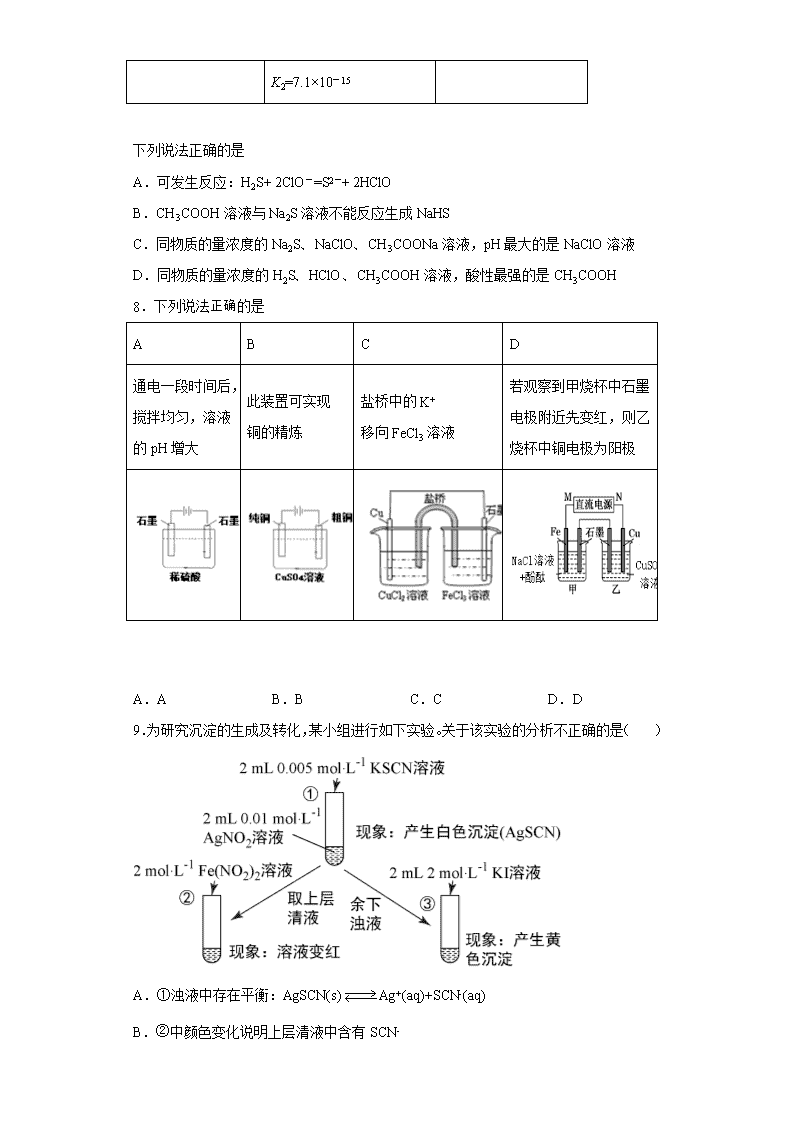
7.以下是常温下几种弱酸的电离平衡常数:
CH3COOH H2S HClO
K=1.8×10-5 K1=1.3×10-7 K=4.69×10-11
K2=7.1×10-15
下列说法正确的是
A.可发生反应:H2S+ 2ClO-=S2-+ 2HClO
B.CH3COOH 溶液与 Na2S 溶液不能反应生成 NaHS
C.同物质的量浓度的 Na2S、NaClO、CH3COONa 溶液,pH 最大的是 NaClO 溶液
D.同物质的量浓度的 H2S、HClO、CH3COOH 溶液,酸性最强的是 CH3COOH
8.下列说法正确的是
A B C D
通电一段时间
后,搅拌均匀,
溶液的 pH 增大
此装置可实现
铜的精炼
盐桥中的 K+
移向 FeCl3 溶液
若观察到甲烧杯中石墨
电极附近先变红,则乙
烧杯中铜电极为阳极
A.A B.B C.C D.D
9.为研究沉淀的生成及转化,某小组进行如下实验。关于该实验的分析不正确的是
( )
A.①浊液中存在平衡:AgSCN(s) Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有 SCN-
C.③中颜色变化说明有 AgI 生成
D.该实验可以证明 AgI 比 AgSCN 更难溶
10.K2FeO4 在水中不稳定,发生反应:4FeO42-+10H2O 4Fe(OH)3(胶体)+8OH
-+3O2,其稳定性与温度(T)和溶液 pH 的关系分别如图所示。下列说法不正确的是
A.由图Ⅰ可知 K2FeO4 的稳定性随温度的升高而减弱
B.由图Ⅱ可知图中 a>c
C.由图Ⅰ可知温度:T1>T2>T3
D.由图Ⅰ可知上述反应△H>0
11.为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以 Al 作阳极、Pb 作阴极,电解稀
硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq)
=2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2 Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 电解池
A H+移向 Pb 电极 H+移向 Pb 电极
B 每消耗 3molPb 生成 2molAl2O3
C 正极:PbO2+4H++2e—=Pb2++2H2O 阳极:2Al+3H2O-6e—=Al2O3+6H+
D
12.常温下,用 0.1000mol/L NaOH 溶液滴定 20.00mL 0.1000mol/L HCl 溶液,滴定曲线
如图所示,下列说法不正确的是
A.a=20.00
B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C.若将盐酸换成相同浓度的醋酸,则滴定到 pH=7 时,a<20.00
D.若用酚酞作指示剂,当滴定到溶液明显由无色变为浅红色时立即停止滴定
13.下列选项中,微粒的物质的量浓度关系正确的是
A.0.1 mol/L K2CO3 溶液:c(OH-)=c(HCO3
-)+c(H+)+c(H2CO3)
B.0.1 mol/L NaHCO3 溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3
-)+c(H2CO3)
C.等物质的量的一元弱酸 HX 与其钾盐 KX 的混合溶液中:2c(K+)= c(HX)+c(X
-)
D.浓度均为 0.1 mol/L 的 NaHCO3 溶液和 NaOH 溶液等体积混合:c(Na+)+ c(H+)
=c(CO32-)+c(OH-)+c(HCO3
-)
14.人工光合作用能够借助太阳能,用 CO2 和 H2O 制备化学原料。下图是通过人工光
合作用制备 HCOOH 的原理示意图,下列说法不正确的是
A.该过程是将太阳能转化为化学能的过程
B.催化剂 a 表面发生氧化反应,有 O2 产生
C.催化剂 a 附近酸性减弱,催化剂 b 附近酸性增强
D.催化剂 b 表面的反应是 CO2+2H++2e 一=HCOOH
第 II 卷(非选择题)
请点击修改第 II 卷的文字说明
评卷人 得分
二、实验题
15.(题文)氯碱工业中电解饱和食盐水流程及原理示意图如下图所示。
(1)生成 H2 的电极反应式是_________________________________________。
(2)Na+向________(填“E”或“F”)方向移动,溶液 A 的溶质是______________。
(3)电解饱和食盐水总反应的离子方程式是_____________________________。
(4)常温下,将氯碱工业的附属产品盐酸与氨水等体积混合,两种溶液的浓度和混合
后所得溶液的 pH 如下表。
实验编号 氨水浓度/mol·L-1 盐酸浓度/mol·L-1 混合溶液 pH
① 0.1 0.1 pH=5
② c 0.2 pH=7
③ 0.2 0.1 pH>7
ⅰ. 实验①中所得混合溶液,由水电离出的 c(H+)=______ mol·L-1。
ⅱ. 实验②中,c______0.2(填“>”“<”或“=”)。
ⅲ. 实验③中所得混合溶液,各离子浓度由大到小的顺序是__________________。
ⅳ. 实验①、③所用氨水中的c(NH4 +)
c(NH3•H2O)
:①___________③(填“>”“<”或“=”)。
(5)氯在饮用水处理中常用作杀菌剂,且 HClO 的杀菌能力比 ClO-强。25℃时氯气-
氯水体系中的 Cl2(aq)、HClO 和 ClO-分别在三者中所占分数(α)随 pH 变化的关系
如下图所示。
下列表述正确的是_______。
A.氯处理饮用水时,在夏季的杀菌效果比在冬季好
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5 时杀菌效果比 pH=6.5 时效果差
16.含有 K2Cr2O7 的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有 K2Cr2O7 的
废水并回收重铬酸,具体的流程如下:
已知:i. CaCr2O7、BaCr2O7 易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 CaSO4 CaCrO4 BaCrO4 BaSO4
溶度积 9.1 × 10− 6 2.30 × 10−2 1.17 × 10−10 1.08 × 10−10
ii. Cr2O72-+ H2O 2 CrO42-+ 2H+
(1)向滤液 1 中加入 BaCl2·H2O 的目的,是使 CrO42-从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用是_______________________________。
②结合表中数据,说明选用 Ba2+而不选用 Ca2+处理废水的理由是________________。
③研究温度对 CrO42-沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度
下 CrO42-的沉淀率 沉淀率 =
固体 2 中 CrO4
2−的量
滤液 1 中 CrO4
2−的量 × 100% ,
如下图所示。
已知:BaCrO4(s) Ba2+ (aq) + CrO42-(aq)
CrO42-的沉淀效率随温度变化的原因是___________________________________。
(2)向固体 2 中加入硫酸,回收重铬酸。
① 硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用
0.450 mol/L 的硫酸时,重铬酸的回收率明显高于使用 0.225 mol/L 的硫酸的原因是
_________________________________。
② 回收重铬酸的原理如下图(右)所示。当硫酸浓度高于 0.450 mol/L 时,重铬酸的回
收率没有明显变化,其原因是_______________________________。
(3)综上所述,沉淀 BaCrO4 并进一步回收重铬酸的效果与___________有关。
评卷人 得分
三、综合题
17.工业上由 N2、H2 合成 NH3。制备 H2 需经多步完成,其中“水煤气(CO、H2)变换”
是纯化 H2 的关键一步。
(1)水煤气变换:CO(g)+ H2O(g) CO2(g) + H2(g),该反应的∆H = +41 kJ/mol
或﹣41 kJ/mol。
① 平衡常数 K 随温度变化如下:
温度/℃ 200 300 400
K 290 39 11.7
下列分析正确的是__________。
a. 水煤气变换反应的∆H<0
b. 增大压强,可以提高 CO 的平衡转化率
c. 增大水蒸气浓度,可以同时增大 CO 的平衡转化率和反应速率
② 温度为 T1 时,向容积为 2 L 的密闭容器甲、乙中分别充入一定量的 CO 和 H2O(g),
相关数据如下:
容器 甲 乙
反应物 CO H2O CO H2O
起始时物质的量(mol) 1.2 0.6 2.4 1.2
平衡时物质的量(mol) 0.8 0.2 a b
达到平衡的时间(min) t 1 t 2
ⅰ. 甲容器中,反应在 t1 min 内的平均反应速率 v(H2)=_____mol/(L·min)。
ⅱ. 甲容器中,平衡时,反应的热量变化为_____kJ。
ⅲ. T1 时,反应的平衡常数 K 甲= ______。
ⅳ. 乙容器中,a =______mol。
(2)以氨水为吸收剂脱除 CO2。当其失去吸收能力时,通过加热使吸收剂再生。用化
学方程式表示“吸收”过程:___________________________________。
(3)2016 年我国某科研团队利用透氧膜,一步即获得 N2、H2,工作原理如图所示。(空
气中 N2 与 O2 的物质的量之比按 4:1 计)。
① 起还原作用的物质是_______。
② 膜Ⅰ侧发生的电极反应式是_______。
18.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如
下:
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550 kJ·mol-1
它由两步反应组成:i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177 kJ·mol-1 ii. SO3
(g)分解。
L(L1、L2)、X 可分别代表压强和温度。下图表示 L 一定时,ii 中 SO3(g)的平衡转化
率随 X 的变化关系。
① X 代表的物理量是_____________________。
② 判断 L1、L2 的大小关系是______________。
(2)反应Ⅱ:I-可以作为催化剂,可能的催化过程如下。
i. SO2+4I-+4H+=S↓+2I2+2H2O; ii. I2+2H2O+ SO2= SO42-+4H++2I-;
探究 i、ii 反应速率与 SO2 歧化反应速率的关系,实验如下:分别将 18 mL SO2 饱和溶
液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知:I2 易溶解在 KI 溶液中)
序号 A B C D
试剂组成 0.4 mol/L KI
a mol/LKI
0.2 mol/LH2SO4
0.2 mol/L
H2SO4
0.2 mol/L KI
0.0002 mol I2
实验现象
溶液变黄,一段
时间后出现浑浊
溶液变黄,出现浑
浊较 A 快
无明显现象
溶液由棕褐色很快
褪色,变成黄色,出
现浑浊较 A 快
① B 是 A 的对比实验,则 a=__________。
② 比较 A、B、C,可得出的结论是_______________________________。
③ 实验表明,SO2 的歧化反应速率 D>A,结合 i、ii 反应速率解释原因:___________。
(3)在钠碱循环法中,Na2SO3 溶液作为吸收液吸收 SO2 的过程中,pH 随 n(SO32-):n
(HSO3-)变化关系如下表:
n(SO32-):n(HSO3
-) 91:9 1:1 1:91
pH 8.2 7.2 6.2
当吸收液的 pH 降至约为 6 时,需送至电解槽再生。再生示意图如下:
① 上表判断 NaHSO3 溶液显__________性,用化学平衡原理解释:_____________。
② HSO3
-在阳极放电的电极反应式是______,当阴极室中溶液 pH 升至 8 以上时,吸收
液再生并循环利用。简述再生原理________。
19.(题文)某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原
电池的电压越大。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原
电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 编号 电极 A 溶液 B 操作及现象
Ⅰ Fe pH=2 的 H2SO4
连接装置后,石墨表面产生无
色气泡;电压表指针偏转
Ⅱ Cu pH=2 的 H2SO4
连接装置后,石墨表面无明显
现象;电压表指针偏转,记录
读数为 a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是______________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是______________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________________。
(2)同学们仍用上述装置并用 Cu 和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及
影响 O2 氧化性的因素。
编号 溶液 B 操作及现象
Ⅲ
经煮沸的 pH=2 的
H2SO4
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,
记录读数为 b
Ⅳ pH=2 的 H2SO4
在石墨一侧缓慢通入 O2 并连接装置,电压表指针偏转,记
录读数为 c;取出电极,向溶液中加入数滴浓 Na2SO4 溶液
混合后,插入电极,保持 O2 通入,电压表读数仍为 c
Ⅴ pH=12 的 NaOH
在石墨一侧缓慢通入 O2 并连接装置,电压表指针偏转,记
录读数为 d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究________对 O2 氧化性的影响。
③实验Ⅳ中加入 Na2SO4 溶液的目的是_____________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,
其设计意图是________;重复实验时,记录电压表读数依次为 c′、d′,且 c′>d′,由此
得出的结论是______________________________。
参考答案
1.A
2.C
3.C
4.B
5.A
6.C
7.D
8.C
9.D
10.B
11.D
12.D
13.C
14.C
15.2H+ + 2e− = H2FNaOH2Cl-+2H2O H2↑+Cl2↑+2OH-10-5>c(NH4+)>c(Cl-)>c
(OH-)>c(H+)>C
16.沉淀 SO42-;调节溶液 pH,使 Cr2O72-转化为 CrO42-而沉淀 BaCrO4 比 CaCrO4 更难溶,
可以使 CrO42-沉淀更完全温度升高,沉淀速率加快 c(H2SO4)增大,则 c(SO42-)增大,
与 Ba2+生成沉淀,促进 BaCrO4 Ba2++CrO42-平衡右移,c(CrO42-)增大;同时,c(H+)
也增大,共同促进 Cr2O72-+H2O 2CrO42-+2H+平衡左移,有利于生成更多的
H2Cr2O7BaSO4 与 BaCrO4 溶解度接近,c(H2SO4)越大,越有利于生成 BaSO4,包裹在 BaCrO4
外,使其难于接触 H2SO4,阻碍重铬酸生成受到溶液 pH 、温度、H2SO4 浓度、BaCrO4 颗粒
大小等影响(其他答案合理给分)
17.a c0.2/t116.411.6NH3 ⋅ H2O + CO2 = NH4HCO3 CH4 H2O + 2e− = H2 + O2−、O2 + 4e− =
2O2−
18.压强 L2 >L10.4I−是 SO2 歧化反应的催化剂,H+单独存在时不具有催化作用,但 H+可以
加快歧化反应速率反应 ii 比 i 快;D 中由反应 ii 产生的 H+使反应 i 加快。酸 HSO3
-存在 HSO3
-⇌ H++SO32-和 HSO3
-+H2O⇌ H2SO3+OH-,HSO3
-的电离程度大于水解程度。HSO3
-+H2O
﹣2e-=SO42-+3H+氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使 HSO3
-电离
生成 SO32-,且钠离子进入阴极室,吸收液就可以再生。
19.2H+ + 2e-=H2↑在金属活动性顺序中,Cu 在 H 后,Cu 不能置换出 H2O2 + 4H+ + 4e-=2H2OO2
浓度越大,其氧化性越强,使电压值增大溶液的酸碱性排除溶液中的 Na+(或 SO42-)对实
验的可能干扰排除 Cu 在酸碱性不同的溶液中,其还原性不同对该实验结果的影响溶液酸性
越强,O2 的氧化性越强(介质或环境的 pH 影响物质的氧化性)