- 1.22 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020 年江苏高考化学模拟试题
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.
5 K 39 Ca 40 Cr 52 Fe 56 Cu 64 Ag 108 I 127
单项选择题:本题包括10 小题,每小题2 分,共计20 分。每小题只有一个选项符合题意。
1.中国科研提供抗疫“硬核力量”,在对新冠病毒的认识与防控中,化学知识起到了重要作
用。下列说法不正确的是
A.为了防止蛋白质变性,病毒疫苗一般需要冷藏存放
B.在选用酒精消毒时,75%的酒精溶液比 95%的杀菌效果好
C.新冠病毒 DNA 分子内存在氢键,氢键具有一定的方向性和饱和性
D.聚丙烯是生产医用口罩熔喷布的主要原料,其单体分子中碳原子均以 sp2 杂化
2.反应 Cl2+2NaOH=NaCl+NaClO+H2O,可用于工业上制取漂白精。下列表示反应中相关
微粒的化学用语正确的是
A.NaOH 的电子式:Na: :H B.中子数为 18 的 Cl 原子: Cl
C.Na 的结构示意图: D.NaClO 的水解方程式:ClO-+H2O=HClO+
OH-
3.下列物质性质与用途具有对应关系的是
A.氨气易液化,可用作制冷剂
B.溴化银具有感光性,可用于人工降雨
C.氯化铁具有氧化性,可用了自来水的杀菌消毒
D.氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多
4.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在水电离出的H+浓度为10X10-13mol·l-1:Na+、K+、 2
3CO 、 2AlO
B.使甲基橙呈红色的溶液中,可能大量存在的是: 4NH ,K+、ClO−、 2
4SO
C.某无色溶液中可能大量存在:Al3+、Ba2+、 3NO 、OH−
D.0.1 mol·L−1NH3·H2O溶液:K+、Fe3+、 4MnO 、SCN-
5.用下列实验装置进行相应的实验,能达到实验目的的是
A.图 I 用于实验室制氨气并收集干燥的氨气
B.图 II 用于除去 Cl2 中含有的少量 HCl
C.图 III 用于提取 I2 的 CCl4 溶液中的 I2
D.图 IV 用于检查碱式滴定管是否漏液
6.硫化氢的转化是资源利用和环境保护的重要研究课题。将 H2S 和空气的混合气体通入 FeCl2、
CuCl2 的混合溶液中反应回收 S,其物质转化如图所示。下列说法错误的是
A.在图示的转化中,Fe3+和 CuS 是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是 2H2S+O2 2S+2H2O
D.当有 1molH2S 转化为硫单质时,需要消耗 O2 的物质的量为 0.5mol
7.下列离子方程式书写正确旳是
A.碳酸氢铵和足量旳氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O
B.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+
C.用稀硝酸浸泡做过银镜反应旳试管:Ag+2H++NO3-=Ag++NO2↑+H2O
D.偏铝酸钠溶液中通入过量旳二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
8.短周期元素 W、X、Y 和 Z 的原子序数依次增大。W 的一种核素在考古时常用来鉴定一些
文物的年代,X2-和 Y2+具有相同的电子层结构,Z 原子的最外层电子数是其电子层数的 2
倍。下列说法错误..的是
A.X 的氢化物只含有极性共价键
B.Y 单质可通过电解 Y 的氯化物获得
C.W 与氢形成的原子比为 1︰1 的化合物有多种
D.W 与 Z 形成化合物 WZ2 中各原子均满足 8 电子稳定结构
9.在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe 2Cl点燃 FeCl2 NaOH(aq) Fe(OH)2
B.S 2O点燃 SO3
H O2 H2SO4
C.CaCO3 高温 CaO 2SiO高温 CaSiO3
D.NH3 2O催化剂,△
NO 2H O HNO3
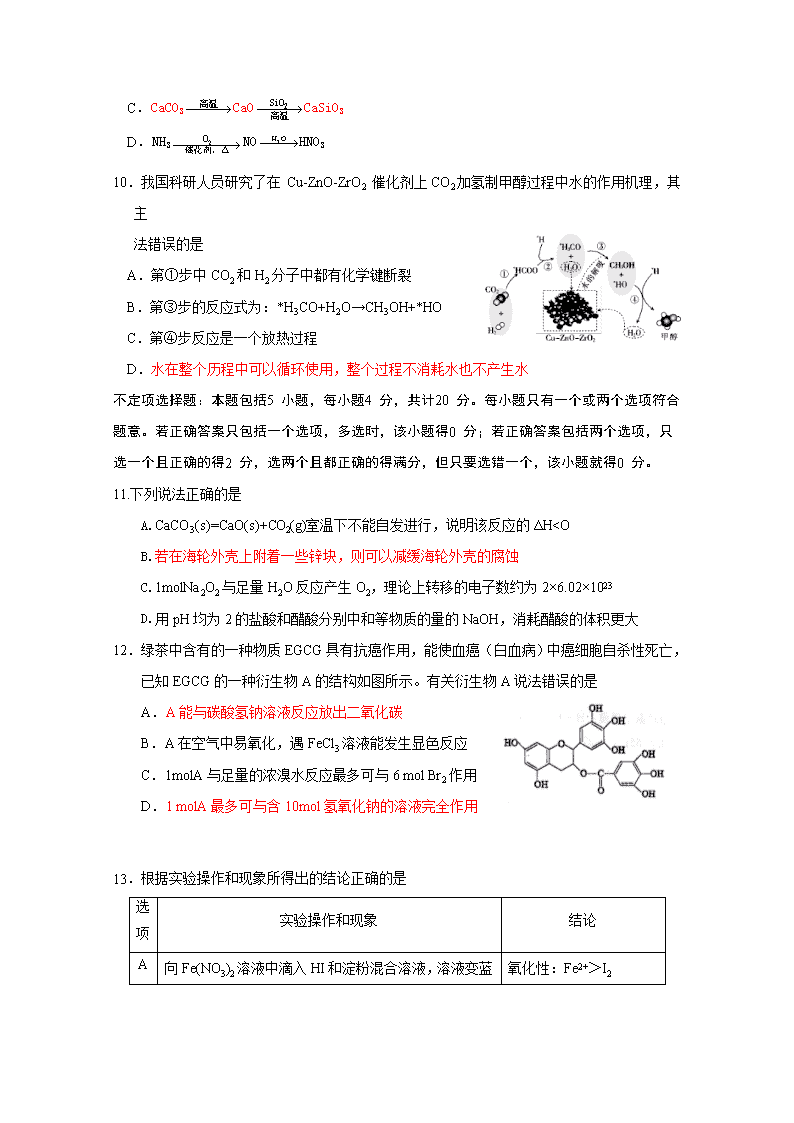
10.我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上 CO2 加氢制甲醇过程中水的作用机理,其
主
法错误的是
A.第①步中 CO2 和 H2 分子中都有化学键断裂
B.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
C.第④步反应是一个放热过程
D.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个.....选项符合
题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只
选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
11.下列说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH0
B.180℃,SO2去除率较高的主要原因是
SO2被γAl2O3吸附
C.500℃时,其他条件不变,采用高效
的催化剂可以提高SO2去除率
D.X点恒容下再通入CO、CO2各0.1 mol,达到平衡前v(正)>v(逆)
16.(12 分)草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为 Co2O3,含
少量 Ni、Fe、Al2O3、CaO、炭及有机物等)制取 CoC2O4 的工艺流程如下:
滤液B
RH (NH4)2C2O4
水层
有机溶剂
滤液A
CaF2
过量的 NaF溶液
浸出液B
NaOH溶液
碱浸
浸出液A
H2SO4 NaHSO3 H2O2 CoO
滤渣A 滤渣B
钴浸出焙烧含钴
废料
草酸钴
晶体
己知:①草酸钴晶体难溶于水
X
②RH 为有机物,可用 RH、有机溶剂萃取出溶液
中的 Ni2+
③几种金属阳离子的氢氧化物沉淀时的 PH 如右表所
示:
(1)“焙烧”的目的 ▲ 。
(2)“碱浸”过程中 Al2O3 发生反应的化学方程式为 ▲ 。
(3) 经硫酸酸化后,“钴浸出”过程中 Co3+转化为 Co2+的离子方程式为 ▲ 。
(4)“浸出液 B”中加入 CoO 并调节 pH 值至 3.7~7.1 的目的为 ▲ 。
(5) 加入 NaF 溶液可将钙离子转化为沉淀并过滤除去,若所得滤液中 c(F - )=1.0×10 - 2
mol·L−1,则滤液中 c(Ca2+)为 ▲ mol·L−1[已知 Ksp(CaF2)=1.05×10-10]。
(6) 萃取后水层中含有大量的 Co2+,将水层与酸性 KMnO4 溶液充分混合生成 Co3+、Mn2+,
理论上完全反应消耗的 n(Co2+)∶n(MnO4
-)= ▲ 。
17.(15 分)化合物 F 是合成一种增强记忆力药物的重要中间体,其合成路线如下:
(1)E 中的含氧官能团名称为 ▲ 。(写一种)
(2)A→B 的反应类型为 ▲ 。
(3)写出同时满足下列条件的 B 的一种同分异构体的结构简式: ▲ 。
①为α-氨基酸;②苯环上有 4 个取代基;③有 6 种不同化学环境的氢。
(4)C 转为 D 生成的另一种产物的结构简式为 ▲ 。
(5)已知:R—Br R—CN
请写出以苯甲醇( )和 为原料
制备有机物 X(结构如右图)的合成路线流程图(无机试剂
任用,合成路线流程图示例见本题题干)。
18.(12 分)在碱性条件下使用鸟粪石[Mgx(NH4)y(PO4)z·nH2O]处理氨氮废水具有加热时间短,
Fe3+ Co2+
开始沉淀时 1.9 7.1
沉淀完全时 3.7 9.1
X
△
氨逸出彻底等优点。反应原理如下:
yNa++yOH-+Mgx(NH4)y(PO4)z·nH2O Mgx(Na)y(PO4)z+yNH3↑+(n+y)H2O
Mgx(Na)y(PO4)z+yNH4++nH2O yNa++Mgx(NH4)y(PO4)z·nH2O↓
(1)上述氨氮废水处理过程中鸟粪石所起的作用是 。
(2)其它条件不变,若鸟粪石化学式中的 z 保持不变,x 越大,处理相同量的氨氮废水所需
的时间就 (填:“越长”“越短”“不变”)。
(3)为测定鸟粪石的组成,进行下列实验:
①取鸟粪石 2.45 g 与足量的 NaOH 溶液混合,加热,收集到标准状况下的气体 224mL
②另取鸟粪石 2.45 g 溶于稍过量盐酸,用蒸馏水配成 100.00 mL 溶液 A;
③取 25.00 mL 溶液 A,调节 pH=10,用浓度为 0.1000 mol·L-1 的 EDTA 标准溶液滴定
Mg2+,滴定至终点,消耗 EDTA 标准溶液 25 mL(已知 Mg2+与 EDTA 反应的化学计量
比 1∶1);
④取 25.00 mL 溶液 A,加入 0.005mol 的 BiCl3,调节溶液 pH 生成 Mg 3 (PO 4 ) 2 和 BiPO4
沉淀,过滤,滤液中的 Bi3+用 EDTA 标准溶液滴定为 mol。通过计算确定鸟粪石的
化学式(写出计算过程)。
19.(15 分)以 AlCl3、工业 V2O5(纯度为 96%)为原料,低温提纯制备高纯 V2O5,其主要
实验流程如下:
工业级
V2O5
氯化
无水AlCl3
氨解沉钒
NH4Cl、盐酸
过滤
滤液
煅烧 高纯
V2O5
已知:①无水 AlCl3 升华温度约 170℃,在空气中会吸水部分水解。
②VOCl3(三氯氧钒)熔点约 78 ℃,沸点约 127 ℃,易水解生成 V2O5。
③V2O5 易溶于碱生成 VO-
3 (偏钒酸盐),溶于强酸生成
VO+
2 (氧基钒离子)。
(1)“氯化”产物为 VOCl3 和 Al2O3,装置如图 1 所示。
向反应装置中不断通入氩气的目的是 ▲ ;反应温度
采用 160℃左右的原因是 ▲ 。
(2)“沉钒”时控制温度为 35 ℃、pH 约为 1,VOCl3 转化为
(NH4)2V6O16(多钒酸铵),其离子方程式为 ▲ 。
(3)“煅烧”时为避免生成的 NH3 将产物还原,需采取的措施
是 ▲ 。
△
240
1
图 1
(4)氨解沉钒时也可将 VOCl3 与氨水作用,生成 NH4VO3(为避免反应过于剧烈,需先将一
定量 VOCl3 溶解于水中配制成钒溶液)。沉钒率与钒溶液浓度、氨解温度的关系分别如
图 2、图 3 所示。
①钒溶液中会存在少量颗粒状沉淀,其可能成分为 ▲ (填化学式)。
②为确定较适宜的沉钒条件,请结合上图曲线,补充完整“探究氨水浓度对沉钒率的影
响”的实验方案: ▲ ,使用专用仪器测定并计算沉钒率。
(实验中可供选择的试剂:50 g·L-1 的钒溶液、10 g·L-1 的钒溶液、25 %的优级纯氨水、
高纯水)
20.(14分)废铅蓄电池的回收中产生大量的铅膏,回收利用铅膏能有效减少铅污染,充分利
用铅资源。
(1)铅膏制备PbO。铅膏经过预处理后(主要成分为PbSO4)加入Na2CO3溶液,使之转化为
PbCO3,然后充分灼烧得到PbO。
①PbCO3分解产生aPbCO3•bPbO中间产物。PbCO3和PbSO4加热升温过程中固体的质量变
化见图1。PbCO3在300 ℃时分解的产物为 ▲ 。
图 3图 2
剩
余
固
体
质
量
/
g
200 400 400 600 800 1000 1200
温度/℃
PbSO4909
801
757
735
713
669
PbCO3
图 1
②工业上用 PbCO3 热分解制备的 PbO 而不直接热分解 PbSO4 制备的 PbO 的原因是
▲ 。
(2)沉淀除铅。铅膏经过转化后得到含铅的 Na2SO4 废液,需要进一步除去废水中的铅。
①常温下,该废液中 SO 2-
4 浓度为 0.01 mol·L−1,则该废液中 Pb2+浓度最大为▲ 。
[Ksp(PbSO4)=1.8×10−8]
②随温度升高和 SO 2-
4 浓度增大废液中 Pb2+浓度显著增大,所以工业通常采用向废液
中加入 Na2CO3、NaHCO3 或 NaOH 等碱性沉淀剂产生 Pb(OH)2 沉淀除铅。废液随着
pH 的变化生成 Pb(OH)2 的质量如图 2。
向含铅废液中投放 NaHCO3 发生的离子方程式为 ▲ 。在实际生产中采用
NaHCO3 或 Na2CO3 沉铅,不采用 NaOH 的原因是 ▲ 。
图 2 图 3
(3)电化学除铅。利用脉冲电源(间歇性通入电流)电解法转化废液中的 Pb2+实现铅资源化
利用,可以提高除铅效率(除铅效率与 Pb2+浓度有关),其原理示意图 3。
①写出阳极的电极反应式: ▲ 。
②采用脉冲电解比普通电源电解的优点是 ▲ 。
21.黄铜矿是工业冶炼铜的原料,主要成分为 CuFeS2。试回答下列问题:
(1)基态 Cu 原子的核外电子排布式为________;Cu、Zn 的第二电离能大小 I2(Cu)________(填
“>”“<”或“=”)I2(Zn)。
(2)SO2 分子中分子空间构型为________;与 SO2 互为等电子体的阴离子有________(写一种)。
(3)[Cr(H2O)4Br2]Br2H2O 中心离子配位数为_______
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,
其晶胞结构如图所示。晶胞距离 Mg 原子最近 Mg 数目
阳离子交换膜
石墨
脉冲电源
铜片
NaNO3 溶
液 含铅废水
6 8 10 12 14
pH
P
b
(
O
H
)
2
的
质
量
/
g
为____________
参考答案
1-5 DCACA
6-10 BBACD
11-15 B AD BC CD B
16.(12 分)每空 2 分
(1)除去炭和有机物
(2)Al2O3 + 2NaOH =2NaAlO2 + H2O
(3)2Co3+ + HSO3- + H2O = 2Co2+ + SO42- + 3H+
(4)除去 Fe3+(或者使 Fe3+完全转化为 Fe(OH)3 沉淀)
(5)1.05×10-6
(6)5:1
17.答案:(1) 酯基或酰胺键 (2)取代反应
(3)
(4)CH3CH2OH
(5)
18.(12 分)
(1)催化剂(2 分)
(2)越长(2 分)
(3)n(NH4+)=n(NH3)=0.224L/22.4L·mol-1=0.01mol(1 分)
n(Mg2+)=n(EDTA)
mL
mL
00.25
00.100
HBr
△
NaCN
NaH
H2
雷尼镍
=0.1000 mol·L-1×25.00 mL×10-3 L·mL-1
mL
mL
00.25
00.100 =0.01mol
(2 分)
n(PO43-)=0.01mol×
3
2 +(0.005mol- mol)×4=0.01mol(1 分)
n(H2O)=
1
111
18
9501.02401.01801.045.2
molg
molgmolmolgmolmolgmolg
=0.06mol(2 分)
n(NH4+):n(Mg2+): n(PO43 - ):n(H2O) = 0.01mol:0.01mol:0.01mol:0.06mol =
1:1:1:6(1 分)
化学式为 MgNH4PO4·6H2O (1 分)
19.答案:(1)①PbCO3·PbO ②PbSO4分解温度高,消耗能量多;产生硫的氧化物污染大
(2)①1.8×10−6 mol·L-1
②2HCO-3+ Pb2+=pb(OH)2↓+ 2CO2↑
NaOH碱性强容易与Pb(OH)2反应使其溶解,而Na2CO3溶液碱性弱容易控制pH,
从而最大限度的使铅沉淀
(3)① 4OH− +4e−=O2↑+2H2O
②可以让阴阳离子充分的移到阳极和阴极附近,电极区相关离子浓度更大,有利
于电解
20.【答案】(1)排除装置中的水蒸气 该温度下反应能发生,同时将生成的 VOCl3 及时蒸
出分离,又避免 AlCl3 升华混入杂质
(2)6VOCl3 + 2NH+
4 + 10H2O = (NH4)2V6O16 + 18Cl- + 20H+
(3)在空气中进行,并不断搅拌
(4)①V2O5
②取数份等体积、50 g·L-1 的钒溶液,分别加入不同体积 25 %的优级纯氨水,再加
入高纯水使各组溶液总体积相等,水浴加热控制反应温度均为 35 ℃(或
35-55 ℃),充分反应相同的时间(或 1-2 h)
21.答案:(1)【Ar】3d104s1 >
(2) V 型 NO2-
(3)6 (4) 12
240
1