- 474.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
安徽省蚌埠市教师2020届高三化学“我为高考命题”仿真模拟试题(蚌埠一中6)
可能用到的相对原子质量:H- 1 C -12 N- 14 O -16 Na -23 Mg
-24 Al -27 P- 31 S -32 Cl -35.5 Ca -40 Ba -137.3 一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的四个选项 中,只有一项是符合题目要求的。
7、2019 年 7 月 1 日,上海正式开始实施垃扱分类,下列说法正确的是( ) A.回收油烟机费油用于提取食用油
B.对废油脂进行处理可获取氨基酸 C.回收旧报纸用于生产再生纸 D.废旧电池含重金属属于有害垃圾须深度填埋
8、下列化学用语表述正确的是( )
A.CO2 的 电 子 式 为 B.水的比例模型为 C.乙烯的结构简式为 CH2CH2 D.次氯酸的结构式为 H-O-Cl
9、轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由碳、氢、氧三种元
素组成,其球棍模型如图所示,下列对该化合物的说法中,正确的是( )
A. 不能使酸性高锰酸钾褪色
B. 最多有十个原子在同一平面内
C. 链状同分异构体中,属于羧酸的有 2 种 D. 既能发生加聚反应,又能发生缩聚反应
10、用下列实验目的或装置进行相应实验,正确的是( )
8
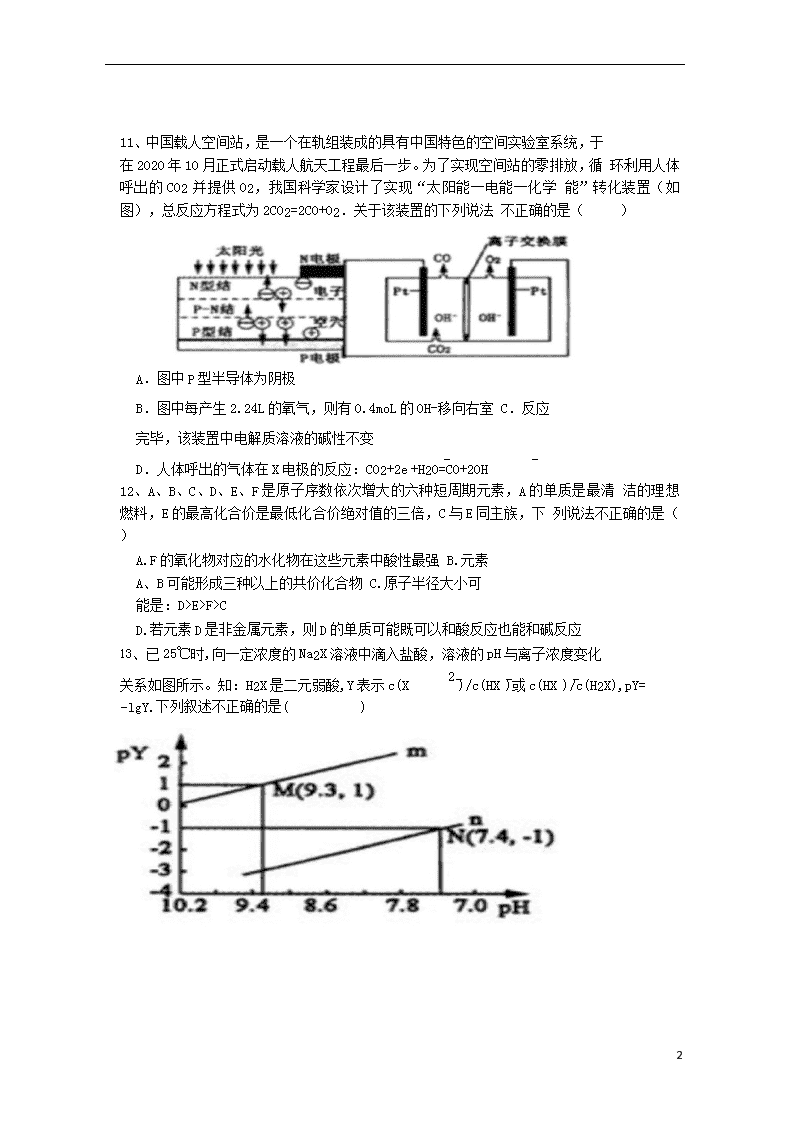
11、中国载人空间站,是一个在轨组装成的具有中国特色的空间实验室系统,于
在 2020 年 10 月正式启动载人航天工程最后一步。为了实现空间站的零排放,循 环利用人体呼出的 CO2 并提供 O2,我国科学家设计了实现“太阳能一电能一化学 能”转化装置(如图),总反应方程式为 2CO2=2CO+O2.关于该装置的下列说法 不正确的是( )
A.图中 P 型半导体为阴极
B.图中每产生 2.24L 的氧气,则有 0.4moL 的 OH-移向右室 C.反应完毕,该装置中电解质溶液的碱性不变
- -
D.人体呼出的气体在 X 电极的反应:CO2+2e +H2O=CO+2OH
12、A、B、C、D、E、F 是原子序数依次增大的六种短周期元素,A 的单质是最清 洁的理想燃料,E 的最高化合价是最低化合价绝对值的三倍,C 与 E 同主族,下 列说法不正确的是( )
A.F 的氧化物对应的水化物在这些元素中酸性最强 B.元素 A、B 可能形成三种以上的共价化合物 C.原子半径大小可能是:D>E>F>C
D.若元素 D 是非金属元素,则 D 的单质可能既可以和酸反应也能和碱反应
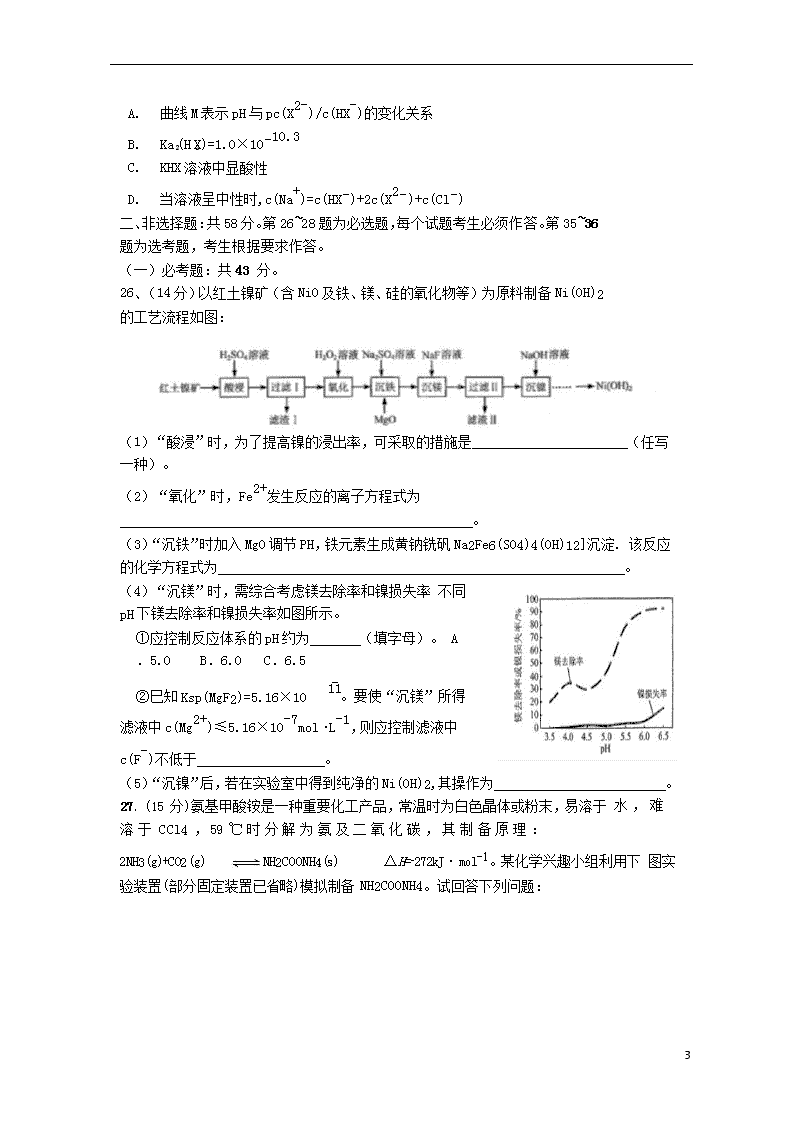
13、已 25℃时,向一定浓度的 Na2X 溶液中滴入盐酸,溶液的 pH 与离子浓度变化
2− − −
8
关系如图所示。知:H2X 是二元弱酸,Y 表示 c(X
−lgY.下列叙述不正确的是( )
)/c(HX )或 c(HX )/c(H2X),pY=
8
8
A. 曲线 M 表示 pH 与 pc(X2-)/c(HX-)的变化关系
2 2
B. Ka (H X)=1.0×10−10.3
C. KHX 溶液中显酸性
D. 当溶液呈中性时,c(Na+)=c(HX−)+2c(X2−)+c(Cl−)
二、非选择题:共 58 分。第 26~28 题为必选题,每个试题考生必须作答。第 35~36
题为选考题,考生根据要求作答。
(一)必考题:共 43 分。
26、(14 分)以红土镍矿(含 NiO 及铁、镁、硅的氧化物等)为原料制备 Ni(OH)2
的工艺流程如图:
(1)“酸浸”时,为了提高镍的浸出率,可采取的措施是 (任写 一种)。
(2)“氧化”时,Fe2+发生反应的离子方程式为
。
(3)“沉铁”时加入 MgO 调节 PH,铁元素生成黄钠铣矾 Na2Fe6(SO4)4(OH)12]沉淀. 该反应的化学方程式为 。
(4)“沉镁”时,需综合考虑镁去除率和镍损失率 不同 pH 下镁去除率和镍损失率如图所示。
①应控制反应体系的 pH 约为 (填字母)。 A.5.0 B.6.0 C.6.5
-11
8
②巳知 Ksp(MgF2)=5.16×10
。要使“沉镁”所得
8
滤液中 c(Mg2+)≤5.16×10-7mol·L-1,则应控制滤液中
c(F-)不低于 。
(5)“沉镍”后,若在实验室中得到纯净的 Ni(OH)2,其操作为 。
27.(15 分)氨基甲酸铵是一种重要化工产品,常温时为白色晶体或粉末,易溶于 水 , 难 溶 于 CCl4 , 59 ℃ 时 分 解 为 氨 及 二 氧 化 碳 , 其 制 备 原 理 :
2NH3(g)+CO2(g) NH2COONH4(s) ΔH=-272kJ·mol−1。某化学兴趣小组利用下 图实验装置(部分固定装置已省略)模拟制备 NH2COONH4。试回答下列问题:
8
(1)仪器组装完毕后,首先应进行的操作是 ,仪器 a 的名称是
。
(2)装置 A 用于实验室制取 NH2COONH4 的原料气体之一,该反应的化学方 程式为 。
(3)装置 G 中试剂的名称为 ,其作用是 。
(4 )为提高原料气的利用率,应控制装置 C 和 E 中最佳鼓泡速率比为
,装置 D 采用冰水浴的原因为 。
(5)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种杂质。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀 HNO3、BaCl2 溶液、澄清石灰水、AgNO3 溶液、稀 盐酸。
实验步骤
预期现象和结论
步骤 1:取少量固体样品于试管中,加入蒸馏 水至固体溶解。
得到无色溶液
步骤 2:向试管中加入过量的 BaCl2 溶液,静 置。
若溶液不变浑浊,证明固体中不 含碳酸铵。
步骤 3:向试管中继续加
,证明固体中有 碳酸氢铵。
②根据①的结论:取氨基甲酸铵样品 15.8 g,用足量氢氧化钡溶液充分处理 后,过滤、洗涤、干燥,测得沉淀质量为 1.97 g。则样品中氨基甲酸铵的质量分 数为 。
28.(14 分)二甲醚(DME)被誉为“21 世纪的清洁燃料”。由合成气制备二甲醚的
8
主要原理如下:
① CO(g)+2H2 (g) ® CH3OH(g)
② 2CH3OH(g) ® CH3OCH3 (g)+H2O(g)
③ CO(g)+H2O(g) ® CO2 (g)+H2 (g)
回答下列问题:
(1)反应④3H2 (g)+3CO(g) ® CH3OCH3 (g)+CO2 (g) 的 ΔH = 。 已知反应②在某温度下的平衡常数为 K=400。此温度下,在一恒容密闭容器
中加入 CH3OH(g),反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度(mol/L) 0.44 0.6 0.6
此时正、逆反应速率的大小:v(正) v(逆) (填“>"、“<”或“=”) 。若加入 CH3OH 后 ,经 10min 反 应达 到 平衡 , 则反 应 从起 始 至 10min 内 反应 速率 v(CH3OCH3)= 。
(2)在不同温度下,按照相同物质的量投料,发生反应①。测得 CO 的平衡转化 率与“压强的关系如图 1 所示,下列说法正确的是 (填序号).
8
A 反应温度:
T1 > T2 >T3
8
8
B.混合气体密度:
r(x) > r(w)
8
8
C.混合气体平均摩尔质量:
M ( y) < M (z)
8
8
D.反应容器的体积关系:
V (w) > 2V ( y)
8
(3)采用一种新型的催化剂(主要成分是 Cu-Mn 合金),利用 CO 和 H2 制备二甲
8
n(Mn)
醚(DME)。由图 2 可知,催化剂中 n(Cu) 约为 时最有利于二甲醚的合成。
8
(4)高温时二甲醚蒸气发生分解反应:
CH3OCH3 ® CH4 +CO+H2 。迅速将二甲
8
醚引人一个 504℃的抽成真空的瓶中,在不同时刻测定瓶内压强 p 总如下表:
①该反应达到平衡状态时,二甲醚的转化率为 。
②该反应的平衡常数 Kp= 。(用平衡分压代替平衡浓度计算,分压=总 压 X 物质的量分数)
(5)一种以二甲醚作为燃料的燃料电池的工作原理如图 3 所示。其负极的电极 反应式为 。
(二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则 所做的第一题计分。
35.[化学---选修 3:物质结构与性质](15 分) 钙及其化合物在工业、建筑工程上和医药上用途很大,回答下列问题。
(1)Ca2+的电子排布式 ,Ca 的第一电离能 (填“大于” 或“小于”)Ge。
(2)Cr 和 Ca 属于同一周期,且核外电子构型相同,但金属 Cr 的熔沸点等都 比金属 Ca 高,原因是 。
(3)磷酸三钙 Ca3(PO4)2 可以补充人体缺少的钙以及矿物质,同时也是营养 蛋白质的重要成分之一,Ca3(PO4)2 中阴离子空间构型是 ,中心原 子的杂化方式为 。
图 A 图 B
(4)碳酸盐的热分解示意图如图 A 所示。 热分解度:CaCO3 (填“高于”或“低于”)BaCO3,原因是 。
8
从价键轨道看,CO2 分子内的化学键类型有 。
(5)在工业方面,萤石是氟的主要来源,能够提取制备氟元素及其各种化合 物,晶胞如图 B 所示,钙离子的配位数为 。已知晶胞参数为 545pm, 阿伏伽德罗常数用 NA 表示,则萤石的密度为 (列出计算式)。
36.[化学---选修 3:有机化学基础](15 分)
化合物 H(碘他拉酸)可用于 CT 检查 Ca、动静脉造影等,其一种合成路线 如下:
(1)A 的化学名称为
(2)C 中的含氧官能团名称为 和 。
(3)F-G 的反应类型为 。
(4)B C 所需试剂、条件分别为 。
(5)E 的分子式为 C9H8N2O5,E F 发生还原反应,写出 D E 的化学方程式:
。
(6)写出与 B 互为同分异构体的 M 且满足以下条件的结构简式: 。
①能发生银镜反应,1molM 可生成 4mol 银;
②可发生水解反应,且 1molM 可消耗 4mol 氢氧化钠
③苯环上有三个取代基,分子中只有 4 种不同化学环境的氢。
( 7 ) 泛 影 酸 丙 酯 是一种医学诊断剂,写出 以 CH3CH2CH2Cl、(CH3CO)2O 和为原 料制备泛影酸丙酯的
合成路线图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
8
参考答案:
7、C 8、D 9、B 10、A 11、B 12、C 13、C
26.(1)适当提高硫酸浓度;适当升高温度。
(2)2Fe2++H O +H+=2Fe3++2H O
2 2 2
(3)3Fe2(SO4)3+6MgO+6H2O+Na2SO4=Na2Fe6(SO4)4(OH)12+6MgSO4
(4)B (5)0.01mol·L-1 (6)过滤、洗涤、干燥
27.(1)检查装置气密性
(2)2NH4Cl+Ca(OH)2=加热=CaCl2+2NH3+2H2O (3)饱和碳酸氢钠溶液;除 CO2 中的氯化氢气体
(4)2:1;减低温度,有利于提高反应物转化率(或降低温度,防止产物分解
(5)①少量澄清石灰水;溶液变浑浊 ②80%
28(1). -246.1kJ·mol-1 ; > ; 0.08mol·L-1·min-1
(2)BD (3). 2.0 (4). 50% (5). 625 (kPa)2
8
(6).
CH OCH -12e- +3H O=2CO +12H+
8
3 3 2 2
35.(1)[Ar]或 1s22s22p63s23p6 ; 小于
(2)Cr 的原子半径较小且价电子较多,金属性较强 (3)正四面体 ;sp3
(4)低于;Ca2+半径比 Ba2+半径小,钙离子对氧离子的吸引作用较强;σ键、π键
(5)8;
36.(1)间苯二甲酸 (2)酯基、硝基 (3)取代反应
(4)浓硫酸、甲醇、加热 (5) (6) (6)
8
相关文档
- 2020届二轮复习考前仿真模拟(七)课2021-07-0563页
- 安徽省蚌埠市教师2020届高三化学“2021-07-0522页
- 安徽省蚌埠市教师2020届高三化学“2021-07-0512页
- 安徽蚌埠市教师2020届高三仿真模拟2021-07-0511页
- 2020年高考化学二轮复习第二部分考2021-07-0513页
- 安徽省蚌埠市教师2020届高三仿真模2021-07-058页
- 浙江省杭州高级中学2020届高三仿真2021-07-0213页
- 2020年高考化学二轮复习第二部分考2021-07-0215页
- 2020年高考化学二轮复习第二部分考2021-07-0215页
- 安徽省蚌埠市教师2020届高三化学“2021-07-0211页