- 554.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
安徽省蚌埠市教师2020届高三化学“我为高考命题”仿真模拟试题(蚌埠一中8)
第Ⅰ卷(选择题 共 42 分)
可能用到的相对原子质量:H-1 O-16 Al-27 S-32 Cl-35.5 K-39
一、选择题 :本部分共 7 小题,每小题 6 分,共 42 分。在每小题给出的四个选项中,只 有一项是符合题目要求的。
7.(原创题)电子垃圾,指废弃不在使用的电器电子产品,主要包括废弃电脑、移动通讯产品、 电视机、电冰箱等废旧设备及其零部件。下列说法正确的是( ) A.电子废料中含有金属铝,可通过电解氯化铝制取。 B.二氧化硅为重要的半导体材料,大量用于制造各种半导体器件、元件以及其它仪器设备。 C.印刷电路板中的发生的化学反应是氯化铁与铜的置换反应。 D.从显示器中回收的玻璃属于使用量较大的无机非金属材料。
8.已知 NA 是阿伏伽德罗常数的值,下列说法正确的是( )
-
2
A.1 L 0.1 mol∙L-1 NaHCO3 溶液中,含有的 HCO3
的数目为 0.1NA
2
B.标准状况下,22.4 L 的 HF 含有的质子数为 10NA
C.pH=1 的 CH3COOH 溶液中,所含 H+的数目等于 NA
D.32 g S8 分子结构中 含有的 S—S 键个数为 NA
O
2
9.(原创题)苦杏仁酸结构简式
OH
OH ,下列说法正确的是( )
2
A.苦杏仁酸中含有两个手性碳原子 B. 含有三种官能团
C. 1 mol 的苦杏仁酸最多可以消耗 1 molNaOH 溶液 D.苦杏仁酸可以发生消去反应
2
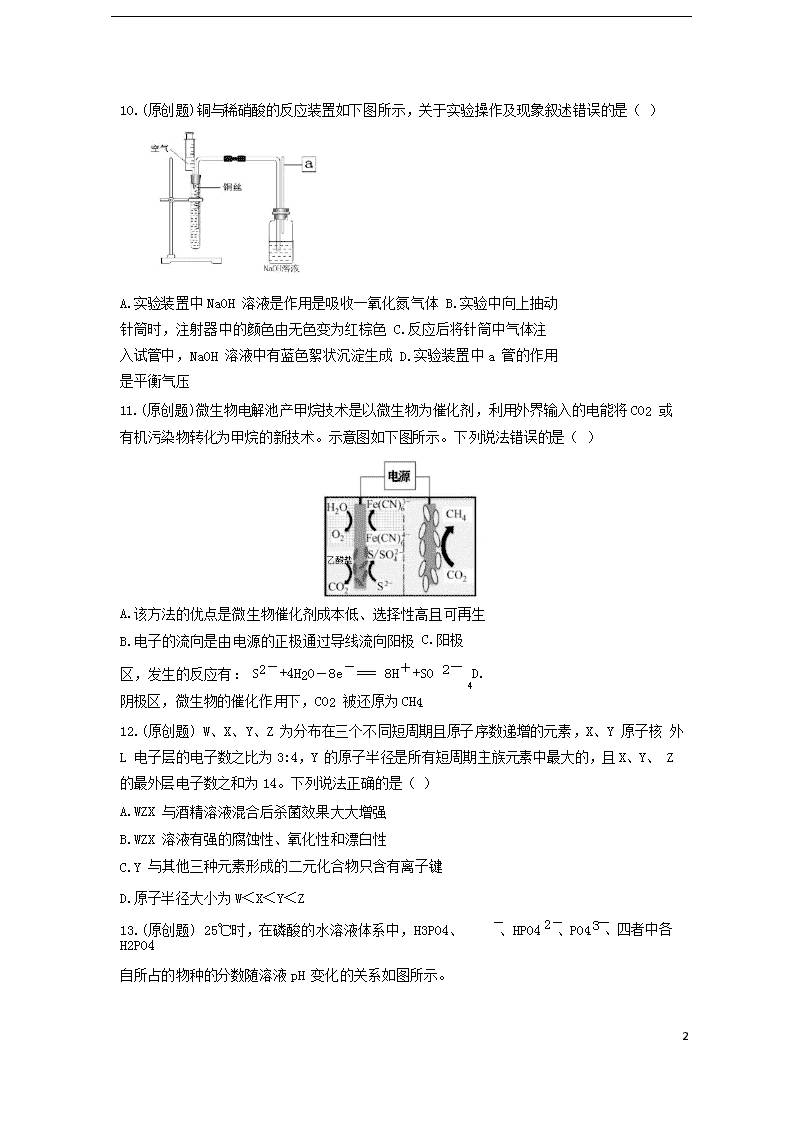
10.(原创题)铜与稀硝酸的反应装置如下图所示,关于实验操作及现象叙述错误的是( )
A.实验装置中 NaOH 溶液是作用是吸收一氧化氮气体 B.实验中向上抽动针筒时,注射器中的颜色由无色变为红棕色 C.反应后将针筒中气体注入试管中,NaOH 溶液中有蓝色絮状沉淀生成 D.实验装置中 a 管的作用是平衡气压
11.(原创题)微生物电解池产甲烷技术是以微生物为催化剂,利用外界输入的电能将 CO2 或 有机污染物转化为甲烷的新技术。示意图如下图所示。下列说法错误的是( )
4
A.该方法的优点是微生物催化剂成本低、选择性高且可再生 B.电子的流向是由电源的正极通过导线流向阳极 C.阳极区,发生的反应有: S2-+4H2O-8e-==== 8H++SO 2- D.阴极区,微生物的催化作用下,CO2 被还原为 CH4
12.(原创题) W、X、Y、Z 为分布在三个不同短周期且原子序数递增的元素,X、Y 原子核 外 L 电子层的电子数之比为 3:4,Y 的原子半径是所有短周期主族元素中最大的,且 X、Y、 Z 的最外层电子数之和为 14。下列说法正确的是( )
A.WZX 与酒精溶液混合后杀菌效果大大增强
B.WZX 溶液有强的腐蚀性、氧化性和漂白性
C.Y 与其他三种元素形成的二元化合物只含有离子键
D.原子半径大小为 W<X<Y<Z
- 2- -
2
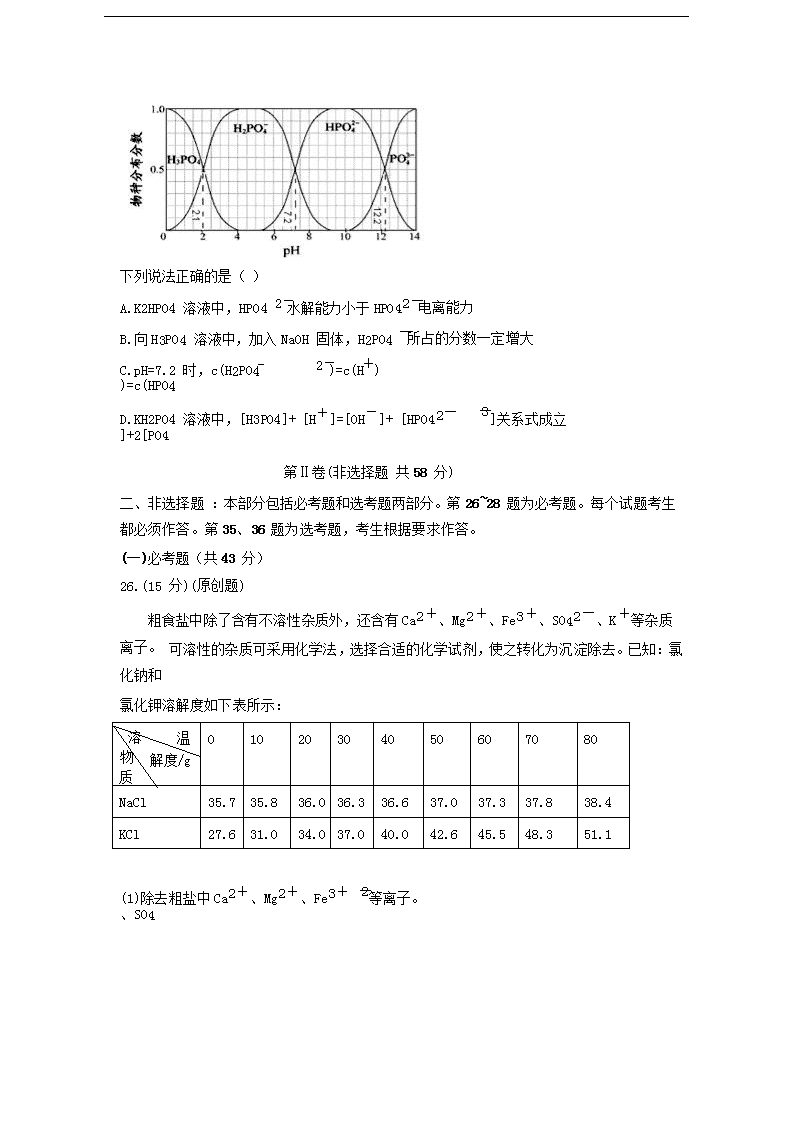
13.(原创题) 25℃时,在磷酸的水溶液体系中,H3PO4、H2PO4
、HPO4
、PO43
、四者中各
2
自所占的物种的分数随溶液 pH 变化的关系如图所示。
2
下列说法正确的是( )
2- -
A.K2HPO4 溶液中,HPO4
水解能力小于 HPO42
电离能力
-
B.向 H3PO4 溶液中,加入 NaOH 固体,H2PO4
所占的分数一定增大
- 2- +
C.pH=7.2 时,c(H2PO4 )=c(HPO4
)=c(H )
3-
D.KH2PO4 溶液中,[H3PO4]+ [H+]=[OH-]+ [HPO42-]+2[PO4
]关系式成立
第Ⅱ卷(非选择题 共 58 分)
二、非选择题 :本部分包括必考题和选考题两部分。第 26~28 题为必考题。每个试题考生 都必须作答。第 35、36 题为选考题,考生根据要求作答。
(一)必考题(共 43 分)
26.(15 分)(原创题)
粗食盐中除了含有不溶性杂质外,还含有 Ca2+、Mg2+、Fe3+、SO42-、K+等杂质离子。 可溶性的杂质可采用化学法,选择合适的化学试剂,使之转化为沉淀除去。已知:氯化钠和
氯化钾溶解度如下表所示:
溶 温 物 解度/g
质
0
10
20
30
40
50
60
70
80
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
KCl
27.6
31.0
34.0
37.0
40.0
42.6
45.5
48.3
51.1
2-
(1)除去粗盐中 Ca2+、Mg2+、Fe3+、SO4
等离子。
①本实验先加过量 BaCl2,再加 NaOH 和 Na2CO3 溶液,原因是
②NaOH 和 Na2CO3 均可与 Fe3+反应,写出 Na2CO3 与 Fe3+的离子方程式:
。
(2) 在提纯后的饱和 NaCl 的溶液中,仍然含有一定量的 K+,将含有 K+的饱和 NaCl 的溶液 倒入下图的洁净广口瓶 4 中,进行如下实验:
①实验前,需检验装置的气密性,具体的操作步骤: 。
②制备 HCl 气体:取一定量的较纯 NaCl,加入蒸馏烧瓶中,打开 1 中的旋塞,使浓硫酸慢 慢滴入蒸馏烧瓶中,待浓硫酸滴完后,即关闭旋塞,调节煤气灯的火焰以控制气体发生的速
率。写出制备 HCl 气体的方程式: 。
2. 蒸馏烧瓶 3.缓冲瓶 4.NaCl 饱和溶液 5.吸收瓶(内装 40%NaOH 溶液)6.稀 NaOH 溶液
③装置 1 的名称 。装置 4 中倒置漏斗的作用是 和 。
④待 NaCl 晶体不再析出时,即可停止通 HCl 气体,过滤,并用 95%的乙醇淋洗产品 2~3 次。 最后在水浴上把产品烤干,称重。
⑤通过下面步骤可以测定氯化钠产品中 Cl 的含量:
I.取 xg 产品于锥形瓶中,向锥形瓶中加入 0.1000 mol/L 的 AgNO3 溶液 40.00 mL,使 Cl-完 全沉淀。
II.再向锥形瓶中加入 20 mL 硝基苯,振荡,使沉淀表面被有机物覆盖; Ⅲ.然后加入指示剂,用 c mol /L NH4SCN 溶液滴定过量 Ag+至终点,记下所用体积 VmL。 (己知: Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10 -12)
i 滴定选用的指示剂是 (填标号)。
a.酚酞 b.淀粉 c.NH4Fe(SO4)2 d.甲基橙
ii 元素 Cl 的质量分数为(列出算式) 。
27. (14 分)(原创题)
明矾是一种重要的铝盐,用途很广,为了充分利用资源,变废为宝,在实验室中探究采 用易拉罐(主要成分铝和铁合金)来制备明矾,具体流程如下:
(1) 步骤①中的发生的化学方程式为 。
(2) 步骤②过滤得到的滤渣主要是成分是 。
(3)步骤④具体的实验操作是 ,经过抽滤、洗涤、干燥得到明矾晶体产品。
(4)在洗涤明矾晶体时,所用的最佳洗涤试剂是 (填字母)。
a.乙醇 b.热水 c. 硫酸溶液
(5)实验结果发现得到的产品的产率偏低,原因是 (写出一条即可)。 (6)采用热重分析法测定明矾晶体加热分解的产物,将样品加热,30~270℃时,失重 45.5%, 继续加热 680~810℃时,失重 70.1%。在 680~810℃间所发生的化学反应方程式为
。
28.(14 分)(改编题)
CO2 是主要的温室气体之一,同时也是自然界丰富的碳资源。开发和利用 CO2 资源具有 重要的意义。
(1) 研究表明 CO2 和 H2 在催化剂存在下可发生反应生成 CH3OH。己知部分反应的热化学方 程式如下:CH3OH(g)+3/2 O2(g)==== CO2(g)+H2O(l) ① △H1= -137.8 kJ•mol-1
H2(g)+1/2 O2(g)==== H2O(l) ② △H2= -285.8 kJ•mol-1
则 CO2(g)+3H2(g)==== CH3OH(g)+2H2O(l) ③ △H= kJ•mol-1。下列措施不能提高
CO2 转化为 CH3OH 的平衡转化率的有 (填字母)。
A.使用催化剂 B.增大体系压强 C.增大 CO2 和 H2 初始投料比
(2) 在 300℃、8MPa 下,将 CO2 和 H2 按物质的量之比 1:3 通入一密闭容器中发生③中反应, 达到平衡时,测得 CO2 的平衡转化率为 50%,则该反应条件下的平衡常数为 Kp= (用平 衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一定条件下,往 2L 恒容密闭容器中充入 1mol CO2 和 3 mol H2,在不同催化剂作用下发 生反应 I、反应Ⅱ与反应Ⅲ,相同时间内 CO2 的转化率随温度变化如下图所示:
①催化剂效果最佳的反应是 (填“反应 I”、“反应Ⅱ”、“反应Ⅲ”),使用催
化剂会使该反应的活化能 (填“增大”、“减少”或 “不变”),反应热(△H) (填 “增大”、“减少”或 “不变”)。
②b 点 v (正) v (逆) (填“>”,“<”, “=”)。
③若此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因是 。
(二)选考题(共 15 分,请考生从给出的 2 道题中任选一题做答)
35.(原创题)[化学—选修 3:物质结构与性质](15 分)
叶绿素是吡咯(C4H5N)的重要衍生物,叶绿素(含 Mg2+)可用于植物的光合作用。吡咯和 叶绿素的结构如下图:
H N
吡 咯
(1) 基态 Mg 原子核外电子占据的原子轨道数目为 ,叶绿素中不存在的作用力有 (填
代号)。 a.离子键 b.共价键 c.金属键 d.配位键
(2)1mol 吡咯分子中所含的σ键总数为 个。分子中的大π键可用πmn 表示,其中 m 代表参 与形成大π键的原子数,n 代表参与形成大π键的电子数,则吡略环中的大π键应表示为 。 (3)C、N、O、Mg 四种元素中,第一电离能由低到高的顺序为 (填化学式)。 (4)镁不同于很多金属,灼烧时火焰不特殊颜色。很多金属元素能产生焰色反应的微观原因
为 。
(5) Mg 是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物
NaF
MgF2
SiF4
熔点/K
1266
1534
183
解释表中氟化物熔点差异的原因: 。
(6)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
则铁镁合金的化学式为 ,棱上相邻的 Fe 原子之间的核间距为 d nm,则该合金的密度为
(不必化简,用 NA 表示阿伏加德罗常数)。
36. (原创题)[化学—选修 5:有机化学基础](15 分)
普罗帕酮,为广谱高效膜抑制性抗心律失常药。具有膜稳定作用及竞争性β受体阻滞作用。 能降低心肌兴奋性,延长动作电位时程及有效不应期,延长传导。普罗帕酮合成的一种途径 如图所示:
O
O H
O O CH3 AlCl C
3 B
O
O Cl
Pd/C H2 F
① ② OH
③ OH ④
A D E
O H2N CH
H
O ⑤
O
G
3 O
O HN CH3
OH
I
已知:
O
R CH3
+ R1-CHO
一 定 条 件 O
R R1
回答下列问题:
(1) C 的化学名称为 。
(2) B 的结构简式为 ;E 中所含官能团的名称是 。
(3) G→I 的反应类型是 ;B→D 的化学方程式为 。
(4)碳原子上连有 4 个不同原子或基团时,该碳称为手性碳,指出 I 中的手性碳原子,用星号
(*)标出 。
(5)化合物 W 与 B 互为同分异构体,且满足下列条件,W 的可能结构有 种。
①遇 FeCl3 溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应; 其中核磁共振氢谱显示有 5 种不同化学环境的氢,峰面积比为 2:2:2:1:1,写出符合要求的
W 的结构简式 。
O
(6)设计由苯和溴乙烷为原料制备
CH3
的合成路线
(无机试剂任选)。
蚌埠市我为高考命题化学学科试卷答案
一、选择题
题号
7
8
9
10
11
12
13
答案
D
D
C
A
B
B
D
二、非选择题 :本部分包括必考题和选考题两部分。第 26~28 题为必考题。每个试题考生
都必须作答。第 35、36 题为选考题,考生根据要求作答。
26.(15 分)
(1)①NaOH 和 Na2CO3 可除去过量的 Ba2+ ( 1 分)
2-
② 2Fe3++3CO3
+3H2O====2Fe(OH)3↓+3CO2↑ ( 2 分)
(2)①用双手掌紧贴烧瓶壁使烧瓶内气体温度上升,若吸收瓶导管内的液柱高度产生变化, 说明该装置不漏气。 ( 2 分)
②NaCl+H2SO4(浓)=NaHSO4+HCl↑(或 2NaCl+H2SO4(浓)=Na2SO4+2HCl↑)
③滴液漏斗或恒压漏斗 便于溶液更好的吸收 HCl 气体和防止溶液被倒吸
( 2 分)
( 1 分,2 分,共 3 分)
⑤i c ( 2 分)
ii —(4—×10-3-cV—×—10-3)×—35—.5 ×100% [ 或 3.55×(4-cV)
——— x ——
27.(14 分)
% ] ( 3 分)
x
(1)2Al+2KOH+2H2O====2KAlO2+3H2↑ (或 2Al+2KOH+6H2O====2K[Al(OH)4]+3H2↑ )
(3 分)
(2)铁 (2 分) (3)加热浓缩、冷却结晶 (2 分) (4) a (2 分) (5)易拉罐外皮含有杂质(部分明矾溶在水中未结晶;没有完全将产品从滤纸上刮下等均可
(2 分)
(6)2KAl(SO4)2 ==== K2SO4 + Al2O3 + 3SO3 (3 分)
28.(14 分)
参考答案:
(l) -719.6 AC (选对一个 1 分,多选不得分) (2 分,2 分,共 4 分) (2) 1/48 或 0.02 (2 分) (3) ①反应 I 减小 不变 (2 分 ,1 分,1 分,共 4 分)
②> (2 分)
③该反应为放热反应,温度升高,平衡逆向移动 (2 分)
35. (15 分)
(1)6 , c (1 分,1 分,共 2 分)
(2)10 NA ;
6 (2 分,2 分,共 4 分)
5
(3) Mg<C<O<N (2 分)
(4)电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量, 产生焰色反应 (2 分) (5) NaF 与 MgF2 为离子晶体,SiF4 为分子晶体,所以 NaF 与 MgF2 远比 SiF4 熔点要高,又因 为 Mg2+的半径小于 Na+的半径,所以 MgF2 的离子键强度大于 NaF 的离子键强度,故 MgF2 的熔点大于 NaF (2 分)
A
4 ´104
(6) Mg2Fe
d3 N
´10-21
(1 分,2 分,共 3 分)
36.(14 分)
(1)苯甲醛 (1 分)
(2)
OH O
CH3
羟基,羰基 (1 分,1 分,1 分,共 3 分)
(3)加成反应
OH O O CH3
一定条件 O OH
H2O
(1 分,2 分,共 3 分)
(4) (1 分)
(5)13 (2 分,2 分,共 4 分)
(6)
CH3CH2Br
FeBr3
CH3
NaOH溶液
光照
OH CH3
O
3
Cu / O2 CH
O
CH3
Pt/C H2
O
CH3
CH3CH2Br
NaOH溶液
CH3CH2OH
Cu / O2
CH3CHO
(3 分)
相关文档
- 安徽蚌埠市教师2020届高三仿真模拟2021-07-0511页
- 2020年高考化学二轮复习第二部分考2021-07-0513页
- 安徽省蚌埠市教师2020届高三仿真模2021-07-058页
- 浙江省杭州高级中学2020届高三仿真2021-07-0213页
- 2020年高考化学二轮复习第二部分考2021-07-0215页
- 2020年高考化学二轮复习第二部分考2021-07-0215页
- 安徽省蚌埠市教师2020届高三化学“2021-07-0211页
- 安徽蚌埠市教师2020届高三仿真模拟2021-07-0218页
- 安徽蚌埠市教师2020届高三仿真模拟2021-07-0214页
- 安徽省蚌埠市教师2020届高三仿真模2021-07-0216页